前列腺素F2α-PTGFR通路的激活对奶牛子宫内膜组织中生长因子表达的影响
2021-06-17张双翼李茜如赵佳敏巩志国
冯 爽,张双翼,李茜如,赵佳敏,巩志国,刘 博
(内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018)
子宫内膜位于子宫内壁,是由单层上皮细胞覆盖在间质基质上构成的复杂结构[1]。环氧合酶-2(cyclooxygenase-2,COX-2)可参与血管生成、子宫内膜细胞增殖和子宫内膜生长修复过程[2-3]。COX-2过表达可加速子宫内膜癌和子宫内膜异位症的发展,而COX-2抑制剂可减缓此过程[4-5]。COX-2可导致花生四烯酸转化为前列腺素H2(prostaglandin H2,PGH2),其中包括列腺素F2α(prostaglandin F2α,PGF2α)在内的多种前列腺素的共同前体。在家畜子宫内膜生长修复过程中,尚不清楚每种前列腺素所发挥的具体功能。
不同动物在发情期或妊娠早期,子宫内膜生长修复与PGF2α分泌、PGF2α合成酶(PGF2αsynthase,PGFS)和PGF2α受体(prostaglandin F2αreceptor,PTGFR)表达之间存在正相关关系[6-8]。PGF2α的浓度在月经期呈周期性变化,而PTGFR的表达在增殖期的人子宫内膜中呈上升趋势[9]。此外,PGF2α-PTGFR通路的激活可加速子宫内膜肿瘤的生长[10]。众所周知,雌二醇(estradiol,E2)对子宫内膜的生长和修复具有促进作用。有研究证明,17β-雌二醇可刺激家畜子宫内膜或输卵管中PGF2α、PGFS和PTGFR的合成或表达[8,11]。然而,PGF2α-PTGFR通路在子宫内膜生长修复中的具体作用仍不清楚。
在本试验中,通过实时荧光定量PCR、Western blot和组织免疫荧光染色等方法分析了在PGF2α-PTGFR通路被激活后,对体外培养的奶牛子宫内膜组织中参与子宫内膜修复的一系列生长因子,包括结缔组织生长因子(connective tissue growth factor,CTGF)、成纤维细胞生长因子-2(fibroblast growth factor 2,FGF-2)、转化生长因子-β1(transforming growth factor β1,TGF-β1)和血管内皮生长因子(vascular endothelial growth factor A,VEGFA)表达的影响。此外,分析了PGF2α-PTGFR通路对奶牛子宫内膜组织中能够代表细胞发生增殖的增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达的影响。上述试验可为阐明前列腺素类化合物在奶牛子宫内膜组织修复中的作用提供依据。
1 材料与方法
1.1 主要试剂、药品及抗体胎牛血清(FBS)购自ExCell Biology公司;DMEM/F-12购自GIBCO公司;氟前列醇(fluprostenol,PTGFR激动剂,可激活PGF2α-PTGFR通路)购自Cayman Chemical公司。总RNA提取剂量试剂盒购自Axygen公司;反转录试剂盒购自Thermo Scientific公司;实时荧光定量PCR试剂(FastStart Universal SYBR Green Master)购自Roche Applied Science公司。组织总蛋白提取试剂和BCA蛋白浓度检测试剂盒均购自Thermo Scientific公司;SDS-PAGE样品上样缓冲液购自Beyotime公司。
兔抗CTGF抗体购自GeneTex公司;鼠抗增殖细胞核抗原(PCNA)抗体、兔抗TGF-β1抗体、鼠抗β-actin抗体均购自Abcam公司;兔抗VEGFA抗体购自Santa Cruz Biotechnology公司;兔抗FGF-2抗体购自NovusBio公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗、HRP标记的山羊抗鼠IgG二抗均购自Cell Signaling Technology公司;Alexa Fluor 488偶联山羊抗鼠IgG H&L抗体、小鼠IgG同型对照(isotype)抗体均购自Abcam公司。使用的引物由Invitrogen公司合成。
1.2 奶牛子宫内膜组织的体外培养奶牛子宫内膜组织的体外培养按照本课题组先前报道的方法进行[12-13]。在屠宰场收集处于发情前期的健康荷斯坦奶牛双侧子宫角,置于冰上保存,2 h内转移至实验室做进一步处理。首先,用含100 IU/mL青链霉素和2.5 mg/L两性霉素B的磷酸盐缓冲液(PBS)清洗组织3次后置于4℃保存1 h。然后,在无菌条件下分离各个子宫角,使用弯剪刀和眼科镊子纵向切开子宫角,将子宫内膜组织取出。将子宫内膜组织再分为直径约2 mm、厚度约1 mm的小块,每孔8块组织,放入6孔细胞培养板中,加入5 mL含有20% FBS、100 IU/mL青链霉素和2.5 mg/L两性霉素B的培养基,置于含5% CO2的37℃培养箱中培养。每24 h更换1次培养液,培养5 d后待处理。
1.3 样品处理将培养5 d的子宫内膜组织块分组。在浓度梯度处理试验中,使用不同终浓度(10-9~10-5mol/L)的氟前列醇处理组织,并设置对照试验组,处理后提取mRNA(处理后4 h)和总蛋白(处理后12 h用于生长因子蛋白检测,处理后24 h用于PCNA蛋白表达检测),通过实时荧光定量PCR、Western blot分析生长因子和PCNA的表达情况。为了检测氟前列醇处理的时间依赖效应,使用终浓度为10-7mol/L的氟前列醇处理奶牛子宫内膜组织2~36 h,并设置对照试验组,在相应处理时间点分别提取mRNA和总蛋白,分析生长因子和PCNA的表达情况。使用终浓度为10-7mol/L的氟前列醇处理奶牛子宫内膜组织24 h,并设置对照试验组,随后使用OCT冰冻切片包埋剂进行包埋,并置于-80℃保存,通过组织免疫荧光染色分析PCNA在组织中的表达情况。
1.4 实时荧光定量PCR反应总mRNA提取、反转录和实时定量RT-PCR反应按照说明书进行操作。从奶牛子宫内膜组织提取的总RNA反转录为cDNA并进行扩增,步骤如下:在ABI ViiA 7实时荧光定量PCR系统(applied biosystems)上,50℃ 2 min,1个循环;95℃ 10 min,1个循环;95℃ 15 s,60℃ 60 s,共40个循环。使用的引物见表1。根据文献报导的方法,以持家基因β-actin作为内参照,使用2-ΔΔCt(ΔΔCt=ΔCt-ΔCt对照组,ΔCt=Ct目的基因-Ctβ-actin)的计算方法进行目的基因表达的统计与分析[14]。

表1 实时荧光定量反应引物序列
1.5 Western blot分析在本试验中使用Western blot方法对奶牛子宫内膜组织样本中蛋白的表达进行分析[13]。组织总蛋白的提取、浓度的测定及蛋白变性按说明书进行操作。将从试验组和对照组样品中提取的总蛋白进行变性后,置于―80℃冰箱储存备用。配制12% SDS-PAGE分离凝胶进行蛋白质电泳,每孔总蛋白加样量为30 μg。电泳程序如下:浓缩胶80 V电泳15 min,分离胶120 V电泳90 min。在40 V条件下进行膜转印30 min((Trans-Blot SD,Bio-Rad)。电泳完成后使用StartingBlockTM封闭液(Thermo Scientific)封闭膜1 h,然后在4℃条件下孵育一抗14 h。一抗稀释比例如下:CTGF、FGF-2、TGF-β1、PCNA和β-actin一抗稀释比例均为1∶1 000;VEGFA一抗稀释比例均为1∶250。一抗孵育完成后,用含Tween-20的Tris缓冲液(TBST)洗膜,室温孵育二抗(1∶8 000稀释)1 h。然后用TBST冲洗膜,使用Supersignal west femto化学发光底物(Thermo Scientific)和化学发光成像系统(GE Image-Quant-RT)进行图像的采集,根据得到的图像通过ImageJ(National Institutes of Health)软件对试验结果进行灰度分析。
1.6 免疫荧光分析按照本课题组先前报道的方法对奶牛子宫内膜组织样本中的目标蛋白进行免疫荧光染色[13]。将处理后的子宫内膜组织冰冻切片(厚度6 μm)在室温下解冻15 min,用预冷的丙酮固定10 min。然后切片用预冷的PBS冲洗,并用10%山羊血清室温封闭1 h。切片使用抗PCNA抗体(1∶1 000稀释)4℃孵育过夜。孵育完成后使用PBS洗涤3次,随后使用Alexa Fluor 488偶联山羊抗鼠IgG H&L抗体(1∶1 000稀释)室温孵育1 h。使用激光共聚焦显微镜(Zeiss LSM-800)检测荧光信号,并通过ImageJ软件计算荧光强度。

2 结果
2.1 不同浓度的氟前列醇对体外培养的奶牛子宫内膜组织中CTGF、FGF2、TGF-β1和VEGFA表达的影响使用不同终浓度(10-9~10-5mol/L)的PTGFR激动剂氟前列醇处理体外培养的奶牛子宫内膜组织后,分别通过实时荧光定量PCR和Western blot方法分析组织中CTGF、FGF-2、TGF-β1和VEGFA mRNA(处理4 h后)和蛋白(处理12 h后)的表达水平。试验结果表明(图1A-D),终浓度为10-7mol/L和更高终浓度的氟前列醇可显著上调体外培养的奶牛子宫内膜组织中CTGF、TGF-β1和VEGFA mRNA的表达(P<0.05),而终浓度为10-8mol/L和更高浓度的氟前列醇可显著上调FGF-2 mRNA的表达(P<0.01)。此外,终浓度为10-7mol/L的氟前列醇可显著上调子宫内膜组织中CTGF、FGF-2、TGF-β1和VEGFA蛋白的表达(P<0.05),与mRNA表达检测的结果基本一致。因此,在后续研究中,终浓度为10-7mol/L的氟前列醇可用于开展PTGFR被激活后上述生长因子表达的时间效应试验。

*P<0.05;**P <0.01;***P <0.001。下同
2.2 终浓度为10-7mol/L的氟前列醇对体外培养的奶牛子宫内膜组织中CTGF、FGF-2、TGF-β1和VEGFA表达的影响终浓度为10-7mol/L的PTGFR激动剂氟前列醇处理体外培养的奶牛子宫内膜组织不同时间后(4~36 h),分别通过实时荧光定量PCR和Western blot方法分析组织中CTGF、FGF-2、TGF-β1和VEGFA mRNA以及蛋白的表达情况。试验结果表明,CTGF mRNA的表达量在氟前列醇处理2,4 h后出现上升,处理36 h后亦出现上升,而CTGF蛋白表达量在处理4~36 h后出现上升,18 h达到峰值(图2A)。氟前列醇可上调子宫内膜组织中FGF-2 mRNA和蛋白的表达,且其表达在所有处理时间点均维持在较高水平;FGF-2 mRNA的表达在处理4 h后达到高峰,FGF-2蛋白的表达在处理8 ,12 h后达到高峰;(图2B)。氟前列醇可诱导TGF-β1 mRNA(处理4,12,24和36 h 后)和蛋白(处理12~36 h后)表达的上调(图2C)。在处理8 h后,氟前列醇诱导的VEGFA mRNA表达恢复至正常水平,但处理后24~36 h,VEGFA mRNA的表达水平再次上升;VEGFA蛋白表达水平从处理12~36 h后出现显著上调(图2D)。因此,终浓度为10-7mol/L的氟前列醇可在特定的处理时间点诱导体外培养的奶牛子宫内膜组织中CTGF、FGF-2、TGF-β1和VEGFA的表达量上调。

图2 终浓度为10-7 mol/L的PTGFR激动剂氟前列醇处理不同时间后(4 ~36 h)对奶牛子宫内膜组织中CTGF(A)、FGF-2(B)、TGF-β1(C)和VEGFA(D)mRNA和蛋白表达的影响
2.3 氟前列醇对体外培养的奶牛子宫内膜组织中PCNA表达的影响使用不同终浓度(10-9~10-5mol/L)的PTGFR激动剂氟前列醇处理体外培养的奶牛子宫内膜组织24 h后,通过Western blot检测组织中PCNA蛋白的表达情况。试验结果表明,10-7mol/L和更高终浓度的氟前列醇可显著上调PCNA蛋白的表达(图3A)。因此,在后续试验中,终浓度为10-7mol/L的氟前列醇可用于开展PTGFR被激活后奶牛子宫内膜组织中PCNA表达的时间效应试验。试验结果表明,体外培养的奶牛子宫内膜组织在使用终浓度为10-7mol/L的氟前列醇处理后,PCNA蛋白的表达在处理后12~36 h内显著上升(图3A)。同时,免疫荧光染色试验表明,在使用氟前列醇处理24 h后,奶牛子宫内膜组织中PCNA的表达显著上升(图3B),与Western blot检测结果一致。因此,PTGFR激动剂氟前列醇可上调奶牛子宫内膜组织中PCNA的表达。
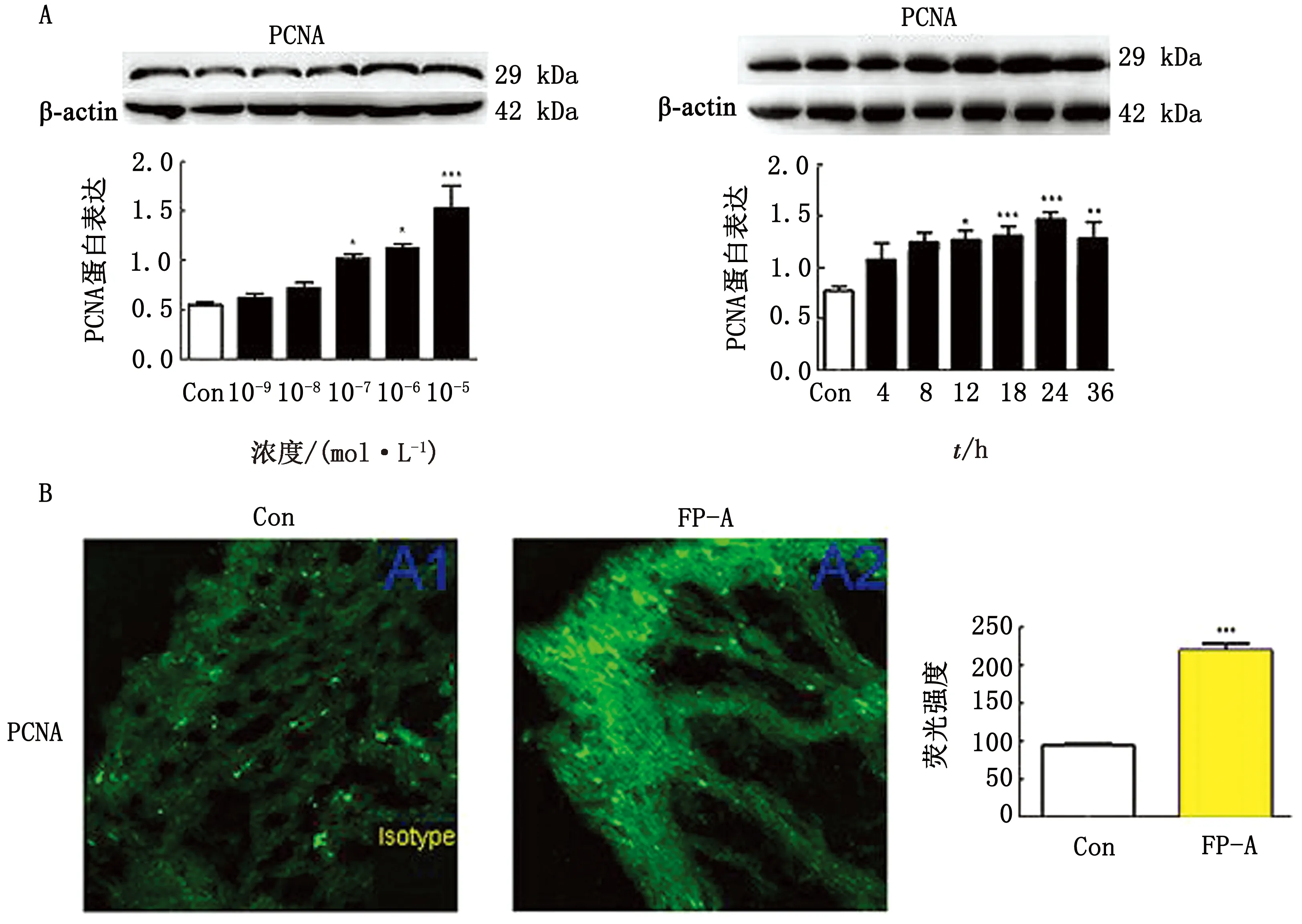
图3 PTGFR激动剂氟前列醇对对奶牛子宫内膜组织中PCNA蛋白表达的影响
3 讨论
PGF2α广泛分布于各组织器官中,并具有多种生物活性。近年来,PGF2α调控生长因子表达、细胞增殖和组织生长的能力已被证实。例如,PGF2α可刺激骨骼肌细胞的增殖,而且该过程是母羊囊状滤泡生长所必需的[15]。此外,PGF2α在猪着床期间具有促进子宫内膜血管生成的作用[16]。值得注意的是,牛子宫内膜在发情期和妊娠早期,PGF2α分泌模式与子宫内膜生长呈正相关,但PGF2α分泌与子宫内膜生长之间的关系尚不清楚。本课题组在前期研究工作中已经成功建立了奶牛子宫内膜组织的体外培养方法[12]。本试验结果表明,在奶牛子宫内膜组织中,PTGFR激活后可诱导一系列对子宫内膜生长所必须的生长因子和细胞增殖因子的表达,进一步证实了PGF2α的分泌参与子宫内膜组织生长的可能性。
子宫内膜状态的改变是由E2、黄体酮等类固醇激素,以及由子宫内膜上皮细胞、间质细胞、血管细胞合成和释放的CTGF、FGF-2、TGF-β1和VEGFA等细胞因子直接或间接决定的。CTGF是重要的子宫内膜生长调控因子。月经期、增殖期与分泌期相比,人子宫内膜组织的腺上皮细胞、上皮细胞和基质细胞中CTGF的表达量显著上升[17]。本试验表明,PTGFR激动剂氟前列醇可诱导奶牛子宫内膜组织中CTGF表达的上调。该结果与先前研究报道的人子宫内膜上皮细胞在使用PGF2α处理后,其CTGF表达显著升高的结果是一致的[17]。FGF-2及其受体在牛子宫内膜组织中表达[18]。FGF-2能够促进猪子宫内膜组织中子宫细胞的增殖、分化和血管生成过程[19]。本试验中,使用PTGFR激动剂氟前列醇处理后,FGF-2的表达量出现上调,表明在奶牛子宫内膜中,FGF-2的表达可能受到PGF2α-PTGFR通路激活的调控。TGF-β蛋白及其受体在促进子宫内膜细胞增殖的过程中发挥了重要作用[20]。此外,在发情期内,TGF-β1的高表达可能通过调控基因表达、细胞运动、增殖、凋亡和分化而在发情期内参与子宫内膜结构的重建[21-22]。本试验结果表明,PGF2α-PTGFR通路的激活可上调TGF-β1在奶牛子宫内膜组织中的表达。VEGF是血管生成的关键因子。在子宫内膜组织修复中,子宫内膜VEGF表达的上调是完成该过程的必要条件[23]。在本试验中,PTGFR激动剂氟前列醇可诱导VEGFA的表达,表明PGF2α-PTGFR通路的激活可能通过诱导奶牛子宫内膜组织中VEGFA的表达促进其修复。
除上述生长因子外,为分析和判断PGF2α-PTGFR通路激活后奶牛子宫内膜组织中细胞增殖的趋势,本试验亦检测了组织中能够代表细胞发生增殖的增殖细胞核抗原(PCNA)的表达情况。试验结果表明,PTGFR激动剂氟前列醇处理后,奶牛子宫内膜组织中PCNA的表达水平显著上升,表明PGF2α-PTGFR通路的激活对组织中的细胞增殖具有一定的诱导作用。该结果与生长因子表达的结果完全一致,进一步说明PGF2α-PTGFR通路的激活可通过奶牛子宫内膜组织中生长因子和PCNA表达,促进奶牛子宫内膜组织的修复过程。
综上所述,本试验探讨了一系列生长因子在奶牛子宫内膜组织中对PTGFR激动剂处理的应答情况。PTGFR激动剂氟前列醇对CTGF、FGF-2、TGF-β1和VEGFA的表达均具有上调作用,表明PGF2α-PTGFR通路的激活可能通过诱导生长因子的表达促进子宫内膜的修复过程。此外,前列腺素类化合物及其类似物具有作为子宫内膜促修复药物应用的潜力,在兽医临床工作中可加以合理使用。然而,在目前的研究中,奶牛子宫内膜组织中负责合成分泌这些生长因子的细胞类型尚未明确,尚需在未来的研究工作中进行进一步的研究探讨。
