基于牛源A型多杀性巴氏杆菌溶血表型的蛋白组学分析
2021-06-17王佳楠汪德会王远兰赵宗铃彭远义
王佳楠,汪德会,李 攀,王远兰,赵宗铃,彭远义
(西南大学 动物科技学院,重庆400700)
多杀性巴氏杆菌(Pasteurellamultocida,Pm)是一种革兰阴性条件致病菌,根据其荚膜抗原的不同可分为A、B、D、E和F共5种血清型[1],其中牛源A型多杀性巴氏杆菌作为牛呼吸道正常栖息菌,在应激条件下引起的牛呼吸道疾病综合征可给养牛业造成巨大的经济损失[2]。目前多杀性巴氏杆菌的致病机制尚不明确,研究其致病机制可对多杀性巴氏杆菌病的防控提供理论依据。
细菌溶血素是细菌分泌的一类外毒素。目前,已知细菌、对虾[3]、微藻[4]、植物病原体[5]、螺旋体[6]、支原体[7]等生物皆能分泌溶血毒素。可分为重复子毒素家族(repeats in toxin family,RTX)、胆固醇依赖细胞溶素家族(cholesterol-dependent cytolysin family,CDC)以及其他类。重复子毒素家族蛋白的概念在1991年首次被提出,该家族蛋白的羧基(C)端有一段富含甘氨酸-天冬氨酸的九肽重复序列(G-G-XG-(N/D)-D-x-(L/I/F)-X),该区域内含Ca2+结合位点;在氨基(N)末端区域具有疏水结构域,该结构域可参与靶膜孔的形成;该家族蛋白通过Ⅰ型分泌系统转运至胞外后结合Ca2+而激活,并与宿主细胞膜相互作用[8]。胆固醇依赖型细胞溶素(cholesterol dependent cytolysins,CDCs)是一种成孔毒素(pore-forming toxins,PFTs),后发现革兰阴性菌也能分泌此类毒素[9]。大多数CDC家族成员之间具有较高的相似性,其基本特征是该毒素结构域4(domain 4)的L1环(Loop 1)含有一段保守的胆固醇识别基序(cholesterol recognition motif,CRM)ECTGLAWEWWR,可与靶膜上的胆固醇受体发生结合,从而产生一系列的生物学效应[10]。其他类中像磷脂酶具有磷酸二酯酶(如PLC和PLD)和酰基水解酶(如PLA1,PLA2,PLB)的活性[11]。目前,与溶血功能相关且研究得较多的有磷脂酶A1,A2和C。例如,嗜肺杆菌plaB是编码主要细胞相关磷脂酶A的基因,可能由于其溶血活性而导致细菌细胞毒性[12]。
作为重要的毒力因子,溶血素可通过损伤细胞组织、诱导细胞凋亡、激活补体和促进炎症反应等参与细菌的致病作用。多杀性巴氏杆菌的溶血性可为我们探究其致病机制提供新的思考方向,即其是否也分泌溶血素样蛋白进而导致炎症反应,杀伤组织细胞。如α-溶血素在宿主细胞膜上形成孔洞后可通过NLRP3炎性小体激活caspase-1,进而切割IL-1β前体转化为成熟的IL-1β,并导致细胞焦亡的发生[13-14]。我们实验室前期发现,多杀性巴氏杆菌感染可诱导NLRP3炎症小体激活,进而导致caspase-1的激活和IL-1β的分泌[15]。厌氧条件下出现的溶血现象让我们猜测多杀性巴氏杆菌是否也产生溶血素样蛋白发挥类似作用,诱导NLRP3炎症小体激活进而导致炎性因子分泌。另一方面,α-溶血素分泌系统是目前研究最透彻的革兰阴性菌Ⅰ型分泌系统,由HlyB,HlyD,TolC 3个蛋白组成。我们在PmCQ2的蛋白组中发现了TolB,TolC的存在,如果引起溶血的也是HlyD家族蛋白,那么对于确定多杀性巴氏杆菌的分泌系统便具有指导价值,同时在理论上可以使用此分泌系统构建分泌型活载体疫苗,为巴氏杆菌病的防控提供新思路。
蛋白组学的应用非常广泛,在微生物方面,可用于研究细菌的耐药机制、致病机制、本身的生理特性机理以及新型疫苗的研发等[16]。例如,RAY等[17]用label free蛋白组学技术鉴定了水解蛋白弧菌(Vibrioproteolyticus)中的一个溶血素基因(VPRH),并阐明该基因可使HeLa细胞肌动蛋白重排且具有毒性作用,是一个重要的毒力因子。本研究旨在用蛋白组学技术并结合生物信息学分析,以期筛选到多杀性巴氏杆菌可能的溶血因子,为其溶血机制研究提供参考。
1 材料与方法
1.1 菌株及动物牛源A型多杀性巴氏杆菌PmCQ1~PmCQ7,PmB ,PmF和禽源PmQ分离并暂存于本实验室,根据形态特征、生化特性、16SrRNA基因序列分析以及对物种特异性基因Kmt-1进行PCR扩增确定以上所用菌株为多杀性巴氏杆菌,进一步通过PCR扩增血清特异性基因hyaD-hyaC,bcbD,dcbF,ecbJ和fcbD确定所用菌株的荚膜血清型[18];大肠杆菌DH5α和BL21(DE3)感受态细胞购于重庆拓世众和生物公司;pET-32a(+)和pET-30a保存于本实验室。
4~5周龄雌性昆明小鼠(18~22 g)、成年新西兰大白兔购自重庆恩斯维尔生物科技有限公司。
1.2 主要试剂马丁肉汤、LB肉汤、BHI肉汤均购于海博生物公司。IPTG、卡那霉素、氨苄西林钠、50倍TAE电泳缓冲液、丙烯酰胺/甲叉29∶1,30%溶液、1.5 mol/L Tris-HCl溶液(pH8.8)、1 mol/L Tris-HCl溶液(pH6.8)、10% SDS溶液均购自上海生工有限公司;甘氨酸、tris、脱脂奶粉购于BIOFROX公司;细菌mRNA提取试剂盒购自于天漠生物公司;一步法反转录试剂盒购于天根公司;ECL显色液和BCA试剂盒购于碧云天公司。
1.3 引物设计引物序列来源于牛源A型多杀性巴氏杆菌PmCQ2(CP033599)基因组,引物合成自上海生工生物公司(表1)。

表1 引物序列
1.4 PmCQ2的溶血活性分析从-80℃冰箱取出PmCQ2种子液,划线接种于马丁固体血培养基上,37℃恒温培养18 h,挑取单菌落接种于马丁试管液体培养基中,37℃,220 r/min恒温摇床培养10 h左右至对数期,即得到可使用的活化菌株。将活化的菌液分别划线接种于马丁、LB和BHI兔血平板,每种肉汤固态培养基进行3个生物学重复,操作重复2次,然后将其分别放置于有氧和厌氧恒温(37℃)培养箱中,分别培养观察3~5 d,观察溶血情况。
PmCQ2先有氧培养再厌氧培养,大致步骤同上,将PmCQ2分别划线于马丁兔血平板和LB兔血平板,先放置于有氧条件的恒温培养箱中,培养12 h后,观察并记录溶血情况;然后将PmCQ2生长良好的平板转移至厌氧培养箱中,继续培养72~96 h,观察并记录此时的溶血情况。
1.5 其他血清型Pm的溶血活性分析将PmCQ1~PmCQ7,PmB ,PmF和PmQ菌株按照1.4步骤,观察并记录溶血情况。
1.6 制备蛋白样品及送样按照1.4方法活化多杀性巴氏杆菌PmCQ2,将对数期的菌液原菌涂布接种于12个马丁兔血平板(并以划线培养作为溶血现象的观察),将平板分别放置于有氧恒温(37℃)培养箱及厌氧恒温培养箱,有氧培养12 h,厌氧培养65 h,用无菌细胞刮收集菌体于无菌冻存管,速冻液氮后于-80℃保存备用,有氧组(对照组)及厌氧组(试验组)各设置3个生物学重复,各组别分别命名为X2,X3和X4以及Y1,Y2和Y3。将样品用干冰运输至杭州景杰生物公司。
1.7 qRT-PCR转录水平验证荧光定量PCR验证蛋白组数据的转录水平,按照mRNA提取试剂盒说明书提取细菌样品RNA,酶标仪测浓度后按照天根公司FastKing反转录试剂盒进行反转录得到cDNA,以5 μL SYBR荧光定量酶,上下游引物各0.5 μL,cDNA 1 μL,dd H2O 3 μL进行qRT-PCR。
1.8 Western blot蛋白水平验证用大肠杆菌BL21(DE3)菌株诱导表达所验证蛋白,将纯化的蛋白与佐剂按4∶1混合,皮下多点免疫小鼠,二免后对小鼠断尾采血,收集血清即为一抗。取送样时的全菌蛋白裂解液上清,蛋白定量后进行SDS-PAGE电泳,转膜,用添加0.05%脱脂奶粉的TBST混合液37℃封闭,洗涤液清洗5次后加一抗于4℃过夜孵育,再次洗涤后进行二抗孵育1 h,最后取等量ECL显色液A/B混匀,用蛋白成像仪显色成像。
1.9 假定溶血因子的分析及筛选根据蛋白组学结果和溶血素本身的性质特点,主要从蛋白差异表达倍数及注释、蛋白的亚细胞定位、蛋白结构域及其家族主要功能几个方面进行筛选。
2 结果
2.1 PmCQ2在有氧及厌氧条件下的溶血情况结果显示有氧条件下PmCQ2在马丁兔血平板上没有溶血活性,而厌氧条件下其在马丁、BHI及LB兔血平板上均有明显的溶血活性。接种于马丁、LB兔血平板的PmCQ2,先有氧培养12 h,不具有溶血活性,而转移至厌氧条件再培养72~96 h时可出现溶血活性(图1)。

A.PmCQ2在有氧和厌氧条件下,于马丁、BHI及LB兔血平板分别培养;1.马丁有氧条件;2.马丁无氧条件;3.BHI厌氧条件;4.LB厌氧条件;B.PmCQ2于马丁、LB兔血平板,先有氧培养后厌氧培养;5.LB有氧条件;6.LB平板转移至厌氧条件;7.马丁有氧条件;8.马丁平板转移至厌氧条件
2.2 不同血清型多杀性巴氏杆菌的溶血情况经多次试验重复验证,厌氧培养条件下,牛源A型PmCQ1 ~ PmCQ7,B型PmB ,F型PmF和禽源PmQ分别在LB,马丁及BHI兔血平板上均具有溶血活性(表2)。

表2 不同血清型多杀性巴氏杆菌的溶血情况
2.3 蛋白提取及浓度测定细菌蛋白浓度测定用BCA法进行,浓度如表所示,达到检测标准(表3)。

表3 蛋白样品质量浓度
2.4 差异表达蛋白定量结果多杀性巴氏杆菌在厌氧条件具有溶血表型,其厌氧条件(PMCQ2_Y)下较有氧条件(PMCQ2_X)而言,蛋白发生了显著的变化,以ratio>1.2倍(或ratio<0.83)为差异表达变化阈值,以统计学t检验P<0.05为显著性阈值,PMCQ2_Y/ PMCQ2_X比较组中有164个蛋白表达上调,282个蛋白表达下调(图2)

图2 不同比较组中差异表达蛋白数量分布柱形图
2.5 亚细胞定位分类所有的差异蛋白亚细胞定位显示(图3),有270,95,47,24和10个蛋白亚细胞分别定位于细胞质、细胞周质、内膜、外膜和胞外,同时占所有差异蛋白的比例分别为60.54%,21.3%,10.54%,5.38%和2.24%。

图3 差异蛋白的亚细胞结构定位分布图
2.6 差异表达蛋白的富集分析对差异表达蛋白进行GO分类、KEGG通路和蛋白结构域富集分析,为发现差异表达蛋白在某些功能类型上是否存在显著性的富集趋势。对富集检验P值用气泡图方式显示差异蛋白的显著富集(P<0.05)。
2.6.1GO功能的富集分析 将P<0.05的GO term的显著富集差异蛋白进行分类,结果如表4所示,在细胞组分中差异蛋白主要富集在胞质部分、核糖体、内核蛋白复合体、非膜细胞器和细胞内非膜细胞器等条目;在分子功能中主要富集在核糖体的结构组成、过度金属离子结合和铁离子跨膜转运活性等条目;在生物进程中主要富集在肽聚糖的生物合成、铁离子结合和细胞蛋白复合物组装等条目。
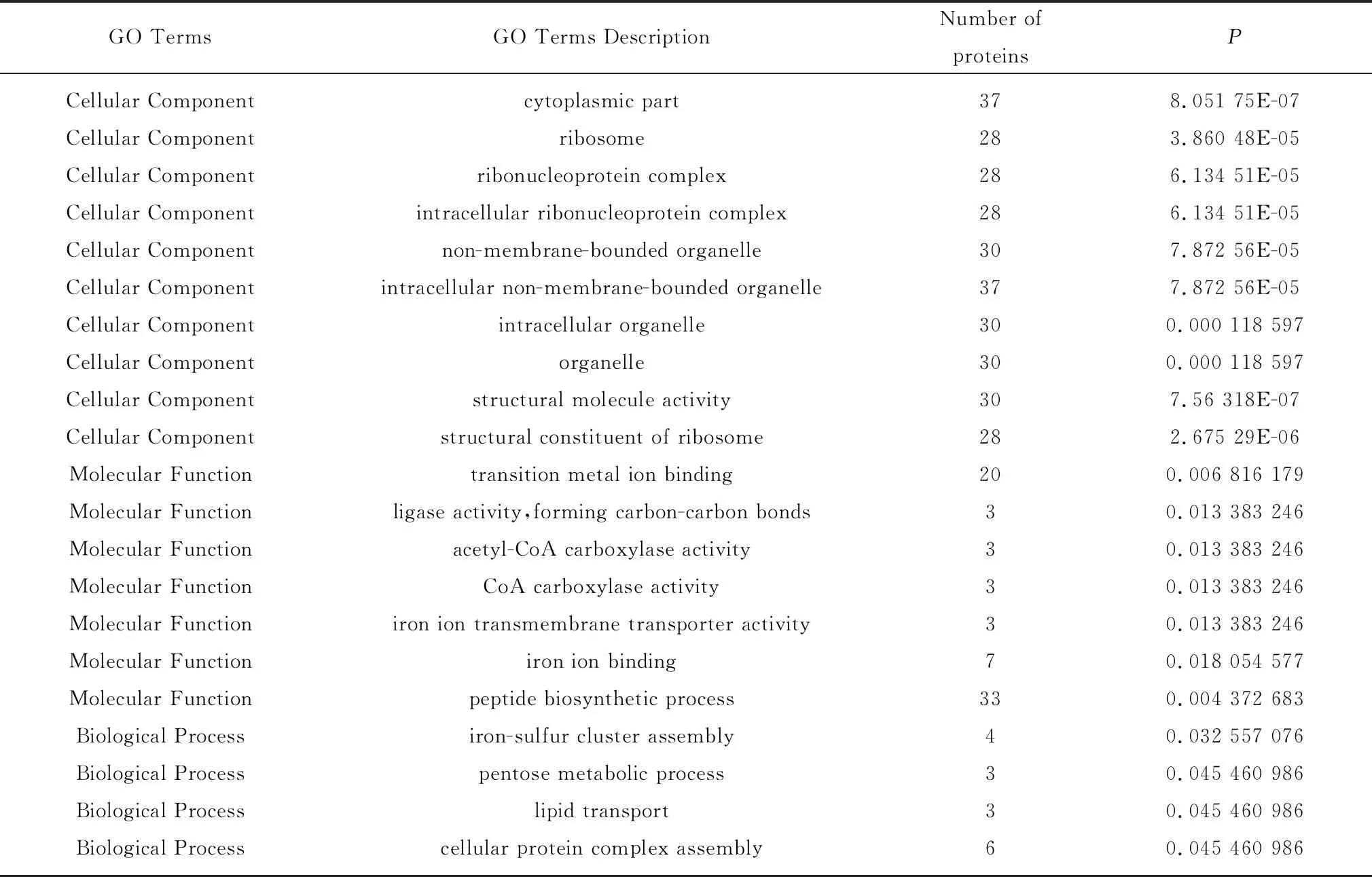
表4 差异蛋白GO功能显著富集分布
2.6.2蛋白结构域富集分析 由图4可见,差异蛋白主要聚集于Single hybrid motif结构域、Biotin/lipoyl attachment结构域、ABC转运蛋白质结合域、氯霉素乙酰转移酶结构域、未知功能(DUF21)结构域和转运相关结构域等。

图4 差异蛋白蛋白结构域富集分布图
2.6.3差异蛋白pathway富集分析 如图5可见,差异蛋白主要富集于核糖体(ribosome)、肽聚糖生物合成(peptidoglycan biosynthesis)、脂肪酸代谢和生物合成(fatty acid metabolism and biosynthesis)通路、丁酸酯代谢(butanoate metabolism)、氧化磷酸化(oxidative phosphorylation)、柠檬酸循环(TCA循环)(citrate cycle,TCA cycle)和丙酮酸代谢(pyruvate metabolism)等通路。

图5 差异蛋白pathway富集分布图
2.7 qRT-PCR在转录水平验证蛋白组结果选取8个差异蛋白(Pm1264,Pm1081,Pm0040,Pm0634,Pm0441,Pm0057,Pm1427和Pm1384)在转录水平进行验证,X-12和Y-65分别表示有氧条件及厌氧条件的取样时间点。结果如图6所示,蛋白的转录水平与蛋白的表达趋势基本一致。

图6 蛋白组结果转录水平验证
2.8 Western blot在蛋白水平验证蛋白组结果Pm2109,Pm2214和Pm769蛋白根据预测结果均有溶血素家族蛋白相关结构域,且在厌氧条件下表达均上调,故选取该3个蛋白进行蛋白水平验证,其ratio(Y/X)值分别为1.262,1.232和1.085,由图7可见(每孔上样量为10 μg),Pm2214及Pm769在厌氧组别中(Y1,Y2,Y3)的表达(灰度值)比有氧组别多,结果与蛋白组测定结果基本一致,而Pm2109的表达差异不明显。

图7 蛋白组结果蛋白水平验证
2.9 假定溶血因子的筛选及分析对于假定溶血因子的筛选一方面是参考在其他细菌已报道的溶血素,从所得蛋白的注释、基因家族功能以及本身功能作用等方面作筛选;另一方面则是需要去挖掘未知的可能与溶血素相关的蛋白作为候选因子,这部分主要从差异蛋白的差异倍数并结合注释、亚细胞定位等经综合分析后作筛选。
2.9.1基于差异表达倍数及亚细胞定位筛选 结果如表5所示,0040是基因ID CQ2GL000040的简称, 以及0090,0057均为假定蛋白,没有功能注释,在厌氧条件下显著高表达于有氧条件,虽然0040,0057等亚细胞定位显示在细胞质和内膜,但有可能对溶血素效应蛋白起调控或者转运作用,如RTX毒素家族中的RtxB蛋白便是整合到细菌内膜的ABC结合转运蛋白。0634编码一种外膜蛋白,对其结构域进行描述时发现其形成β-桶状结构,关于溶血素的研究发现RTX家族中的rtx毒素蛋白在结合Ca2+后其C末端结构域在T1SS出口处折叠形成β-桶状结构[18],以及在CDC家族中由多个单体组装成的环状孔道前孔复合物可调整形成β-桶状结构[19]。1333注释为溶血素D,与溶血素转运有关[20],且定位于外膜,在厌氧组中高表达。
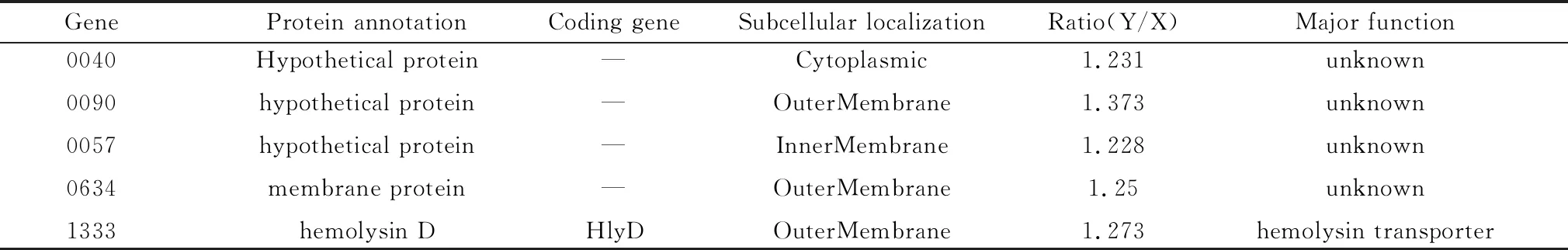
表5 部分极显著差异表达蛋白的特征
2.9.2基于基因家族主要功能及蛋白结构域的筛选 结果如表6所示,2109,2214和806的蛋白注释皆为HlyC/CorC 家族转运子,其蛋白结构域(COD)皆有CBS/Transporter保守结构域,该家族经预测与溶血素的分泌相关,且有相应文献的报道[21];而769,0025是HlyD家族蛋白,该家族蛋白与溶血素的转运相关[22],1211是SGNH超家族的一类蛋白,注释为磷脂酶的一部分,故将Pm2109,Pm2214,Pm806,Pm769,Pm0025和Pm1211筛选为假定溶血候选因子。

表6 基于基因家族主要功能及蛋白结构域的筛选
综上,共筛选到11个假定溶血候选因子,分别为Pm0090,Pm0057,Pm0040,Pm0634,Pm1333,Pm2109,Pm2214,Pm806,Pm769,Pm0025和Pm1211。
3 讨论
多杀性巴氏杆菌是一类重要的人兽共患致病菌,可引起多种动物以及人发病[23],全世界每年因多杀性巴氏杆菌病而导致的经济损失在数百亿以上,因此研究多杀性巴氏杆菌的致病机制仍迫在眉睫。溶血素是一类能使红细胞溶解或具有其他细胞毒性作用的生物学因子[24],在原核生物、真核生物中均有发现。细菌溶血素可通过细胞膜损伤、细胞溶解或裂解、离子失衡相关病变、细胞凋亡、炎症反应等参与细菌致病过程。
前期我们曾发现多杀性巴氏杆菌在厌氧条件下的溶血现象,本研究进一步对溶血现象进行验证,证实厌氧条件下不同血清型菌株在动物红细胞的不同培养基平板均可引起溶血,这与Hunt等人的试验结果基本一致[25],同时我们猜测在厌氧条件下多杀性巴氏杆菌只要能在相应的培养基上生长,最终可能都会出现溶血现象。这表明多杀性巴氏杆菌在厌氧条件下可能有其特殊的基因表达模式。研究显示,液化沙雷氏菌(Serratialiquefaciens)胞外分泌的磷脂酶溶血素PLA1的表达可受到分别位于PLA1基因(plda1)上游50,600 bp处的双启动子系统的正调控,该系统分别调控该菌在生长对数期和厌氧条件下PLA1表达与分泌[26]。多杀性巴氏杆菌PmCQ2(CP033599)中同样存在磷脂酶A1(plda1)基因(CQ2GL001693 ),该基因是否同样受到启动子调控以及是否与溶血现象有关,可以作为下一步溶血机制的研究。
为了探究Pm在厌氧条件下的溶血机制,本研究用TMT蛋白组学技术从蛋白水平进行分析。将多杀性巴氏杆菌厌氧组与有氧组对比,有164个蛋白表达上调,282个蛋白表达下调。溶血素作为在多种细菌中存在的毒力因子,我们猜测厌氧条件下溶血表型的出现与多杀性巴氏杆菌溶血相关因子有密切联系,可能与某些蛋白的差异表达有关,但其机制目前还不清楚。因此,筛选假定溶血因子便显得尤为重要。除参考在其他细菌现已报道的溶血素,从测得蛋白的注释、基因家族功能以及本身的功能作用等方面作筛选之外,另一方面也需要从差异蛋白的差异倍数、注释、亚细胞定位等经综合分析后筛选一些未知蛋白。本研究一共筛选了11个假定溶血候选因子,其中Pm2109注释为HlyC/CorC family transporter,该蛋白不仅表达上调且其蛋白结构域由未知结构域(DUF21)、CBS结构域、和转运相关结构域(transporter)3部分组成,除与鸭疫里默氏菌(Riemerellaanatipestifer,RA)溶血素Riean_0415具有相同的蛋白结构域外[27],还与嗜水气单胞菌SSU(AeromonashydrophilaSSU )具有溶血活性的HlyA具有相同的蛋白结构域,并且与HlyA蛋白序列具有一定的相似性[28]。另外,Pm1211蛋白表达虽然下调,其注释为磷脂酶,功能是脂质的转运和代谢,研究显示细菌磷脂酶同样具有溶血功能[29],但皆需要试验验证。当然,溶血素除了有可能是蛋白成分外,也有可能是表面活性剂物质等,像枯草芽孢杆菌的表面活性素可引起溶血[30],假单胞菌分泌的鼠李糖脂也可以引起溶血,所以引起巴氏杆菌在厌氧条件下溶血的因素也需要进行多角度的考量和探索。
综上,本研究基于蛋白组学分析筛选了11个候选溶血因子(Pm0090,Pm0057,Pm0040,Pm0634,Pm1333,Pm2109,Pm2214,Pm806,Pm769,Pm0025和Pm1211),为多杀性巴氏杆菌溶血机制研究提供了参考。
