犬瘟热病毒(CDV) RPA-SYBR GreenⅠ 检测方法的建立与应用
2021-06-17张珊珊李吉平孟轲音万忠海穆玉堂李忠义王承宇
郝 镯,张珊珊,李 楠,田 多,李吉平,孟轲音,万忠海,穆玉堂,李忠义,王承宇
(军事科学院 军事医学研究院 军事兽医研究所/吉林省人兽共患病预防与控制重点实验室,吉林 长春 130122)
犬瘟热是由犬瘟热病毒(CDV)引起的一种高度传染性传染病,在犬及野生肉食动物中广泛传播,是危害犬及毛皮经济动物的主要疫病之一,给宠物业和毛皮动物产业带来严重的经济影响[1]。目前对CDV的检测方法主要有ELISA、半定量PCR、LAMP等[2],这些方法灵敏度高,特异性好,但是反应时间长,对实验操作人员的技术水平和仪器精密度要求高,不适于兽医临床或野外现场检测。胶体金检测试纸条的方法虽然简便快速,但灵敏性较低,且容易出现假阳性,因此不适合患病动物的早期诊断。
重组酶聚合酶扩增(recombinase polymerase amplification,RPA)是一种恒温核酸扩增技术,按照RPA反应要求设计上下游引物,根据不同的RPA产物检测方法设计不同的检测探针。RPA反应包含3种核心酶即重组酶、单链DNA结合蛋白(SSB)和链置换多聚异构酶,它们协调引物配对靶向RNA/DNA合成DNA,短时间内将核酸模板从痕量水平扩增到可检测水平,具有高敏感性和特异性[3],非常适于兽医临床的早期诊断。SYBR Green Ⅰ是一种可结合于所有dsDNA双螺旋小沟区域的具有绿色激发波长的染料。在游离状态下,SYBR Green Ⅰ发出微弱的荧光,一旦与双链DNA结合聚集后,荧光大大增强。由于RPA引物标记FAM基团,因此扩增的靶标产物与SYBR Green Ⅰ结合后可产生荧光绿色沉淀复合物,非靶标产物与SYBR Green Ⅰ结合后只显现核酸染料的原始颜色,即为红褐色,RPA扩增产物与SYBR Green Ⅰ结合使结果可通过肉眼观察,所以适用于临床及野外检测[1]。近年来,RPA检测方法已经成功应用于多种动物疫病病原的快速检测,如小反刍动物兽疫、植物病毒等。本研究的目的是将RPA和SYBR Green Ⅰ结合,建立一种CDV核酸检测方法,可以对犬瘟热进行早期、准确、快速诊断。
1 材料与方法
1.1 主要病原CDVOnderstepoort株(CDV-GZ1),犬细小病毒(CPV),犬腺病毒(CAV),犬副流感病毒(CPIV),CDV第10代毒株(CDV-10),Vero细胞,由军事兽医研究所病毒室提供,临床检测样本由长春西诺生物提供,-80℃留存待用。
1.2 主要试剂TwistAmp nfo试剂盒购自 TwistDx公司;病毒基因组DNA/RNA提取试剂盒,cDNA反转录试剂盒购自天根生化科技(北京)有限公司;SYBR Green Ⅰ购自Solarbio公司;ELISA检测试剂盒购自上海纪宁生物技术有限公司;其他未提及试剂均购自Sigma公司。
1.3 主要仪器台式高速离心机,购自德国Sigma公司;干式恒温器,购自金坛市白塔金昌实验仪器厂;Nano Drop、酶标仪,购自上海赛默飞世尔公司;荧光定量PCR仪购自美国BIO-RAD公司;漩涡仪,购自德国IKA公司。
1.4 引物设计根据GenBank中收录的CDV基因序列,利用DNAMAN软件进行对比与分析,筛选出N基因序列中同源性相对较高的保守区,根据RPA引物设计原则,利用软件Primer Explore 3.0在线针对靶基因设计RPA上下游引物(P1、P2)和1条探针(T),RT-PCR引物序列参照四川省地方标准DB51/T 1710.2—2013,序列见表1。

表1 引物序列信息
1.5 模板的制备取实验室培养的CDV细胞培养上清液200 μL,按照病毒基因组DNA/RNA提取试剂盒说明书提取病毒总RNA,并取部分样品检测RNA质量,D260/D280值为1.8~2.0,根据反转录试剂盒说明将RNA反转录成cDNA,-80℃留存备用。
1.6 CDV RPA-SYBR Green Ⅰ检测方法的建立使用上述引物,按照TwistAmp nfo试剂盒说明,以cDNA为模板进行RPA反应,得到扩增产物。反应体系50 μL,其中P1(10 μmol/L)2.10 μL、P2(10 μmol/L)2.10 μL、T(10 μmol/L)1.05 μL、无引物缓冲液 29.50 μL、模板4.00 μL、醋酸镁(280 mmol/L)2.50 μL 、灭菌超纯水8.75 μL。设置阳性对照(PC)为CDV-GZ1病毒总RNA,阴性对照(NC)为Vero细胞的总RNA,空白对照(BC)为DMEM培养基,反应条件和体系按RPA反应试剂盒说明进行[3-5],每个反应至少重复3次。之后在扩增产物中加入SYBR Green Ⅰ,避光静置5 min后读取结果。
1.7 CDV RPA-SYBR Green Ⅰ检测方法反应条件优化将试验组按不同温度共分为5组(25,30,35,39,40℃),确定最佳反应温度。确定反应温度后,将试验组按不同反应时间共分为9组(5,6,8,10,12,14,16,18,20 min),确定最佳反应时间。
1.8 CDV RPA-SYBR Green Ⅰ检测方法反应体系优化将试验组按照不同的引物和探针比例分为7组(1∶1,1.5∶1,2∶1,2.5∶1,3∶1,3.5∶1,4∶1)确定引物与探针的最佳环比;在阳性对照组中加入不同体积的SYBR Green Ⅰ(1.0,0.9,0.8,0.7,0.6,0.5,0.4,0.3,0.2,0.1 μL),确定SYBR Green Ⅰ的最佳反应含量,反应体系、引物浓度和探针浓度则按照TwistAmp nfo试剂盒说明进行筛选。
1.9 CDV RPA-SYBR Green Ⅰ检测方法的灵敏性分析用DMEM培养基将1×105TCID50/mL的 CDV细胞培养物进行10倍梯度稀释,分别提取1×105~1×10-2TCID50/mL 8个样品的总RNA,并反转录成cDNA,采用优化后的RPA-SYBR Green Ⅰ反应条件和体系进行灵敏性试验,并与ELISA方法进行比较。
1.10 CDV RPA-SYBR Green Ⅰ检测方法的特异性分析提取CDV、CDV-10、CPIV的总RNA,反转录成cDNA;提取CPV、CAV的总DNA,采用优化后的反应条件和体系进行RPA扩增反应,验证RPA-SYBR Green Ⅰ检测方法的特异性。
1.11 CDV RPA-SYBR Green Ⅰ检测方法的临床应用分别用RPA-SYBR Green Ⅰ、ELISA和RT-PCR方法对临床上采集的22份病犬临床样本进行CDV检测。
2 结果
2.1 CDV RPA-SYBR Green Ⅰ检测方法反应条件优化RPA反应原理是通过寡核苷酸引物特异性地识别模板靶位点的序列,随后发生DNA链的置换合成,从而使模板的靶区域呈指数扩增,因此我们根据扩增产物的多少来确定最佳的反应条件。如图1A所示,在5组不同反应温度的试验组中,35℃组及之后分组的扩增产物加入SYBR Green Ⅰ后颜色均变成荧光绿包,且颜色几乎没有深浅变化,因此确定最佳反应温度为35℃;图1B结果显示,闭合手掌组(FC)的扩增产物加入SYBR Green Ⅰ后颜色同阳性对照组一致,均为荧光绿色,呈阳性结果,证明手掌中的温度可以启动RPA反应,因此后续RPA试验均在实验人员闭合手掌中启动;图1C结果表明RPA反应10 min后即可将痕量水平的靶标扩增到可检测水平,因此确定最佳反应时间为10 min。

A.反应温度;B.闭合手掌温度启动RPA反应;C.RPA反应时间
2.2 CDV RPA-RPA-SYBR Green Ⅰ检测方法反应体系优化根据RPA试剂盒说明本试验采用50 μL 反应体系,引物和探针的最佳浓度均为10 μmol/L;如图2A中所示,按照优化后的反应条件确定上下游引物与探针的最佳环比,其中2∶1组及以后各组同阳性对照一致,均为荧光绿色,本着操方便,节约成本的原则,我们确定引物与探针的最佳反应环比为2∶1;如图2B中所示,只有在阳性对照的扩增产物中加入0.1 μL的SYBR Green Ⅰ才可以与之发生反应,产生荧光绿色的复合物,因此确定SYBR Green Ⅰ的加入量为0.1 μL。

A.引物与探针环比;B.SYBR GreenⅠ加入量
2.3 CDV RPA-RPA-SYBR Green Ⅰ反应灵敏性分析本试验的灵敏性通过在最优反应条件下对1×105~1×10-1TCID50/mL的CDV细胞培养液进行RPA-SYBR Green Ⅰ检测来分析该方法的的灵敏性。结果如图3显示,1×105~1×101组的扩增产物与SYBR Green Ⅰ结合后均为荧光绿色,但颜色逐渐变浅,1×10-1TCID50/mL组开始有一点红褐色出现,但没有1×10-2TCID50/mL组颜色深,说明RPA-SYBR Green Ⅰ方法的检测下限应该在1×101~1×100TCID50/mL。图3显示,ELISA检测方法在1×101~1×104TCID50/mL具有很好的线性关系(R2=0.963 9),经计算ELISA对CDV的最低检测下限为6.17 TCID50/mL,RPA-SYBR Green Ⅰ与ELISA检测方法的检测下限几乎一致,说明RPA-SYBR Green Ⅰ检测方法具有良好的灵敏性。

图3 CDV RPA-SYBR Green Ⅰ检测方法灵敏度分析结果
2.4 CDV RPA-SYBR Green Ⅰ反应特异性分析分别提取CDV、CDV第10代病毒(CDV-10)、CPV、CAV、CPIV 的总RNA/DNA,并反转录成cDNA之后,进行RPA扩增反应,结果如图4显示只有CDV、CDV-10细胞培养液和阳性对照与SYBR Green Ⅰ结合后为荧光绿色,呈阳性结果,其他病毒均为红褐色,呈阴性结果,证明了本检测方法具有良好的特异性。

图4 CDV RPA-SYBR Green Ⅰ检测方法特异性分析
2.5 CDV RPA-SYBR Green Ⅰ检测方法的临床应用分别用CDV RPA-SYBR Green Ⅰ、ELISA和RT-PCR方法检测临床采集病犬的22份样品,结果显示3种方法的检测结果一致,一致率达到100%,证明CDV RPA-SYBR Green Ⅰ可应用于临床样本CDV的检测(图5,表2)。
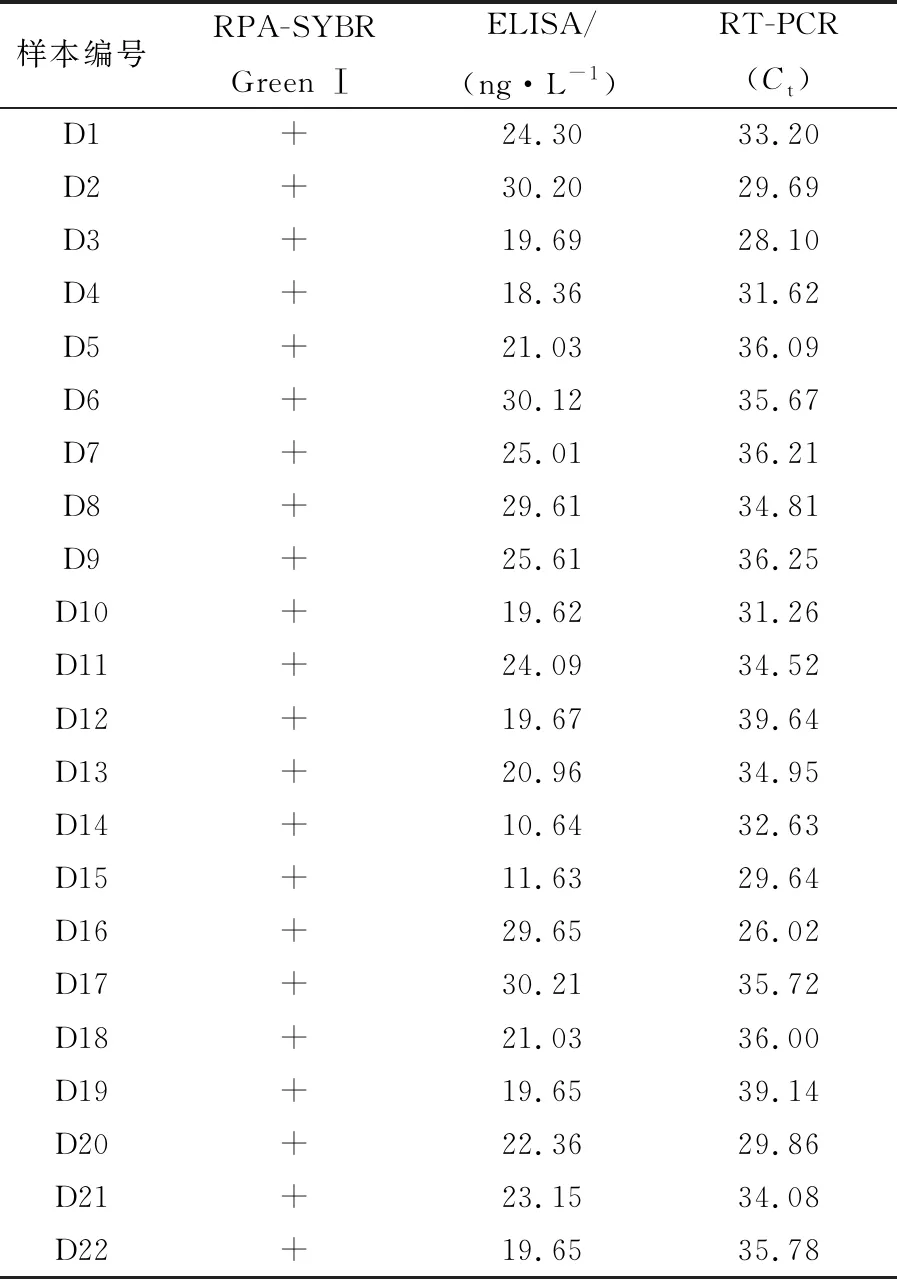
表2 CDV PRA-SYBR Green Ⅰ与ELISA和RT-PCR方法检测临床样本结果比较

样品顺序为箭头方向依次排列,前2个红褐色EP管为NC组与BC组,其余均是临床样本,与表2中顺序一致。
3 讨论
犬瘟热传染性极强,可感染全世界的野生和家养犬科动物,具有跨物种感染潜力,其发病速度快致死率极高,可高达90%以上,主要临床症状为消化道障碍、呼吸道疾病、鼻炎、发热,个别可发生脑炎等[6-11]。犬瘟热早期诊断方法主要为观察法,即观察犬及其他动物的反应症状,之后又陆续出现荧光定量PCR、ELISA、半定量PCR、免疫切片等方法[10-11],但是这些方法对检测人员有很高的要求,且需要一些精密的高端仪器设备,例如免疫切片等方法耗时长,结果也差强人意,因此,开发一种新型、快速、敏感、特异,能在基层兽医站等领域普遍应用的犬瘟热检测方法,对于犬瘟热的早期诊断和综合防控具有重要意义。
本试验结合RPA与SYBR Green Ⅰ 建立了一种CDV RPA-SYBR Green Ⅰ 检测方法[13-15]。该方法操作简单,只需恒温操作(闭合手掌中温度反应10 min),5 min内即可获得检测结果,不需要PCR仪等精密仪器,对操作人员要求较低。RPA检测原理是核酸互补配对原理,该原理使灵敏性和特异性显著提高,很好地克服了市售犬瘟热胶体金试纸条假阳(阴)性问题[16],在手掌中即可进行扩增反应或者保温杯中进行,非常方便,适合野外非正常试验环境进行CDV的检测。经过本实验室多次重复试验,结果无差异,且与ELISA、RT-PCR方法检测结果一致,说明此方法可信度高,可用于犬瘟热诊断。
RPA试验最重要且最关键的是引物和探针的设计,本试验共设计了10套引物,共有3套可以启动扩增反应,但只有1套引物的特异性良好,可见有效的引物才能确保试验结果的准确性。同时可以调整探针的设计,针对不同实验条件对扩增结果的输出方式进行改变,如可以与核酸检测横向流动试纸条(LFD)结合,变成试纸条输出方式,使得结果可视化。RPA对时间和温度的要求也很敏感,反应温度和时间过高过长或者过低过短均可对整个试验造成根本性的影响,因此在不同的试验条件下一定要对试验的反应条件和体系进行优化,以达到最好的检测灵敏性和特异性。本试验将RPA与SYBR Green Ⅰ结合,将待测靶标信号放大,短时间内使结果可视化[17-18],为建立高灵敏性和特异性的靶标检测方法提供了新思路,为犬瘟热的临床诊断提供技术基础。
综上所述,CDV RPA-SYBR Green Ⅰ可以实时、准确、快速地检测出动物机体组织、黏液、细胞等中的CDV,对于开发新型CDV初期检测方法具有很好的应用前景。
