m6A甲基转移酶对新城疫病毒复制的影响
2021-06-17李金斗丁佳欣冯嘉轩陈铭桦邵亚男徐小洪
李金斗,丁佳欣,冯嘉轩,陈铭桦,张 頔,邵亚男,徐小洪,丁 壮
(吉林大学 动物医学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062)
m6A修饰(N6-methyladenosine,m6A)是腺嘌呤第6位氮原子发生的甲基修饰,广泛存在于真核生物及细菌、病毒等原核生物的多类RNA中,其中mRNA和lncRNA中含量最高,占RNA修饰的80%以上,哺乳动物转录组中平均每条mRNA存在3~5个m6A位点,发生在RNA的“RRACH”([G/A][G>A]m6AC[U>A>C])基序,主要分布在翻译起始位点、终止密码子与 3′非翻译区(3′-untranslated region,3′-UTR)等区域[1]。调节m6A形成的细胞机制主要由甲基转移酶、去甲基转移酶及结合蛋白构成。甲基转移酶由甲基转移酶样因子3(methyltransferase like 3,METTL3)、甲基转移酶样因子14(methyltransferase like 14,METTL14)和 Wilm's肿瘤1相关蛋白(Wilms tumor 1-associated protein,WTAP)组成,METTL3与METTL14可结合形成二聚体,显示出比单独一种甲基转移酶更强的甲基化效率,WTAP本身不具有甲基化活性,缺乏保守的催化甲基化结构域,负责协调METTL3-METTL14异二聚体在核斑点中的定位,辅助m6A甲基化修饰的进程[2-3]。
m6A修饰不仅调节应激反应、生育力、干细胞分化、昼夜节律等多种生物学过程,在病毒感染及宿主细胞抗病毒反应中也发挥重要功能。近年研究表明m6A修饰可动态调控病毒复制,过表达甲基转移酶METTL3和METTL14可促进人类免疫缺陷病毒(HIV)[4-5]、甲型流感病毒(IAV)[6]、卡波氏肉瘤病毒(KSHV)[6]、肠道病毒71型(EV71)[7]、猴空泡病毒 40(SV40)[8]和呼吸道合胞病毒(RSV)[9]的复制,但对乙型肝炎病毒(HBV)[10]、丙型肝炎病毒(HCV)[11]、寨卡病毒(ZIKV)[12]和水泡性口炎病毒(VSV)[13]表现出抑制效果,沉默或敲除METTL3和METTL14则表现出相反效果,这可能是由于在不同类型病毒中,m6A修饰的相关酶下游调控靶基因有所不同。除了上述病毒外,m6A修饰对其他病毒,尤其是在禽类病毒的感染或宿主细胞的抗感染过程中的调控作用并不清楚。新城疫病毒(Newcastle disease virus,NDV)是一种单股负链RNA病毒,是危害禽类动物及养殖业的主要病原体之一。本研究以m6A修饰甲基转移酶METTL3/METTL14和NDV为研究对象,探索m6A修饰对NDV复制的影响,为禽类病毒的理论研究拓展新领域,同时也为研究禽类病毒药物靶点提供新的理论依据。
1 材料与方法
1.1 细胞、载体和毒株鸡巨噬细胞(HD11)、E.coliDH5α感受态细胞由本室冻存;pEASY®-T1载体购自北京全式金生物技术有限公司;pcDNA3.1(+)载体由本室冻存;NDV NA-1株由本室冻存。
1.2 主要试剂反转录酶M-MLV、重组RNase抑制剂购自北京宝日医生物技术有限公司;高保真酶HiFi、T4DNA连接酶、DNA Marker、蛋白Marker、去内毒素质粒大提试剂盒以及BCA蛋白浓度测定试剂盒购自北京全式金生物技术有限公司;CCK-8细胞毒性检测试剂盒购自日本同仁公司;Eastep®Super总RNA提取试剂盒购自上海普洛麦格公司;m6A甲基转移酶抑制剂(3-deazaadenosine hydrochloride,DAA)购自MCE公司;Opti-MEMTMⅠ减血清培养基购自Gbico公司;兔抗METTL3和兔抗METTL14抗体购自CST公司;羊抗兔IgG-HRP和羊抗小鼠IgG-HRP购自Immunoway公司。
1.3 引物设计根据NCBI公布的鸡源甲基转移酶METTL3序列(XM_025145967.1)和METTL14序列(NM_001031148.1)设计引物(表1),引物Q-M3 F/Q-M3 FR和Q-M14 F/ Q-M14 R分别用于分析甲基转移酶METTL3和METTL14的转录水平和扩增METTL3和METTL14全长基因。

表1 引物信息
1.4 NDV感染后mRNA整体甲基化水平分析将NA-1株以MOI=0.1感染HD11细胞24 h后,提取细胞总mRNA,按照EZ RNA Methylation Kit (ZYMO)操作说明书分析病毒感染后宿主mRNA甲基化总体水平,根据公式m6A%=[(样品D值-阴性对照D值)/样品RNA总量]/[(阳性对照D值-阴性对照D值)/阳性样品RNA总量]×100%分析细胞mRNA甲基化水平变化。
1.5 NDV感染对METTL3及METTL14的表达水平分析将NDV NA-1株以MOI=0.1感染HD11细胞24 h,按照Eastep®Super总RNA提取试剂盒操作说明书提取细胞总RNA以及利用RIPA蛋白裂解液处理细胞提取细胞总蛋白。将RNA反转录后利用荧光定量PCR分析METTL3及METTL14的转录水平;将提取的细胞总蛋白利用BSA蛋白浓度测定试剂盒定量后,采用Western blot试验分析METTL3及METTL14的翻译水平。
利用激光共聚焦试验分析METTL3及METTL14在胞内分布,具体方法:将HD11细胞按照3×105个/孔铺板于含有细胞爬片的12孔板中,16 h 后以MOI=0.1接种NA-1株,24 h后弃掉上清,采用4%组织细胞固定液固定10 min, 0.1%Triton-X100通透15 min,5%的BSA室温封闭1 h,分别加入1∶500 稀释的兔抗METTL3和METTL14抗体,4℃过夜孵育,加入1∶500稀释的荧光标记二抗室温孵育1 h,加入DAPI染核5 min,期间利用PBS清洗3次。
1.6 抑制甲基转移酶功能对NDV复制的影响以30 μmol/L m6A甲基化抑制剂DAA 处理HD11细胞12 h,随后接种MOI=0.1的NDV NA-1株,24 h后弃掉培养上清,按照Eastep®Super总RNA提取试剂盒操作说明书提取细胞总RNA,利用荧光定量PCR分析NDV参与形成RNPs复合物的NP基因及毒力基因F和HN的转录水平。
1.7 METTL3及METTL14过表达质粒构建提取HD11细胞总RNA,反转录后扩增METTL3和METTL14基因,并引入FLAG标签,分别与pcDNA3.1载体进行连接,构建pcDNA3.1-FLAG-METTL3与pcDNA3.1-FLAG-METTL14过表达质粒。将连接产物转化至DH5α感受态细胞中,利用PCR及双酶切对其进行鉴定,按照去内毒素质粒大提试剂盒操作说明书提取鉴定正确的质粒。
1.8 过表达甲基转移酶对NDV复制的影响按照转染试剂说明书分别将pcDNA3.1空载体、pcDNA3.1-FLAG-METTL3与pcDNA3.1-FLAG-METTL14转染至60%~70%密度的HD11细胞中,18 h后按照MOI=0.1接种NDV NA-1株;病毒感染后18 h提取细胞总RNA及总蛋白,利用荧光定量PCR及Western blot分析m6A甲基转移酶对NDV的转录及翻译水平。
1.9 统计学分析采用Graph-Pad 6.0 软件对数据进行t检验或单因素方差统计学分析并绘制图表。
2 结果
2.1 宿主细胞RNA整体甲基化水平检测病毒感染后采用EZ RNA Methylation Kit (ZYMO)分析HD11细胞的RNA整体甲基化水平,结果如图1所示,NDV感染组总RNA的m6A修饰百分比显著高于未感染组(P<0.05),表明NDV感染后能够显著增加宿主细胞总RNA的整体甲基化水平。
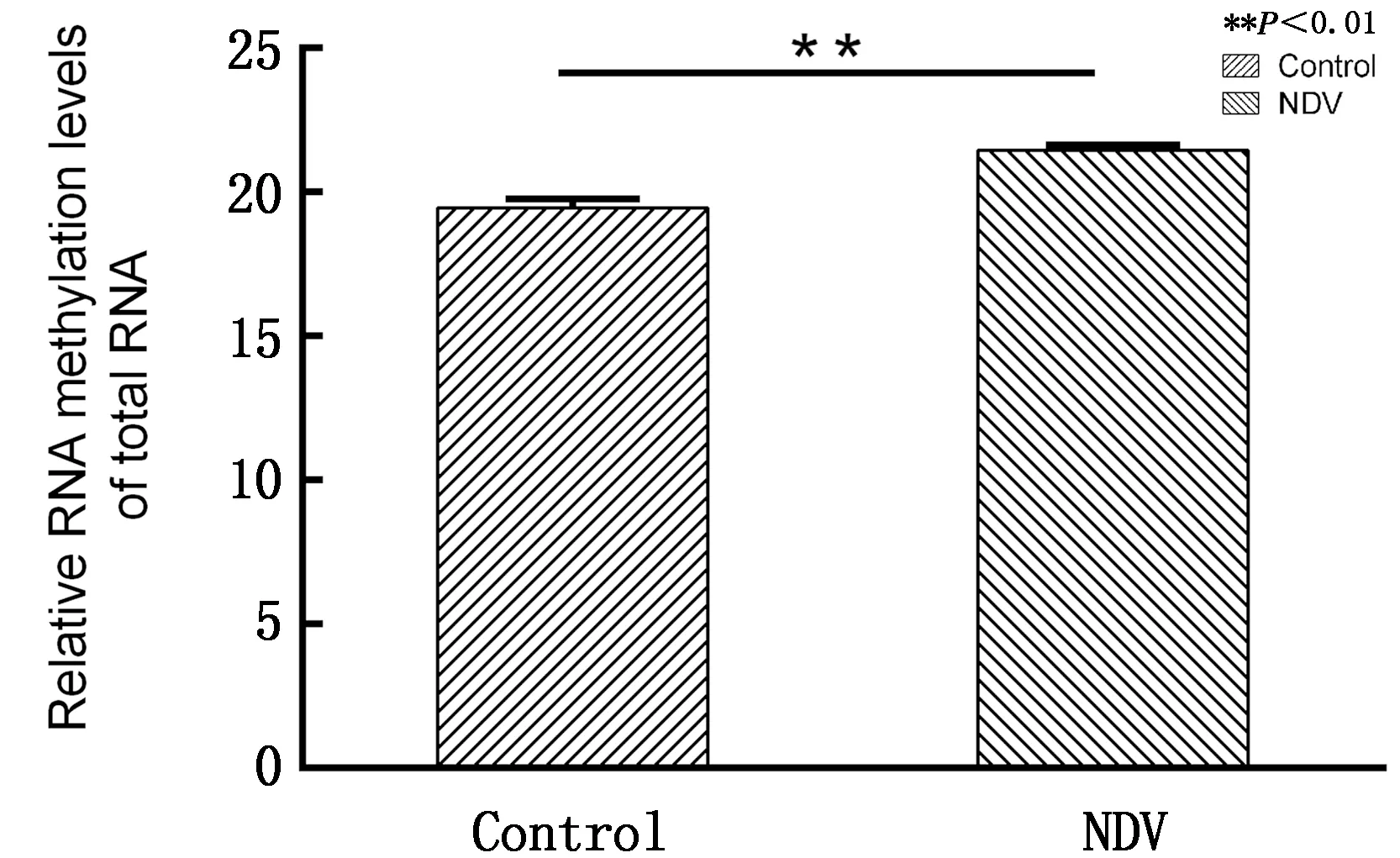
图1 总RNA m6A百分比检测
2.2 METTL3及METTL14表达水平分析荧光定量PCR结果显示,与未感染组相比,NDV感染后显著抑制METTL3的mRNA转录(P<0.001),但上调了METTL14的mRNA转录(P<0.001)(图2A);与之相符,Western blot(图2B)和免疫荧光(图2C)结果显示,NDV感染后能够抑制METTL3的表达,而促进METTL14的表达。

A.mRNA转录水平分析;B,C.蛋白翻译水平分析
2.3 抑制甲基转移酶功能可促进NDV复制利用可消耗细胞内甲基供体S-腺苷甲硫氨酸的DAA处理进而抑制m6A甲基转移酶的功能后,荧光定量PCR结果显示(图3),NDV的NP、F及HN基因的转录水平显著上调(P<0.001)。

图3 NDV NP、F和HN基因转录水平检测
2.4 METTL3及METTL14过表达质粒的构建及鉴定构建过表达质粒pcDNA3.1-FLAG-METTL3和pcDNA3.1-FLAG-METTL14,利用PCR及双酶切对其进行鉴定,结果如图4所示,METTL3基因大小约为1 800 bp,METTL14基因大小约为1 400 bp,pcDNA3.1空载体片段约5 400 bp,均与理论值相符。

A.pcDNA3.1-FLAG-METTL3质粒鉴定;B.pcDNA3.1-FLAG- METTL14质粒鉴定。M.Trans2K plus DNA Marker;1.PCR扩增结果;2.双酶切鉴定结果
2.5 过表达甲基转移酶抑制NDV复制荧光定量结果显示,与对照组(PC+NDV)相比,过表达METTL3(PM3)与METTL14均能显著抑制NDV NP基因的mRNA转录(P<0.001)(图5A);Western blot结果显示两者均能显著抑制NP蛋白的翻译(图5B),其中过表达METTL14的抑制作用更为显著。
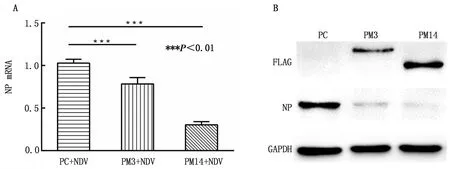
A.NP基因mRNA转录水平分析;B.NP基因翻译水平分析
3 讨论
与DNA和组蛋白相似,RNA也经历动态和可逆的化学修饰,以调控基因的表达。在真核生物及细菌、病毒等原核生物的多类RNA中已经发现了数百种不同的化学基团,可在RNA 的4个核苷酸的1个或多处进行修饰,其中以m6A修饰最为普遍。已有研究表明m6A对mRNA的稳定性有重要调节作用,进一步影响mRNA的翻译、出核以及与蛋白质的相互作用。20世纪80年代前就已经在劳斯氏肉瘤病毒[14]和猴空泡病毒40[15]等病毒的RNA中发现了m6A修饰,直至2012年,由于转录组甲基化RNA 免疫沉淀(MeRIP)与N6-甲基腺苷测序(m6A-seq)技术的开发[16-17],研究者才开始探索 m6A 修饰在病毒致病机理中的作用,但仍对病毒感染和致病机理的调控知之甚少。NDV感染后增强了RNA的总体甲基化水平,宿主细胞或可通过m6A甲基机制抑制病毒复制,病毒也可能劫持该机制逃避免疫系统的监视。已有研究表明含有m6A修饰的RNA与RIG-I的结合能力较弱,不能触发经典的RIG-I通路[18]。m6A甲基化修饰的RNA只能诱导DC细胞产生少量的细胞因子,刺激表达TLRs的细胞时也只能引起少量免疫激活标志物的释放,无法诱导较强的先天免疫反应[19]。与未修饰的外源性circRNA抗原佐剂相比,m6A修饰的circRNAs抑制了免疫基因活化和佐剂活性,诱导抗原特异性T细胞活化、抗体产生和体内抗肿瘤免疫的能力减弱[20]。
m6A甲基转移酶METTL3和METTL14能以S-腺苷甲硫氨酸(S-adenosylmethionine,SAM) 为甲基化供体,催化RNA的m6A形成[2,21]。NDV感染后,宿主细胞METTL3和METTL14转录及表达水平均有变化,这或许也是导致病毒感染后RNA整体甲基化水平发生变化的原因。m6A修饰主要通过相关酶调控宿主及病毒基因转录后修饰,进而影响病毒的复制及感染。已有研究显示METTL3和METTL14对HIV-1[4-5]、IAV[6]和RSV[9]等病毒的感染过程起正调控作用,却充当ZIKV[12]、HCV[11]等病毒的转录后负调控因子,导致这种不同作用效果的原因暂不清楚,推测与病毒的复制场所或病毒毒力基因的靶分子不同有关。本研究利用DAA消耗细胞内甲基供体SAM抑制m6A的甲基转移酶功能,显著促进NDV NP基因的转录,而过表达METTL3和METTL14抑制了NDV NP基因的转录及翻译,表明甲基转移酶在NDV的复制过程中起负调控作用,这与在细胞质中复制的病毒如ZIKV、HCV等的结果相似。其中METTL14较METTL3具有更强的抑制NDV复制的作用,可能与METTL14蛋白更高的甲基化活性有关[2]。但m6A甲基转移酶如何介导NDV复制的具体机制还有待进一步研究。综上,本研究发现NDV感染后,增加了RNA的总体甲基化水平,这或与甲基转移酶的表达量发生变化有关,并进一步证明m6A甲基转移酶对NDV的复制起负调控作用,为了解m6A修饰在不同病毒中的生物学功能具有重要意义,也拓展了m6A修饰对禽类病毒研究领域科学前沿,为禽类病毒与宿主研究提供新思路。
