基于非洲猪瘟病毒CD2v基因TaqMan荧光定量PCR检测方法的建立
2021-06-17孙茂文周萍萍罗玉子仇华吉
韩 玉,王 涛,潘 力,孙茂文,周萍萍,王 冰,王 翌,罗玉子,仇华吉,孙 元
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种高度接触性、广泛出血性的猪烈性传染病,死亡率可达100%。该病在撒哈拉以南非洲地区已经流行多年,在过去10多年中,主要在高加索地区和东欧地区流行,自2018年传入中国以来迅速蔓延至全国各地,并存在进一步扩大的风险,给养猪业造成了无法预估的经济损失[1-2]。
ASFV为非洲猪瘟相关病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的成员[3],也是目前已知的唯一虫媒DNA病毒,主要通过病猪/带毒猪及其污染的产品与易感猪之间的直接接触或通过钝缘蜱属软蜱传播。ASFV具有严格的细胞嗜性,主要感染巨噬细胞(macrophages)和外周血单个核细胞(peripheral blood mononuclear cells,PBMC)[4]。ASFV基因组为双链闭合线性DNA分子,不同分离株的基因组大小在170~194 kb之间,可编码160多种蛋白[3-4]。CD2v作为ASFV重要的囊膜糖蛋白,胞外域含有2个免疫球蛋白样结构域和信号肽,与淋巴细胞CD2蛋白高度同源,可将红细胞聚集在表达CD2v的细胞表面[5]。CD2v介导的ASFV与红细胞结合也有助于病毒在动物体内的扩散和免疫逃逸,但具体的分子机制目前未知。另外,目前已经鉴定出CD2v上存在4个T细胞表位区域,这表明在ASFV感染时诱导产生了针对CD2v蛋白的细胞免疫应答[6]。近几年研究表明,ASFV基因缺失减毒活疫苗是最有希望成功的一种疫苗,中国农业科学院哈尔滨兽医研究所构建的7基因缺失病毒(MGF505-1R、MGF360-2R、MGF360-3R、MGF-360-12L、MGF505-13L、MGF505-14L和CD2v)能对中国流行的ASFV强毒株提供完全免疫保护,可作为有效防控中国ASF疫情的疫苗候选株[7],由此可见,该疫苗候选株具有较好的研发和应用前景。
实时荧光定量PCR检测方法具有快速、灵敏度高和特异性强的优点,广泛应用于动物病原的诊断。由于其可以准确对病原进行定量,该方法也被大量应用于基础研究。基于此,本研究以ASFV中国流行株的重要基因CD2v为靶标,建立针对ASFVCD2v的TaqMan实时荧光定量PCR检测方法,并对该方法进行初步评价,以期为后续ASFVCD2v基因功能研究及野毒株与CD2v基因缺失毒株的鉴别检测奠定基础。
1 材料与方法
1.1 病毒和细胞ASFV/HLJ-18株(MK333180.1)由中国农业科学院哈尔滨兽医研究所猪烈性传染病创新团队(本实验室)分离鉴定并保存;ASFVCD2v基因缺失毒株(ASFV-ΔCD2v株)由本实验室构建并保存;ASFV/HLJ-18株(ASFV)的核酸样品由本研究组提取并保存;猪瘟病毒(CSFV)、伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪传染性胃肠炎病毒(TGEV)、猪圆环病毒1型(PCV1)和猪圆环病毒2型(PCV2)核酸样品均由本实验室保存;无特定病原体猪(SPF猪)的肺泡巨噬细胞(PAM)由本实验室分离并保存;30份临床样品来自2019年本团队保存的送检病料,包括抗凝血和鼻拭子。
1.2 主要试剂AxyPrepTMBody Fluid Viral DNA/RNA提取试剂盒购自康宁生命科学(吴江)有限公司;Premix PrimeSTAR HS和Premix Ex TaqTM(Probe qPCR)均购自宝生物工程(大连)有限公司;pOK12载体由本研究组保存;DH5α感受态菌、DNA凝胶回收试剂盒和质粒小提试剂盒购自天根生化科技(北京)有限公司;ClonExpress Ⅱ One Step Cloning Kit购自南京诺唯赞生物科技股份有限公司;Antibiotic-Antimycotic和RPMI 1640含L-谷氨酰胺培养基购自赛默飞世尔科技(中国)有限公司。
1.3 引物及探针参考GenBank中的ASFV全基因组(MK333180.1),选择CD2v基因序列设计引物CD2v-F/CD2v-R用于构建阳性质粒标准品,扩增的片段长度为811 bp;引物C-F/C-R/C-P为荧光定量PCR的上、下游特异性引物和探针,片段大小为101 bp;以上所有引物和探针的序列见表1,由宝生物工程(大连)有限公司合成。

表1 本研究所用的引物
1.4 阳性质粒标准品的构建与鉴定以本实验室保存的ASFV/HLJ-18株核酸为模板,使用引物CD2v-F/CD2v-R扩增目的基因,反应条件为:95℃ 5 min;95℃ 30 s,55℃ 30 s,72℃ 1 min,共30个循环;72℃ 10 min;PCR产物回收纯化后,按照ClonExpress Ⅱ One Step Cloning Kit说明书将其克隆至经EcoRⅠ酶切的pOK12载体,构建重组质粒pOK12-CD2v,经PCR和测序鉴定正确后作为质粒标准品。采用超微量分光光度计测定重组质粒标准品浓度,根据公式:拷贝数=(6.02×1023拷贝数/mol) × DNA量(g)/[DNA长度(碱基数)×660 Da/碱基],计算标准品拷贝数。
1.5 荧光定量PCR标准曲线的建立将已知拷贝数的质粒标准品10倍梯度稀释(1.6×101~1.6×108拷贝 /μL),并以每个稀释度的质粒标准品为模板按照已优化的条件进行TaqMan荧光定量PCR扩增。反应体系为25 μL:Premix Ex TaqTM(Probe qPCR)12.5 μL、ddH2O 8.25 μL、上、下游引物各0.5 μL(10 μmol/L)、探针1 μL(5 μmol/L)、模板2 μL、ROX 0.25 μL;反应条件为:95℃ 30 s,95℃ 5 s,55℃ 10 s,延伸72℃ 20 s,共40个循环。对不同浓度的质粒标准品及阴性对照设置3个重复。反应结束后得到动力学曲线,并根据结果绘制出相应的标准曲线。
1.6 特异性试验以CSFV、PRV、PRRSV、TGEV、PCV1、PCV2和ASFV/HLJ-18的核酸为模板,按照1.5已优化的条件,同时进行TaqMan荧光定量PCR扩增,评价该方法的特异性。
1.7 敏感性试验将构建的质粒标准品10倍梯度稀释后(1.6×100~1.6×1010拷贝/μL),利用引物CD2v-F/CD2v-R进行常规PCR扩增;同时按照已优化的条件以本研究所建立的ASFVCD2v基因TaqMan荧光定量PCR进行扩增,比较两者的结果以确定该方法的敏感性。
1.8 重复性试验选取1.6×103~1.6×107拷贝/μL共5个浓度的标准品质粒为模板,每个浓度5个重复,按照已优化的条件进行荧光定量PCR扩增,进行组内重复性试验。在不同时间点分别检测3次,进行组间重复性试验。根据检测所得Ct值计算组内和组间的变异系数,初步评估该方法的重复性。
1.9 ASFV野毒株和CD2v基因缺失毒株的鉴别诊断首先,将本实验室分离的PAM细胞计数后分装在12孔细胞培养板(每孔约含细胞1.0×105个);然后,共设置3个试验组分别为:ASFV/HLJ-18组、ASFV/HLJ-18-ΔCD2v组和空白对照组,每组3个重复,并按照MOI = 1的剂量同步感染ASFV/HLJ-18和ASFV/HLJ-18-ΔCD2v,置于5% CO2细胞培养箱中培养48 h,分别收取ASFV/HLJ-18、ASFV/HLJ-18-ΔCD2v感染和空白对照组的上清,按照AxyPrepTMBody Fluid Viral DNA/RNA提取试剂盒说明书提取病毒DNA,然后利用本研究建立的方法进行扩增;最后,根据扩增结果判断ASFV野毒株和CD2v基因缺失毒株的鉴别诊断效果。
1.10 临床样品检测取本实验室保存的30份临床样品,包括鼻拭子和抗凝血,解冻后将鼻拭子震荡后瞬时离心取200 μL上清备用,抗凝血直接取200 μL 备用,参照AxyPrepTMBody Fluid Viral DNA/RNA提取试剂盒说明书步骤进行操作提取DNA。利用本实验室先前建立的ASFV荧光定量检测方法[8]与本研究所建立的方法同时对临床样品进行检测,比较这两种方法的一致性和差异是否具有统计学意义,并计算两者的符合率。
1.11 统计学分析利用SPSS 24.0软件进行一致性和配对卡方检验,比较2种检测方法的结果,Kappa值>0.75,则认为2种方法的一致性较好,P<0.05为差异有统计学意义。
2 结果
2.1 标准品的制备以本实验室保存的ASFV/HLJ-18株核酸为模板进行PCR扩增,得到大小为811 bp的目的条带(图1),与预期相符。将目的片段克隆至pOK12载体上,构建含CD2v基因的质粒标准品,经测序鉴定后,提取质粒标准品并测定其浓度为516 ng/μL,经过计算拷贝数为1.6×1011拷贝/μL。表明,重组质粒标准品pOK12-CD2v正确构建。
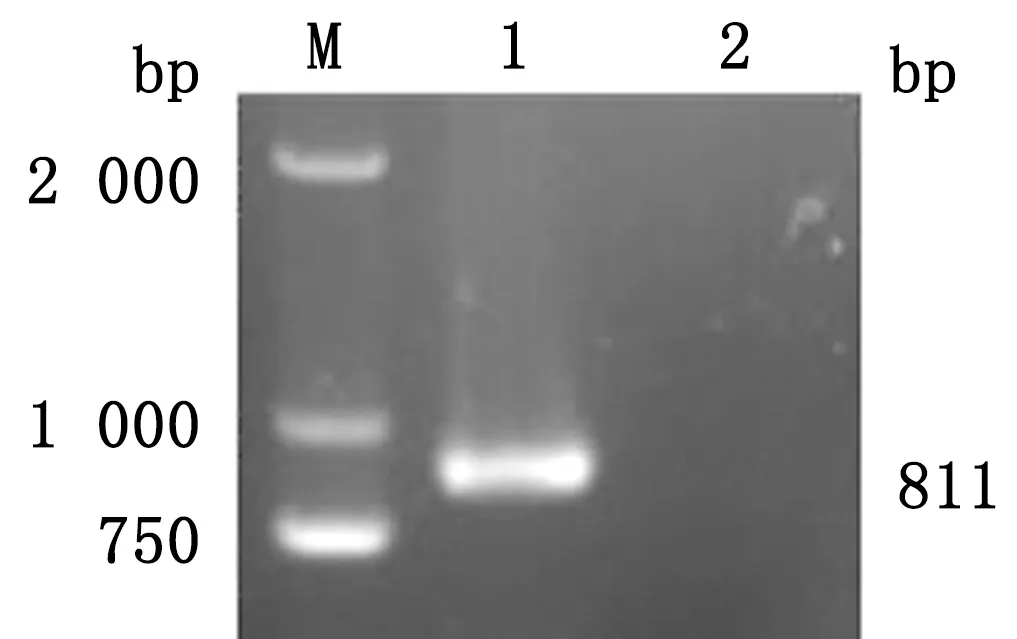
M.DL2 000 DNA Marker;1.CD2v Gene;2.Negative control
2.2 ASFVCD2v基因荧光定量PCR标准曲线的建立将1.6×101~1.6×108拷贝 /μL质粒标准品按照已优化的反应条件进行TaqMan荧光定量PCR扩增,使用QuantStudioTMDesign & Analysis Software v1.4.3分析软件绘制其标准曲线(图2),得到线性回归方程为:y= -3.241x+43.259,其中y为Ct值,x为标准品拷贝数的对数值,R2为0.998,扩增效率为103.5%,最低检测限为16拷贝 /μL。
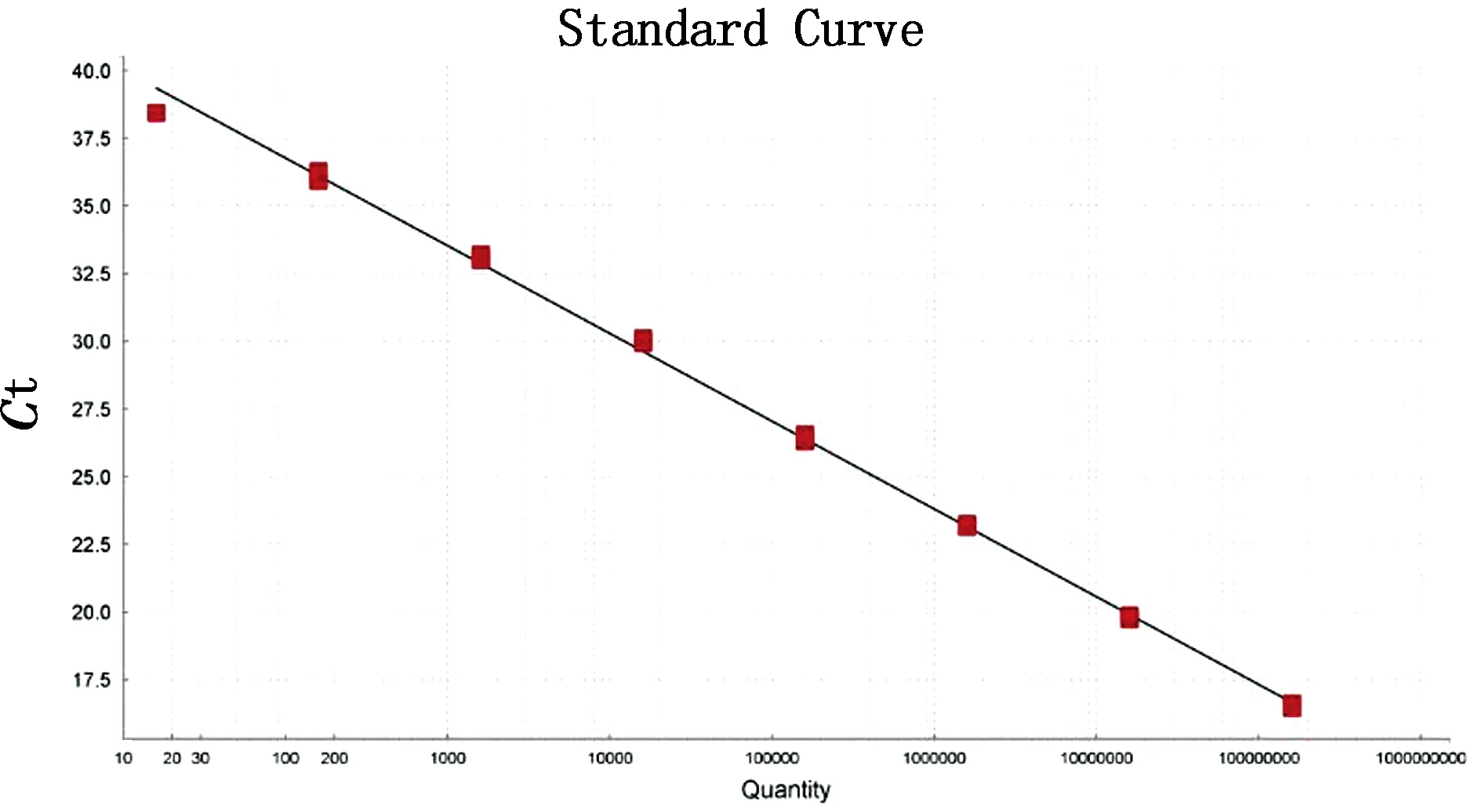
图2 ASFV CD2v基因标准曲线的建立
2.3 ASFV CD2v基因荧光定量PCR的特异性试验结果利用本研究建立的TaqMan荧光定量PCR方法对CSFV、PRV、PRRSV、TGEV、PCV1、PCV2和ASFV/HLJ-18的核酸(cDNA/DNA)进行扩增,结果显示仅ASFV/HLJ-18的DNA出现扩增曲线,其余病毒核酸和阴性对照均未出现扩增曲线(图3)。表明该检测方法中设计的引物和探针特异性强。
2.4 ASFV CD2v基因荧光定量PCR的敏感性试验结果将10倍梯度稀释的重组质粒标准品进行荧光定量PCR和常规PCR扩增。结果显示,本研究建立的针对ASFVCD2v基因的TaqMan荧光定量PCR方法对重组质粒标准品的最低检测限为16拷贝/μL(图4A),常规PCR能够检测到的重组质粒标准品的最低检测限为1.6×104拷贝/μL(图4B);该方法比常规PCR检测方法的敏感性高出3个数量级。
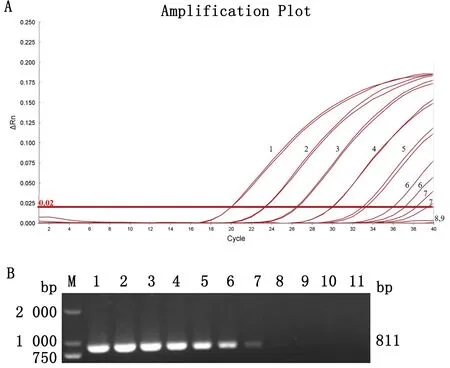
A.1~8.1.6×107~1.6×100copies/μL plasmid standard;9.Negative control;B.M.DL2000 DNA Marker;1~10.1.6×1010~1.6×101 copies/μL plasmid standard;11.Negative control
2.5 ASFV CD2v基因荧光定量PCR的重复性试验结果取10倍梯度稀释得到的1.6×103~1.6×107拷贝/μL共5个浓度的标准品质粒,按照相同的条件进行荧光定量PCR扩增;结果显示,组内变异系数(CV)均小于1%,组间变异系数(CV)均小于2%,表明本检测方法的重复性和稳定性良好(表2)。
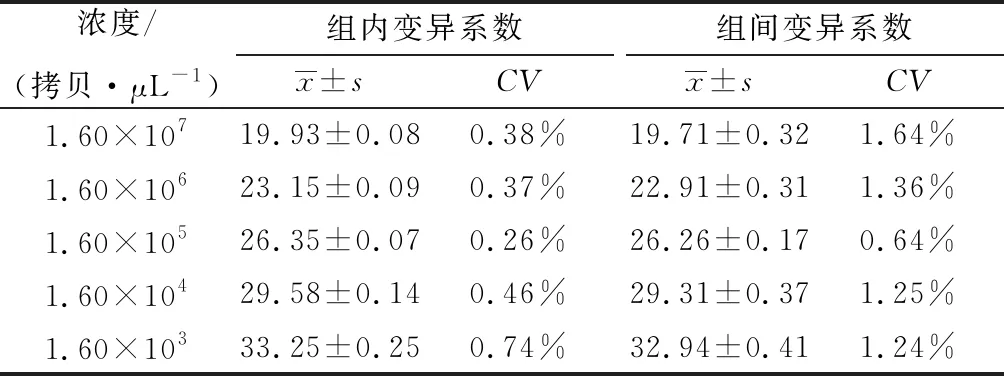
表2 ASFV CD2v基因TaqMan实时荧光定量PCR的重复性试验
2.6 ASFV野毒株和CD2v基因缺失毒株的检测结果利用该方法检测在阳性对照与阴性对照成立的情况下,ASFV/HLJ-18株核酸的Ct值平均为24.1,能够特异性扩增,而ASFV/HLJ-18-ΔCD2v株的核酸无Ct值,没有扩增(图5)。表明该方法能够有效地鉴别ASFV野毒株和CD2v基因缺失毒株。
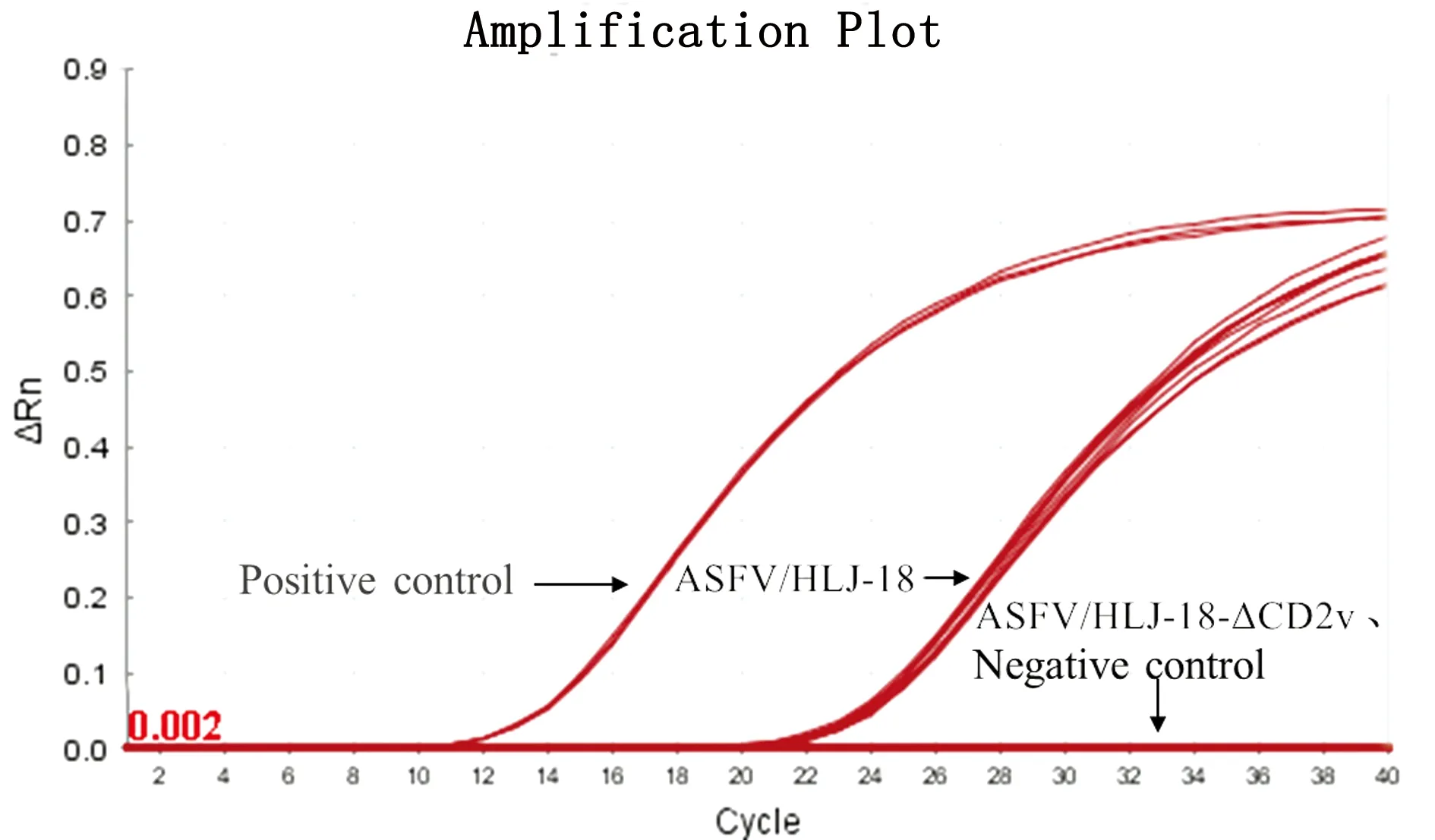
图5 ASFV CD2v野毒株与基因缺失毒株与的检测结果
2.7 临床样品的检测结果运用本研究建立的针对ASFVCD2v的TaqMan荧光定量PCR检测方法和之前本实验室建立的针对ASFVp72基因的TaqMan荧光定量PCR检测方法同时对30份临床样品进行检测,阳性符合率为100%(13/13),阴性符合率为82%(14/17),总符合率为90%(27/30)。McNemer检验的结果,P> 0.05,表明两种检测方法结果无统计学差异;Kappa检验的结果,Kappa = 0.802>0.75,提示这两种检测方法一致性较高(表3)。

表3 两种方法的检测结果
3 讨论
ASFV的结构复杂、基因组十分庞大,目前超过半数的基因功能未知,这严重制约了ASFV感染和致病机制的研究。经过多年对CD2v的研究发现,该蛋白在ASFV的传播和免疫逃逸中发挥重要作用,但具体分子机制尚不清楚[4],因此关于CD2v的功能有必要进一步研究。ASFVCD2v基因缺失病毒在病毒与宿主互作研究中发挥重要作用,有助于解析其功能。目前主要通过同源重组方法来构建ASFV基因缺失病毒,由于重组率极低,其中关键的一步是通过空斑纯化或/和有限稀释法对重组病毒进行纯化,最后需要对重组病毒进行鉴定,筛查是否还存在野毒株。常规PCR敏感性低,若亲本毒含量极低,则会出现假阴性而导致误判,实时荧光定量PCR检测方法很好的填补了这个缺陷。
ASF对全球养猪业的危害日益严重,因此亟需开展综合防控技术及疫苗研发[9]。在过去的几十年中,科学家们对不同类型的ASF疫苗进行了评估。其中灭活疫苗、DNA疫苗、亚单位疫苗和腺病毒载体疫苗的免疫保护效果不尽人意。相比之下,减毒活疫苗和基因缺失疫苗具有一定优势[10]。国内外相关研究已证实,不同基因型的ASFVCD2v单缺失毒株致弱效果差异较大:ASFV BA71株(基因Ⅰ型)缺失CD2v后完全致弱且免疫后具有完全交叉保护效果[11],Malawi LiL-20/1(基因Ⅷ型)缺失CD2v未能致弱[12],而国内流行毒株(基因Ⅱ型)缺失CD2v后进行免疫,存活率为0~75%不等[7,13]。但是,我国研发的包含CD2v在内的ASFV 7基因缺失毒株可针对中国流行的ASFV强毒株提供完全免疫保护,将来可能应用于市场,故而亟需配套的鉴别诊断方法来区分ASFV野毒株和CD2v基因缺失毒株[7]。基于以上分析,本研究建立了以CD2v为靶基因的TaqMan实时荧光定量PCR检测方法。
本研究建立的TaqMan荧光定量PCR方法特异性强、灵敏度高、重复性好。该方法可以特异性检测ASFV,与CSFV、PRV、PRRSV、TGEV、PCV1和PCV2等猪的多种常见病原不存在交叉反应;该方法最低可检测16拷贝/μL的ASFV核酸,比常规PCR检测方法的敏感性高出3个数量级;同时,组内和组间变异系数都小于2%;另外,该方法能够有效地鉴别ASFV野毒株和CD2v基因缺失毒株,与本实验室先前建立的针对ASFVp72基因的荧光定量PCR检测方法相比无统计学差异且符合率较高,因此也可使用该方法对疑似样品进行再次验证。自ASF传入我国以来,给我国养猪业造成了巨大的经济损失。结合ASF复杂的流行病学特点及我国养猪业现状,该病的防控和根除将是一场艰难的持久战[14],因此十分有必要对ASFV展开深入系统的研究。本研究建立的针对ASFVCD2v基因的TaqMan荧光定量PCR方法不仅丰富了ASFV的诊断靶标,也为今后ASFV的基础研究提供良好技术支持。
