乳腺癌中肽转运蛋白1的表达及临床病理意义
2021-06-17王志皓盛有璟彭炜东
王志皓,盛有璟,彭炜东,吴 强,
乳腺癌是女性最常见的恶性肿瘤,也是全球女性癌症死亡的主要原因。截至2020年,全球乳腺癌新发病例230万,占女性新发恶性肿瘤的11.7%,其死亡人数占女性死亡病例的6.9%[1]。乳腺癌根据受体类型不同分为四种亚型:Luminal A型、Luminal B型、HER-2过表达型和三阴型乳腺癌(triple negative breast cancer, TNBC)[2]。非三阴型乳腺癌(non-triple negative breast cancer, non-TNBC)的治疗方法以内分泌治疗或抗HER-2靶向治疗为主,再辅以化疗,患者预后良好。TNBC是一组ER、PR及HER-2均为阴性的乳腺癌,与non-TNBC相比,其发病年龄早,复发率较高[3-5]。目前,TNBC由于缺乏药物靶向受体,治疗效果不甚理想,国际推荐全身化疗为首选治疗方案[6]。根据TNBC分子亚型的不同,化疗方案的组合繁多,预后差异较大[7-10]。因此,探索预测乳腺癌治疗的生物学标志物,对乳腺癌特别是TNBC有重要意义。肽转运蛋白1(peptide transporter 1,PEPT1)属于跨膜转运蛋白,最早被发现在小肠黏膜组织中高表达,其介导寡肽吸收并可促进药物吸收[11]。近年,PEPT1在消化、呼吸和泌尿系统肿瘤中的表达及作用受到关注[12-15],但在乳腺癌中的表达及其与患者预后的相关性未见报道。本文采用免疫组化MaxVision法检测乳腺癌中PEPT1的表达,探讨其与乳腺癌临床病理特征及预后的关系,为预测临床疗效提供新思路。
1 材料与方法
1.1 临床资料收集2014~2018年安徽医科大学第一附属医院病理科存档的80例女性乳腺浸润性导管癌手术组织蜡块、40例癌旁正常乳腺手术组织蜡块,术前均未进行放、化疗。患者中位年龄50.0岁(31~80岁);肿瘤中位直径3.0 cm(0.5~7.0 cm)。根据WHO(2019)乳腺肿瘤分类标准进行病理学分类、分级[16],其中Ⅰ级16例、Ⅱ级35例、Ⅲ级29例。根据第八版美国癌症联合会(the American Joint Committee on Cancer, AJCC)TNM分期标准进行分期[17],所有病理切片均经两位主治及以上病理医师共同阅片,ER、PR、HER-2及Ki-76的数据均来源于既往病理学报告的复核数据。术后根据分子亚型接受不同方案的全身系统性治疗:Luminal型内分泌治疗+化疗,HER-2过表达型靶向抗HER-2+化疗,TNBC仅化疗。术后随访6~80个月,患者有复发、远处转移、死亡或失联时截止。
1.2 主要试剂兔抗人Anti-SLC15A1/PEPT1多克隆抗体(克隆号:ab78020),购自Abcam公司。酶标山羊抗小鼠/抗兔IgG聚合物(通用型)、PBS磷酸缓冲盐粉末、柠檬酸钠缓冲液粉末、内源性过氧化物酶阻断剂及DAB显色液,均购自福州迈新公司。
1.3 方法
1.3.1生物信息学数据分析 登录TIMER 2.0数据库(http://timer.comp-genomics.org/),检索PEPT1 mRNA在乳腺癌和正常乳腺组织中的相对表达量。登录Kaplan-Meier Plotter数据库(https://kmplot.com/analysis/index.php?p=background),分析 PEPT1 mRNA表达与乳腺癌患者预后的相关性。
1.3.2免疫组化 采用免疫组化MaxVision法染色检测PEPT1的表达。切片经脱蜡、抗原修复后,4 ℃过夜孵育一抗,孵育二抗后DAB显色,苏木精复染后,脱水,透明,封固。
1.4 结果判读本实验采用半定量法进行判断,PEPT1以棕黄、棕褐染色颗粒定位于细胞膜为阳性。(1)根据细胞着色强度计分:无着色为0分,浅黄色为1分,浅棕色为2分,棕褐色为3分。(2)根据阳性细胞百分比计分:无阳性细胞为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。将两项得分结果相乘:0~2分为不表达,3~5分为低表达,6分及以上为高表达。
1.5 统计学分析采用Graphpad Prism 8.3.0软件进行统计学分析,样本率组间比较采用χ2检验,Fisher精确检验。应用Spearman等级相关检验分析相关性,采用Kaplan-Meier进行生存分析。以P<0.05为差异有统计学意义。
2 结果
2.1 TIMER 2.0数据库PEPT1 mRNA在正常乳腺组织和乳腺癌不同分子亚型中的表达采用TIMER 2.0数据库,分析1 093例浸润性乳腺癌和112例正常乳腺组织中PEPT1 mRNA的相对表达量。结果显示:PEPT1 mRNA在正常乳腺和乳腺癌组织中的表达差异有显著性(P<0.001);在Luminal A、Luminal B型乳腺癌中稍低于正常乳腺组织。PEPT1 mRNA在HER-2过表达型、TNBC中明显高于正常乳腺组织,TNBC的PEPT1相对表达量在乳腺癌的四种分型中最高(图1)。

图1 PEPT1 mRNA在正常乳腺组织和乳腺癌四种分子亚型中的表达
2.2 Kaplan-Meier Plotter数据库中PEPT1的表达与乳腺癌预后的关系利用Kaplan-Meier Plotter数据库分析PEPT1表达与乳腺癌四种亚型患者预后的关系。结果显示:Luminal A、Luminal B型及TNBC中PEPT1高表达,患者20年无复发生存期(relapse-free survival, RFS)明显高于低表达者(HR=0.7,95%CI0.59~0.83vsHR=0.65,95%CI0.52~0.8vsHR=0.73,95%CI0.58~0.91);HER-2过表达型PEPT1表达与20年RFS无明显相关性(图2)。

图2 PEPT1的表达与乳腺癌四种亚型患者RFS的关系:A.Luminal A型;B.Luminal B型;C.HER-2型;D.TNBC
2.3 乳腺癌及癌旁正常组织中PEPT1的表达本组采用免疫组化MaxVison法对80例乳腺浸润性导管癌石蜡包埋组织和40例癌旁正常组织进行PEPT1蛋白检测。PEPT1阳性染色颗粒主要定位于癌细胞及少数乳腺上皮细胞,37例细胞核呈弥漫阳性,其中4例同时可见胞质弱阳性。45例癌旁组织中4例高表达,占8.9%;80例乳腺癌患者中33例PEPT1高表达,占41.2%。乳腺癌中PEPT1高表达显著升高(P<0.000 1,表1,图3)。乳腺癌四种分子亚型中PEPT1的高表达占比存在明显差异,TNBC(65.7%)明显高于non-TNBC(22.2%)(表2)。

图3 癌旁正常组织、乳腺癌组织中PEPT1 的表达,MaxVision法:A.癌旁正常组织中PEPT1呈阴性;B.部分乳腺癌组织中PEPT1呈胞核弥漫阳性;C.部分乳腺癌组织中PEPT1呈阴性

表1 癌旁正常组织和乳腺癌组织中PEPT1的表达[n (%)]

表2 PEPT1的表达与乳腺癌分子分型的相关性
2.4 乳腺癌中PEPT1表达与临床病理特征的关系本组结果显示:PEPT1高表达与患者淋巴结转移(P<0.001)及远处转移(P=0.03)呈负相关。PEPT1高表达与患者年龄、肿瘤直径、组织学分级及ER、PR、HER-2表达、Ki-67增殖指数均无相关性(P>0.05,表3)。

表3 乳腺癌中PEPT1表达与临床病理特征的关系[n (%)]
2.5 PEPT1表达与乳腺癌不同分子亚型患者预后的关系本组80例乳腺癌患者中发生远处转移、复发或死亡的患者合计34例,占42.5%。Kaplan-Meier生存曲线分析显示,PEPT1高表达与术后化疗的TNBC患者3年无进展生存期(progression free survival,PFS)呈显著的正相关(P<0.01,图4)。PEPT1的高表达,与Luminal A、Luminal B型和HER-2过表达型患者3年PFS无明显相关性(P>0.05)。
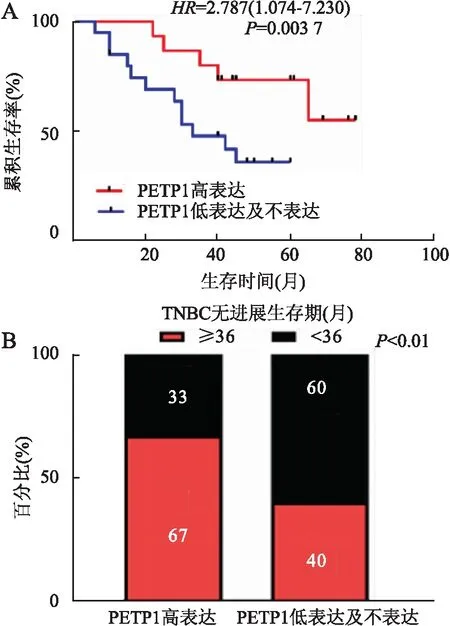
图4 TNBC患者PEPT1高表达与术后化疗后PFS的相关性:A.Kaplan-Meier生存分析;B.直方图
3 讨论
PEPT1属于跨膜转运蛋白,是细胞吸收蛋白质等营养物质的重要介质[11]。近年,PEPT1在不同肿瘤中的表达及作用被相继报道。有学者发现PEPT1在前列腺癌、膀胱癌、胃癌和肝癌细胞中表达增多[12-15],推测其表达增加可能与肿瘤细胞高代谢特性有相关性。Gong等[15]利用肝癌细胞PEPT1高表达的特性,把PEPT1作为药物转运载体,将阿霉素靶向传递至肝癌细胞内,增加其抗肿瘤效果。Huo等[18]报道前列腺癌细胞系PC3和脑胶质细胞瘤细胞系U118中,PEPT1可转运褪黑激素到肿瘤细胞的线粒体内,促进肿瘤细胞凋亡,提示PEPT1可提高褪黑素的疗效。我们利用TIMER 2.0数据库,发现正常乳腺组织和乳腺癌不同亚型的PEPT1表达量具有差异性,TNBC中PEPT1表达量明显高于non-TNBC和正常乳腺组织。PEPT1在Luminal型乳腺癌中和正常乳腺组织表达量差值较少,推测可能由于Luminal型乳腺癌生物学行为较为惰性,肿瘤在某些代谢水平可能与正常细胞相近,故PEPT1表达量较为接近,本研究后续将设计实验探究两者的详细机制。本组采用免疫组化MaxVision法检测80例乳腺癌患者中PEPT1的表达,结果发现TNBC中PEPT1高表达者占65.7%,明显高于癌旁正常组织(8.9%)和non-TNBC(22.2%)。PEPT1的高表达与乳腺癌患者的淋巴结转移和远处转移呈负相关(P均<0.05);与患者年龄、肿瘤直径、组织学分级及ER、PR、HER-2表达、Ki-67增殖指数均无显著相关性(P>0.05)。本组结果提示,PEPT1在乳腺癌和癌旁正常组织中表达差异,可能与乳腺癌的进展相关。
目前,PEPT1表达与乳腺癌患者预后生存的关系尚未见报道。本组结合免疫组化检测和随访结果发现,PEPT1高表达的TNBC患者术后化疗效果较好,≥3年PFS患者的PEPT1高表达组高于不表达+低表达组(67%vs40%)。PEPT1高表达与患者3年PFS有显著相关性(P<0.01),提示PEPT1的表达与TNBC患者预后相关,且PEPT1高表达者的预后优于不表达+低表达者。本实验结果与Kaplan-Meier Plotter数据库的分析结果一致。数据库分析表明PEPT1高表达的Luminal型乳腺癌20年RFS更佳,本组随访结果显示其与患者3年PFS无相关性,可能与Luminal型预后佳、生存期长且PEPT1高表达占比低有关。因此,需进一步随访并积累更多该分子亚型病例加以验证。
本组发现PEPT1高表达与乳腺癌不同分子亚型患者预后的关系不一致,其是否与不同分子亚型全身治疗方案的差异有关还需进一步分析。2019年第16届圣加仑国际乳腺癌大会指出:依据乳腺癌分子亚型制定针对性治疗方案,可显著改善乳腺癌患者的预后[19]。对激素受体阳性乳腺癌患者采用内分泌治疗即可获得较为良好的预后,仅少部分患者可从增加化疗中获益[20-22]。HER-2靶向抗体特异性作用于肿瘤细胞表面HER-2受体,极大改善了HER-2过表达患者的预后[19]。化疗作为经典的系统治疗手段,可见于大部分的乳腺癌治疗方案中,也是TNBC唯一疗效明显的全身治疗方法[6]。多项研究评估乳腺癌不同分子亚型的化疗疗效,虽然TNBC单纯化疗的疗效较为有限,但是对纯化疗的敏感性比non-TNBC稍高[23-25]。Prat等[26]评估451例新辅助化疗乳腺癌患者的病理完全缓解(pathologic complete response,pCR)率,结果显示Luminal A、Luminal B型、HER-2过表达型和TNBC中pCR率分别为5%、15%、16%和36%,差异有统计学意义。Prat等[25]还分析180例接受新辅助化疗乳腺癌患者的穿刺活检病理报告,结果发现Luminal A、Luminal B型、HER-2过表达型和TNBC残余肿瘤负荷(residual cancer burden, RCB)评级为0/1的占比分别为9.3%、20.0%、14.3%和50.0%。两项研究结果均显示TNBC比non-TNBC对化疗药物有更好疗效。本实验通过数据库及免疫组化检测不同亚型乳腺癌中PEPT1的表达,结果显示:TNBC中PEPT1高表达者高于non-TNBC,且TNBC中高表达PEPT1患者术后化疗明显优于不表达+低表达者。因此,我们推测PEPT1的表达可能与TNBC化疗疗效有关,其高表达与化疗效果的相关性可作为后续分析的重点。
综上所述,本组首次探讨PEPT1在乳腺癌不同分子亚型中的表达差异,结果表明PEPT1高表达与TNBC患者化疗预后关系密切,有望成为预测TNBC患者疗效的新生物学指标。
