LncRNA SLC16A1-AS1通过靶向miR-15a-5p负向调控子宫颈癌细胞的增殖和侵袭
2021-06-17占稳稳熊国平吴汝芳胡晓继韩迎燕张庆华
卢 豪,占稳稳,熊国平,吴汝芳,胡晓继,韩迎燕,李 莉,张庆华
子宫颈癌是女性生殖系统常见的恶性肿瘤之一,其发病年龄逐渐呈年轻化,严重威胁女性的生命健康[1]。子宫颈癌的发病涉及遗传、病毒感染等多种因素,尽管子宫颈癌的治疗已取得较大进展,子宫颈癌细胞的高增殖性和侵袭性严重影响患者的预后[2-3]。近年随着分子生物学的发展,分子靶向治疗成为子宫颈癌分析的热点。文献报道,异常表达的长链非编码RNA(long non-coding RNA, LncRNA)参与子宫颈癌的发生、发展[4]。LncRNA是通过调控其靶基因的表达,影响细胞的分化、增殖、侵袭、凋亡、衰老等生物学过程[5-6]。研究显示,LncRNA SLC16A1-AS1在肺癌、肝癌等肿瘤组织中表达降低,过表达SLC16A1-AS1可明显抑制肿瘤细胞的增殖和侵袭[7]。目前,SLC16A1-AS1在子宫颈癌组织中的表达及其对子宫颈癌细胞增殖和侵袭的影响尚不明确。本实验着重探讨SLC16A1-AS1在子宫颈癌组织和细胞株中的表达,分析其靶向miR-15a-5p与子宫颈癌细胞增殖和侵袭的关系,为临床子宫颈癌的靶向治疗提供参考。
1 材料与方法
1.1 组织样本收集2018年3月~2020年8月华中科技大学同济医学院附属武汉中心医院妇产科33例子宫颈癌根治术标本,患者年龄41~69岁,平均(49.31±7.87)岁。根据国际妇产科联盟(International Federation of Gynecologyand Obstetrics, FIGO)分期:I期12例,Ⅱ期10例,Ⅲ期11例;组织分化程度:低分化14例,中分化19例。患者术前均未接受放、化疗或生物治疗。新鲜组织标本储存于液氮罐中。另选同期因子宫肌瘤行全子宫切除标本,并经病理证实无子宫颈病变者作为对照。本实验经我院伦理委员会批准,患者或家属均签署知情同意书。
1.2 细胞及试剂人正常子宫颈上皮细胞H8和子宫颈癌细胞株HeLa、HCC94、SiHa、C33A,均购自中国科学院上海细胞库。阴性质粒(NC)、SLC16A1-AS1过表达质粒、miR-NC、miR-15a-5p模拟物、SLC16A1-AS1野生型质粒(SLC16A1-AS1-WT)、SLC16A1-AS1突变体质粒(SLC16A1-AS1-MUT),均购自广州锐博生物公司。DMEM培养基、RPMI-1640培养基、胎牛血清,均购自美国Gibco公司。qRT-PCR试剂盒购自日本Takara公司。MTT试剂盒购自北京博奥拓达科技公司。qRT-PCR引物由上海生物公司合成。Lipofectamine 3000、Matrigel基质胶,均购自美国Invitrogen公司。Transwell小室购自美国Corning公司。双荧光素酶报告基因检测试剂盒,购自上海碧云天生物公司。GAPDH、PCNA、N-cadherin、Slug、Ki-67蛋白抗体,均购自英国Abcam公司(蛋白编号分别为ab8245、ab29、ab76011、ab27568、ab16667)。
1.3 细胞培养与转染HeLa、HCC94、SiHa细胞用含10%胎牛血清的DMEM培养基,H8、C33A细胞用含10%胎牛血清的RPMI-1640培养基,置于37 ℃、5%CO2培养箱中培养。在24孔板中培养C33A细胞至对数生长期,采用Lipofectamine 3000试剂将NC、SLC16A1-AS1过表达质粒分别转染至C33A细胞,标记为NC组和SLC16A1-AS1组。转染8 h后,更换新鲜培养基。
1.4 qRT-PCR检测SLC16A1-AS1和miR-15a-5p表达在不同子宫颈组织或细胞中加入Trizol裂解液,提取总RNA后逆转录为cDNA。以GAPDH、U6为SLC16A1-AS1和miR-15a-5p的内参基因,配制20 μL的qRT-PCR反应体系,上、下游引物各1 μL(表1)。以2-ΔΔCt法分析计算SLC16A1-AS1和miR-15a-5p的相对表达量。

表1 qRT-PCR引物序列
1.5 MTT法检测C33A细胞的增殖胰酶消化NC组和SLC16A1-AS1组C33A,以每孔200 μL接种至96孔板,每孔2×103个细胞,每组3个复孔。在接种后第24、48、72、96、120 h分别加入MTT试剂20 μL,培养3 h。每孔加入150 μL二甲基亚砜,振荡器震荡15 min。采用酶标仪检测C33A细胞在490 nm波长处的吸光度(A)值。
1.6 Transwell实验检测C33A细胞的侵袭能力将Matrigel基质胶与无血清RPMI-1640培养基按1 ∶2混匀,置于Transwell小室上室。胰酶消化NC组和SLC16A1-AS1组C33A细胞,使用无血清RPMI-1640培养基重悬以每孔200 μL接种至Transwell小室上室;每孔2×104个细胞,每组3个复孔。下室加入含10%胎牛血清的RPMI-1640培养基,培养24 h。弃去培养基,用棉签擦去未穿过细胞,多聚甲醛固定,结晶紫染色。采用流水清洗并晾干,在100倍显微镜下进行观察,计数穿膜细胞数。
1.7 生物信息学技术预测及双荧光素酶报告基因实验验证SLC16A1-AS1的靶基因采用生物信息学网站starBase v2.0,预测SLC16A1-AS1可能的靶向miRNA。接种对数生长期的C33A细胞至24孔板,分别共转染SLC16A1-AS1-WT+miR-NC、SLC16A1-AS1-WT+miR-15a-5p、SLC16A1-AS1-MUT+miR-NC和SLC16A1-AS1-MUT+miR-15a-5p。转染48 h后,根据双荧光素酶报告基因实验试剂盒说明书,检测各组C33A细胞的相对荧光酶活性。
1.8 Western blot法检测蛋白表达采用细胞裂解液提取NC组和SLC16A1-AS1组C33A细胞总蛋白,每组按40 μg上样量进行聚丙烯酰氨凝胶(SDS-PAGE)电泳(110 V恒压),转膜至聚偏二氟乙烯膜(200 mA恒流),在5%脱脂牛奶中封闭3 h。一抗均按1 ∶2 000比例稀释,聚偏二氟乙烯膜在冰箱内一抗孵育过夜。二抗均按1 ∶5 000比例稀释,聚偏二氟乙烯膜在室温二抗孵育1.5 h。滴加电化学发光显影液进行显影,在凝胶成像仪中显影并采集图片,用GADPH作为内参。

2 结果
2.1 子宫颈癌和癌旁组织中SLC16A1-AS1的表达qRT-PCR结果显示,子宫颈癌组织和癌旁组织中SLC16A1-AS1的表达水平分别为1.63±0.31和7.35±0.48,差异有统计学意义(P<0.01,图1)。
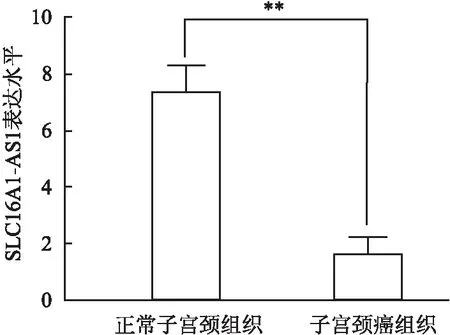
图1 子宫颈癌组织和癌旁组织中SLC16A1-AS1的表达水平:与癌旁组织相比,**P<0.01
2.2 子宫颈癌细胞株和正常子宫颈上皮细胞中SLC16A1-AS1表达水平qRT-PCR结果显示,与正常子宫颈上皮细胞H8相比,子宫颈癌细胞株HeLa、HCC94、SiHa、C33A中SLC16A1-AS1的表达水平下降,差异均有统计学意义(P<0.05,图2)。本组选择表达水平最低的C33A细胞进行后续实验。

图2 子宫颈癌细胞株和正常子宫颈上皮细胞中SLC16A1-AS1的表达水平:与H8细胞相比,*P<0.05,**P<0.01
2.3 SLC16A1-AS1质粒转染效率验证NC组和SLC16A1-AS1组的C33A细胞中,SLC16A1-AS1表达水平分别为1.06±0.19和9.92±1.04。与NC组相比,SLC16A1-AS1组的C33A细胞中SLC16A1-AS1的表达明显增加(P<0.01)。
2.4 过表达SLC16A1-AS1对C33A细胞增殖能力的影响MTT结果显示,与NC组相比,SLC16A1-AS1组中C33A细胞的吸光度(A)值24 h后下降,差异有统计学意义(P<0.05,图3)。本组结果提示过表达SLC16A1-AS1能抑制C33A细胞的增殖能力。
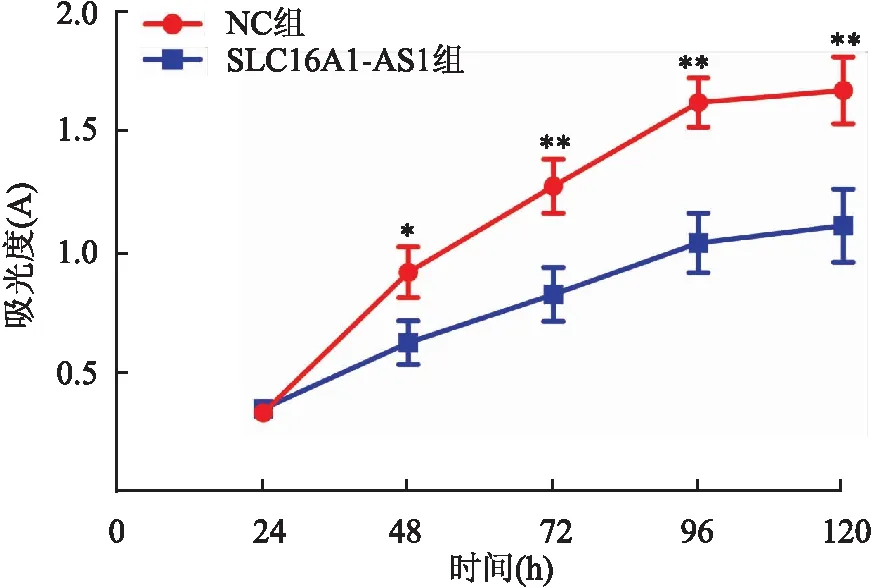
图3 过表达SLC16A1-AS1对C33A细胞增殖的影响:与NC组相比,*P<0.05,**P<0.01
2.5 过表达SLC16A1-AS1对C33A细胞侵袭能力的影响Transwell实验结果显示,NC组和SLC16A1-AS1组中C33A细胞的侵袭细胞数分别为(107.10±13.17)个和(41.76±11.12)个,差异有统计学意义(P<0.01,图4)。本组结果提示过表达SLC16A1-AS1可抑制C33A细胞的侵袭能力。

图4 过表达SLC16A1-AS1对C33A细胞侵袭的影响:A.Transwell侵袭图;B.细胞侵袭数统计柱状图,与NC组相比,**P<0.01
2.6 SLC16A1-AS1靶向结合miR-15a-5pstarBase v2.0预测网站显示:SLC16A1-AS1可能的靶基因是miR-15a-5p(图5)。双荧光素酶报告基因实验显示:与SLC16A1-AS1-WT+miR-NC组相比,miR-15a-5p可明显下调SLC16A1-AS1-WT质粒的相对荧光素酶活性(P<0.01)。对特异性结合区域点突变后,与SLC16A1-AS1-MUT+miR-NC组相比,miR-15a-5p不能抑制SLC16A1-AS1-MUT质粒的相对荧光素酶活性(P>0.05,图6),提示SLC16A1-AS1可与miR-15a-5p特异性结合。

图5 SLC16A1-AS1与miR-15a-5p结合预测图

图6 双荧光素酶报告基因实验验证SLC16A1-AS1靶向结合miR-15a-5p:与SLC16A1-AS1-WT+miR-NC组相比,**P<0.01
2.7 各组C33A细胞中miR-15a-5p的表达NC组和SLC16A1-AS1组中C33A细胞的miR-15a-5p表达水平分别为1.02±0.06和0.19±0.04。与NC组相比,SLC16A1-AS1组C33A细胞中miR-15a-5p的表达明显降低(P<0.01),提示SLC16A1-AS1可靶向抑制miR-15a-5p的表达。
2.8 过表达SLC16A1-AS1对增殖和侵袭相关蛋白的影响Western blot结果显示:与NC组相比,转染SLC16A1-AS1后,C33A细胞的增殖表型蛋白如PCNA、Ki-67表达降低,C33A细胞的侵袭表型蛋白如N-cadherin、Slug表达降低(图7)。

图7 Western blot法检测SLC16A1-AS1对增殖和侵袭相关表型蛋白表达的影响
3 讨论
LncRNA属于内源性非编码RNA,经RNA聚合酶Ⅱ转录合成[8-11]。LncRNA虽然不具有编码蛋白质的生物学功能,其可通过影响靶基因的表达,参与调控肿瘤细胞的多种生物学过程[12-17]。 研究证实,LncRNA如MIR22HG、LINC01305、EWSAT1被发现在子宫颈癌组织中表达明显异常,与子宫颈癌患者的放疗敏感性、预后等密切相关[18-21]。Liu等[7]报道SLC16A1-AS1在非小细胞肺癌组织和细胞株中明显下调,过表达SLC16A1-AS1可抑制肺癌细胞的活力并促进细胞凋亡;SLC16A1-AS1表达水平较高的患者总生存期和无进展生存期更长。Pei等[22]报道SLC16A1-AS1在肝癌组织和细胞中明显下调,SLC16A1-AS1过表达抑制肝癌细胞的增殖和侵袭,增强肝癌细胞的放疗敏感性。SLC16A1-AS1表现为明显的抑癌基因作用。本实验结果显示,子宫颈癌组织中SLC16A1-AS1的表达水平低于子宫颈正常组织,子宫颈癌细胞株中SLC16A1-AS1的表达水平低于正常子宫颈上皮细胞,提示其可能参与调控子宫颈癌的发生、发展。本实验进一步筛选SLC16A1-AS1表达最低的C33A细胞进行后续实验,过表达SLC16A1-AS1后,C33A细胞的增殖和侵袭能力均明显降低,提示SLC16A1-AS1在子宫颈癌中可能发挥抑癌基因作用。
LncRNA属于线性RNA,可通过海绵吸附作用结合miRNA,有效抑制miRNA的表达[23-27]。生物信息学技术预测显示,SLC16A1-AS1与miR-15a-5p有特异性结合位点,miR-15a-5p可能是SLC16A1-AS1的靶基因。双荧光素酶报告基因实验证实,miR-15a-5p是SLC16A1-AS1的靶基因。miR-15a-5p属于miR-15a家族的一员,在胃癌、卵巢癌、肾癌等组织中表达上调,可促进肿瘤细胞的恶性生物学行为,发挥癌基因的作用[28-29]。miR-15a-5p在子宫颈癌组织和细胞株中均呈高表达,抑制miR-15a-5p表达可显著降低子宫颈癌细胞的增殖和侵袭[30]。本实验通过qRT-PCR检测发现,SLC16A1-AS1可负向调控miR-15a-5p的表达。以上结果表明,SLC16A1-AS1通过下调miR-15a-5p的表达,抑制子宫颈癌C33A细胞的增殖和侵袭。Western blot结果显示,SLC16A1-AS1降低miR-15a-5p表达后,C33A细胞的增殖表型蛋白如PCNA、Ki-67表达降低,C33A细胞的侵袭表型蛋白如N-cadherin、Slug表达降低,间接表明子宫颈癌C33A细胞的增殖和侵袭能力下降。
综上所述,SLC16A1-AS1在子宫颈癌组织及细胞株中低表达,SLC16A1-AS1可通过靶向负调控miR-15a-5p表达,抑制子宫颈癌C33A细胞的增殖和侵袭能力。SLC16A1-AS有望成为子宫颈癌治疗的靶点。
