肝细胞癌中PNO1 mRNA的表达及临床意义
2021-06-17何春梅宁诗雨莫之婧
何春梅,宁诗雨,莫之婧
肝癌是全球癌症相关死亡的主要原因之一,全球肝癌的发病率和病死率呈逐年上升趋势[1]。肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌中最常见的肿瘤类型[2],RNA结合蛋白PNO1是已知的核糖体组装因子,在核糖体生物合成中至关重要。近年越来越多证据表明,PNO1通过调控p53、Notch和AKT/mTOR信号通路,促进多种肿瘤的进展[3-5]。文献报道[3-4,6-7]PNO1表达上调,与结直肠癌、肺腺癌和膀胱癌的发生、发展以及迁移、侵袭密切相关。目前,PNO1在HCC中的作用报道较少。本文着重探讨PNO1 mRNA在HCC中的表达及与临床病理特征的关系,以期对其致病机制、临床意义、预后等提供参考。
1 材料与方法
1.1 临床资料收集2010年12月~2012年12月桂林医学院附属医院行手术切除的66例HCC组织和21例配对的癌旁组织。66例HCC中,男性57例,女性9例。年龄>50岁者45例,年龄≤50岁者21例。肝硬化患者42例,无肝硬化患者24例。单个瘤体者46例,2个及以上瘤体者20例。多个瘤体者取直径总和,>5 cm者24例,≤5 cm者42例。低分化者20例,中+高分化者46例。肿瘤包膜完整者47例,包膜缺失者19例。采用美国癌症联合会(AJCC)第八版进行TNM分期,其中Ⅰ+Ⅱ期56例,Ⅲ+Ⅳ期10例。随访时间截至2016年4月。
1.2 主要试剂及仪器CFX96 Real-Time System QPCR仪(美国Bio-RAD);PCR仪(美国Bio-RAD);OMEGA RNA提取试剂盒;TAKARA逆转录试剂盒;TAKARA实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)试剂盒。PNO1引物由华大基因合成,上游引物:5′-GCGCCAATGGCGAGATCTG-3′,下游引物:5′-GGTGGATCAGCAGGCACTTG-3′;β-actin为内参,上游引物:5′-GAAGAGCTACGAGCTGCCT GA-3′,下游引物:5′-CAGACAGCACTGTGTTGGCG-3′;内参GAPDH引物购自华大基因。
1.3 RNA提取和qRT-PCR检测细胞系总RNA提取使用OMEGA RNA提取试剂盒,按照RT-PCR试剂盒说明书逆转录为cDNA。PNO1基因qRT-PCR上游引物:5′-GCGCCAATGGCGAGATCTG-3′,下游引物:5′-GGTGGATCAGCAGGCACTTG-3′;β-actin为内参,上游引物:5′-GAAGAGCTACGAGCTGC CTGA-3′,下游引物:5′-CAGACAGCACTGTGTT GGCG-3′。反应条件如下:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,合计40个循环,扩增后进行溶解曲线分析,每个样品均设3个复孔。反应体系为20 μL,其中2 μL cDNA,0.8 μL引物,10 μL SYBR Premix和0.4 μL ROX,加超纯水至20 μL。采用2-△△Ct法进行数据分析。
1.4 数据来源从Oncomine数据库中选择数据集Roessler Liver 2中445例标本、Roessler Liver中43例标本和Chen Liver中183例标本、Wurmbach Liver中180例标本和相关临床病理资料。从UCSC Xena获得HCC患者经log2(x+1)转换的TCGA RNA-seq数据中373例标本。
1.5 基因集富集分析(gene set enrichment analysis, GSEA)实验基于MSigDB的HCC预后相关基因集对PNO1进行GSEA,以识别PNO1相关的信号通路,使用GSEA v4.0.3软件进行。TCGA中373例HCC样本根据PNO1 mRNA表达水平分为低表达组和高表达组,MSigDB的HCC预后相关基因集作为参考基因集,其他参数均基于默认值设置。
1.6 统计学分析采用IBM SPSS Statistics Version 20.0和GraphPad Prism 6.0软件进行统计学分析。通过t检验比较HCC和癌旁正常组织中PNO1 mRNA的表达。应用Kaplan-Meier法进行生存分析,并通过对数秩检验评估生存曲线的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 HCC及癌旁正常组织中PNO1 mRNA的表达分析Oncomine数据库中3个数据集中PNO1 mRNA的表达。Roessler Liver 2数据集中,与220例癌旁正常组织相比,PNO1 mRNA在225例HCC组织中表达显著升高(P<0.001,图1A)。Roessler Liver数据集中,与21例癌旁正常组织相比,PNO1 mRNA在22例HCC组织中表达显著升高(P<0.001,图1B)。Chen Liver数据集中,与76例癌旁正常组织相比,PNO1 mRNA在104例HCC组织中表达显著升高(P=0.009,图1C)。

图1 Oncomine数据库中正常肝组织和HCC组织中PNO1 mRNA的表达:A.PNO1 mRNA在Rossler Liver 2数据集中的表达;B.PNO1 mRNA在Rossler Liver数据集中的表达;C.PNO1 mRNA在Chen Liver数据集中的表达;·代表极端值
qRT-PCR检测本组21例HCC及癌旁正常组织中PNO1 mRNA的表达。HCC中PNO1 mRNA的相对表达量显著高于癌旁正常组织(P=0.020 2,图2)。
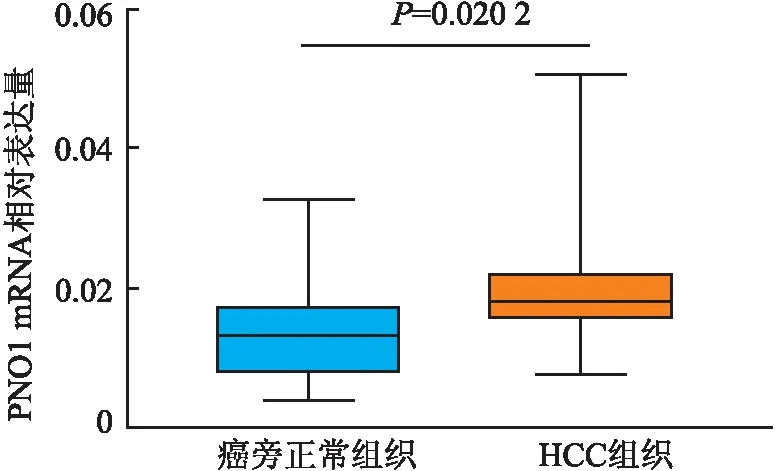
图2 qRT-PCR检测HCC组织及配对的癌旁正常组织中PNO1 mRNA的表达
2.2 HCC中PNO1 mRNA表达与临床病理特征的关系Chen Liver数据集显示:与39例无肝炎病毒感染的HCC患者相比,PNO1 mRNA在144例肝炎病毒感染HCC样本中的表达显著升高(P=0.002);Wurmbach Liver数据集显示:PNO1 mRNA在卫星结节(主瘤周边肝组织内出现肉眼可见或显微镜下小癌灶,主要源于微血管侵犯的肝内转移)或伴血管浸润HCC中的表达高于无卫星结节或血管浸润者(P=0.003)。PNO1 mRNA表达与肝炎病毒感染、卫星结节和血管浸润有关(表1)。

表1 Oncomine数据库中PNO1 mRNA表达与肝炎病毒感染、卫星结节、血管侵袭的关系
qRT-PCR检测本组66例HCC组织中PNO1 mRNA表达,并分析其表达与HCC临床病理特征的关系。HCC组织中PNO1 mRNA表达与肿瘤直径(P=0.041)和TNM分期(P=0.039)有关;与患者性别、年龄、肝硬化、瘤体个数、分化程度及肿瘤包膜无关(P>0.05,表2)。

表2 HCC中PNO1 mRNA表达与临床病理特征的关系
2.3 HCC中PNO1 mRNA表达与预后的关系TCGA数据库显示:373例HCC患者中有11例失访,其中181例PNO1 mRNA高表达HCC患者比181例PNO1 mRNA低表达的患者总生存率低(P=0.024),PNO1 mRNA高表达是HCC患者的风险因子(HR=1.5,图3)。

图3 TCGA中PNO1 mRNA表达与HCC患者总生存率的关系
本组66例HCC患者中PNO1 mRNA表达与患者总生存率的相关性。33例PNO1 mRNA高表达HCC患者比33例低表达患者总生存率低(P=0.033 6,图4)

图4 66例HCC患者中PNO1 mRNA表达与总生存率的关系
2.4 HCC中PNO1基因相关的信号通路从MSigDB中挑选11个与HCC预后相关的基因集,应用GSEA分析PNO1 mRNA表达水平和HCC预后相关基因集的相关性。LEE_LIVER_CANCER_SURVIVAL_DN和LIAO_METASTASIS 2个基因集在PNO1 mRNA高表达表型中富集,LEE_LIVER_CANCER_SURVIVAL_DN基因集包含的是在预后差的HCC患者中高表达的基因;LIAO_METASTASIS基因集包含的是在肝内转移性HCC患者中表达上调的基因。表明PNO1 mRNA高表达与HCC患者生存率低及转移率高相关(图5)。
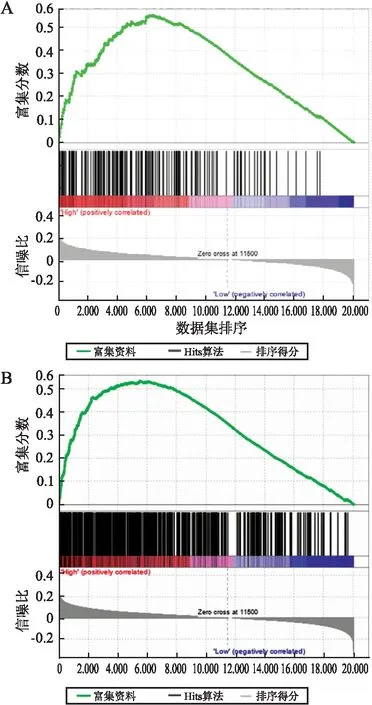
图5 GSEA信号通路富集分析:A.PNO1 mRNA表达在HCC预后相关基因集中的GSEA富集分析;B.PNO1 mRNA表达在HCC肝内转移相关基因集中的GSEA富集分析
3 讨论
HCC起病隐匿,手术及放、化疗效果有限,预后差[8],其发生、发展受多种因素的影响。PNO1是内切酶NOB1的相互作用伙伴,介导20S rRNA裂解为成熟的18S rRNA[9],在核糖体的生物发生过程中起重要作用。研究表明,RIO1-NOB1-PNO1网络建立了一个检查点,防止不成熟核糖体释放到翻译池中造成保真度缺陷和扰乱蛋白稳态[10]。细胞中蛋白质的合成场所是核糖体,肿瘤细胞需要有大量的核糖体,才能保持旺盛增殖代谢能力来维持肿瘤细胞的生理活动[11]。文献报道[12]核糖体的过度激活是多种恶性肿瘤的驱动因素,一些致癌转录因子已被证明可以协调整个核糖体生物发生,促进肿瘤进展的异常翻译过程,如C-MYC癌基因通过激活核糖体装配因子和rRNA的合成加剧核糖体的生物发生,促进多种肿瘤的进展[13-14]。最近研究表明,抑制核糖体生物发生的药物可能为肿瘤治疗提供可行的治疗方法[15]。
本实验分析Oncomine数据库中3个数据集中PNO1 mRNA的表达,结果显示PNO1 mRNA在HCC中的表达高于癌旁正常组织。qRT-PCR检测结果显示HCC组织中PNO1 mRNA的相对表达量高于癌旁正常组织,与Oncomine数据库中的分析结果相符。PNO1是核糖体新生调控因子,其高表达可能加剧核糖体的合成,促进肿瘤的发生和发展。Shen等[3]报道PNO1在结直肠癌组织中表达上调,其高表达与结直肠患者预后差密切相关;PNO1的下调是通过上调p53及其下游p21的表达,抑制细胞增殖和凋亡,从而抑制结直肠癌的发生、发展。Dai等[5]通过体内外实验发现,PNO1可以调节肿瘤生长的AKT/mTOR信号通路,抑制肿瘤的增殖和转移。Liu等[4]在体内、体外实验表明,PNO1表达在肺腺癌组织样本中上调,其通过Notch信号通路促进肺腺癌细胞的增殖和转移。
目前,PNO1在HCC中的相关报道较少。Dai等[5]首次报道PNO1在HCC中的致癌作用,但其在HCC中的表达及与临床病理特征的关系尚未见报道。本组采用qRT-PCR实验检测66例HCC组织中PNO1 mRNA表达,相关临床资料分析表明HCC组织中PNO1 mRNA高表达患者的肿瘤直径更大、TNM分期更高。有研究表明,伴微血管侵袭的HCC患者肿瘤体积较大[16]。Oncomine数据库分析表明PNO1 mRNA在HCC中表达上调,伴肝炎病毒感染、卫星结节及血管侵袭者PNO1 mRNA表达升高,提示PNO1在HCC的进程中发挥重要作用,PNO1可能是评估HCC复发风险和选择治疗方案的重要生物标志物。TCGA数据库显示:PNO1 mRNA高表达HCC患者的总生存率降低。本组66例HCC患者的预后与TCGA数据库分析相符,提示PNO1可能是引发HCC预后不良的潜在基因。本组通过GSEA对PNO1进行通路富集分析,结果显示PNO1 mRNA高表达与HCC患者生存率低及转移率高相关。Dai等[5]通过体内、外实验发现,PNO1对肿瘤的生存和转移有促进作用,与本实验结果一致。
综上所述,PNO1 mRNA表达与HCC发生转移、预后不良有关,其是评估HCC复发风险和选择治疗方案的重要生物学标志物。本组将在后续实验对PNO1的生物学功能及其作用机制进一步深入分析,其有望成为HCC治疗的新靶标。
