红曲黄色素和红曲橙色素的稳定性研究
2021-06-16王艳阳潘伟仪
陈 莎,刘 涛,王 帅,王艳阳,徐 帅,潘伟仪,李 利
(长江大学生命科学学院,湖北荆州 434025)
红曲色素(Monascuspigments,MPs)是丝状真菌红曲菌(Monascusspp.)产生的次生代谢产物,在我国用于食品着色已经有两千多年的历史[1]。根据我国食品安全国家标准《食品添加剂使用标准》(GB 2760-2014),红曲色素可用于腌腊肉制品、熟肉制品、调制乳、果酱、糖果、糕点等28个类别的食品中,且大部分没有限定最大使用量。随着一些合成食用色素毒性的不断被发现,健康、安全的天然食用色素越来越受到青睐[2]。红曲色素作为一种天然微生物色素,不仅具有安全性好、产量高、生产成本低、色调丰富(从黄到红)、溶解性好等优点,还被证实具有抗炎、抗氧化、免疫调节、抗肿瘤、降血糖和降血脂等多种生物活性[3-6],因此需求量逐年增大,目前我国红曲色素年产量超过2万吨[7]。
红曲色素有6种主要色素组分,分别为2种黄色素:红曲素(monascin)和安卡红曲黄素(ankaflavin);2种橙色素:红斑红曲素(rubropunctatin)和红曲玉红素(monascorubrin);2种红色素:红斑红曲胺(rubropunctamine)和红斑玉红胺(monascorubramine)[7]。每类色素的2种组分有着相似的结构,差异在于烷基支链的长度(图1),其中红曲素、红斑红曲素和红斑红曲胺的烷基支链为C5H11,而安卡红曲黄素、红曲玉红素和红斑玉红胺为C7H15。目前,还没有一种发酵技术可以生产单一的红曲色素组分,不同红曲色素组分通常以混合物形式存在于发酵产物中[8]。由于分离制备难度大、成本高,红曲色素也通常以混合物形式应用于食品工业,虽然其色调根据不同颜色色素组分的含量而有所差异,但一般均以红色组分为主[9]。
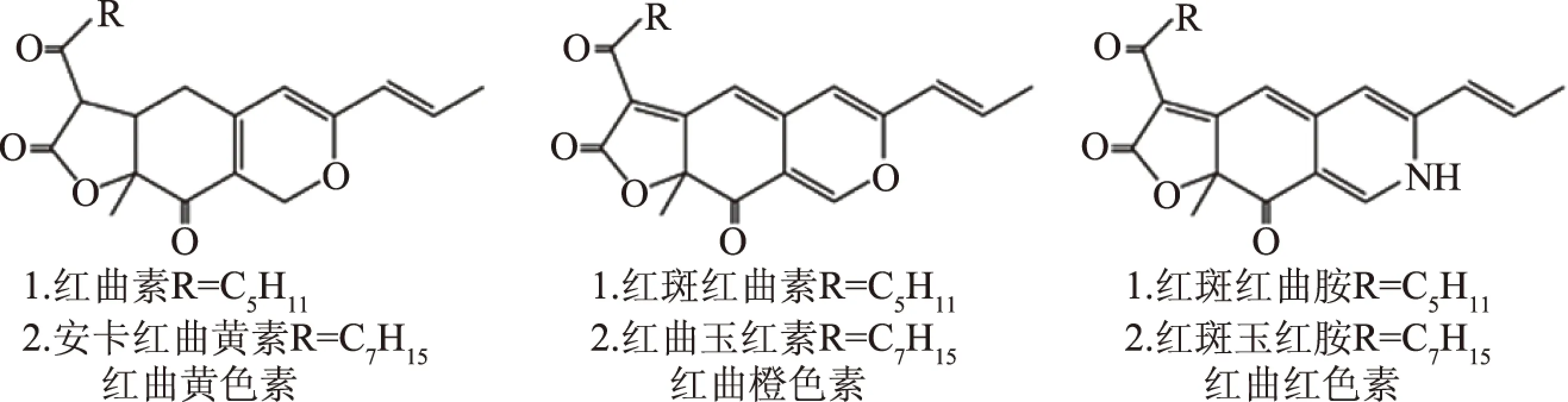
图1 六种主要红曲色素组分的化学结构Fig.1 Chemical structures of six major Monascus pigment components
天然色素一般为高度不饱和的化合物,易受光、热、氧、酸碱等因素的影响而发生颜色变化[10]。红曲色素是一类由红、黄、橙三种颜色色素组成的混合物,其中任何一种色素的变化都会对产品产生影响,因此了解不同色素组分的稳定性差异,对红曲色素产品的应用具有重要的指导意义。然而,红曲色素的稳定性研究目前主要集中于色素混合物以及红色素组分[11-16],黄色素和橙色素组分的相关报道还较少[17-18]。本研究通过大孔树脂柱层析分离得到红曲黄色素和橙色素组分,从pH、光照和温度三个方面评估了其稳定性,以期为高稳定性红曲色素产品的开发提供参考。
1 材料与方法
1.1 材料与仪器
红色红曲菌M7(MonascusruberM7,CCAM 070120) 中国典型培养物保藏中心,用于红曲色素的发酵与制备;大孔树脂CAD-40 郑州和成新材料科技有限公司;姜黄色素 食品级,郑州嘉源食品配料有限公司;盐酸、氢氧化钠、葡萄糖、氯化钠、柠檬酸、磷酸氢二钠、乙醇、甲酸、无水乙醇 分析纯,国药集团化学试剂有限公司;乙腈 色谱纯,美国天地有限公司。
UV-1900紫外-可见分光光度计 北京普析;Beckman Allegra X-30R离心机 德国贝克曼;LC1200高效液相色谱仪 美国安捷伦;UltiMate 3000-TSQ Altis液相色谱-质谱联用仪 美国热电;KQ-600DE超声波提取器 昆山舒美;BS-100A组分收集器 上海青浦;PB-10pH计 德国赛多利斯;IS-RDS3恒温摇床 美国精骐;HH-4水浴锅 浙江金坛杰瑞尔。
1.2 实验方法
1.2.1 红曲色素的发酵与制备 以1%的接种量将红曲菌孢子液(105个/mL)接种于马铃薯葡萄糖液体培养基(PDB)中,28 ℃,200 r/min恒温振荡条件培养40 h;然后向发酵液中加入等体积的无菌的0.2 mol/L pH6柠檬酸-磷酸氢二钠缓冲液,28 ℃,200 r/min继续培养5 d。发酵完毕后,发酵液经300目滤布抽真空过滤,收集菌丝体。用2倍发酵液体积的酸水(pH2,甲酸调节)冲洗菌丝,用吸水纸压干水分,加入与发酵液体积相等的70%的乙醇溶液(用无水乙醇和pH=2的甲酸水溶液配制),于30 ℃条件下超声波(100 W)辅助提取2 h,8000 r/min离心10 min,上清液即为红曲色素粗提液。
1.2.2 大孔树脂CAD-40的预处理 参照Zhang等[19]的方法,具体如下:95%(v/v)乙醇浸泡24 h,使大孔树脂充分溶胀,用去离子水冲洗到不出现白色浑浊液和没有乙醇味为止,再加入5% HCl(v/v)溶液浸泡4 h,用去离子水冲洗至中性,然后用5% NaOH(m/v)溶液浸泡4 h,用去离子水冲洗至中性,得到预处理好的大孔树脂。
1.2.3 色素的分离纯化 采用湿法装柱,将预处理后的大孔树脂CAD-40装填于玻璃层析柱中(25 cm×1 cm ID),柱床高度23 cm,柱床体积18 mL。50 mL色素粗提液(5.0±0.2 U/mL,以470 nm计)上样,上样速率3.0 BV/h。吸附平衡后,用4 BV无水乙醇以1 BV/h速率洗脱,收集第0.94~1.22 BV洗脱液为F1(主要含红曲黄色素),收集第2.22~4 BV洗脱液为F2(主要含红曲橙色素)。
1.2.4 红曲色素的分析 红曲色素的紫外-可见光谱分析、HPLC分析和LC-MS分析参考Li等[20]的方法。具体如下:
1.2.4.1 紫外-可见光谱分析 在300~600 nm范围内进行扫描,红曲黄色素和橙色素的色价分别以400和470 nm的吸光值计算。色价(U/mL)=吸光值A×稀释倍数;色素残留率(%)=处理后的色价/处理前的色价×100。
1.2.4.2 HPLC分析 色谱柱:Inertsil ODS-3(250 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:A相为乙腈,B相为酸水(pH=3,甲酸调),C相为纯水,梯度洗脱条件见表1;流速:0.8 mL/min;进样量:20 μL;检测器:二极管阵列检测器(DAD);检测波长:210~600 nm,其中红曲黄色素、橙色素和红色素组分的监测波长分别为380、470和520 nm。红曲黄色素组分的含量以380 nm下的峰面积计算,橙色素组分的含量以470 nm下的峰面积计算。

表1 HPLC的梯度洗脱条件Table 1 Gradient elution conditions of HPLC
1.2.4.3 LC/MS分析 色谱柱:Thermo Hypersil GOLD C18(100 mm×2.1 mm,3 μm);柱温:40 ℃;流动相:A相为乙腈,B相为酸水(pH=3,甲酸调);梯度洗脱条件:0~3 min,35% A;3~18 min,35% A~70% A;18~23 min,70% A~90% A;23~24 min,90% A~35% A;24~27 min,35% A;流速:0.3 mL/min;进样量:10 μL;DAD检测波长:210~600 nm;离子源:电喷雾电离(ESI),正离子模式;扫描范围:m/z 200~600;电喷雾电压:3500 V;离子传输管温度:350 ℃;脱溶剂温度:400 ℃;鞘气压力30 arb;辅助气压力5 arb。根据质谱检测到的准分子离子[M+H]+峰确定各红曲色素组分的分子量,并与目前报道的100多种红曲色素[7]的分子量进行比对,以进行定性分析。
1.2.5 pH稳定性试验 配制0.1 mol/L柠檬酸-磷酸氢二钠缓冲液(pH2、pH3、pH4、pH5、pH6、pH7),0.1 mol/L磷酸二氢钠-磷酸氢二钠缓冲液(pH8)和0.1 mol/L碳酸钠-碳酸氢钠缓冲液(pH9)。色素溶液(2.0±0.2 U/mL)分别与8个不同pH的缓冲液以3∶7的比例混合,25 ℃放置24 h后进行色素分析。所有实验组设置三个平行。
1.2.6 光稳定性试验 将2.0±0.2 U/mL的色素溶液置于石英比色皿(光程为1 cm),密封,放入安装有紫外灯(254 nm,8 W)的暗盒子,使紫外光垂直透过石英比色皿的透光面,照射距离为8 cm,照射时间270 min,照射期间取样进行色素分析。对照采用(2.0±0.2) U/mL的姜黄色素溶液(色价以最大吸收波长424 nm计算)。所有实验组设置三个平行。
1.2.7 热稳定性试验 将(1.0±0.1) U/mL的色素溶液置于带聚四氟乙烯衬垫螺旋盖的厚壁耐压管,分别放置在60和80 ℃下避光处理120 min,处理期间取样进行色素分析。对照采用(1.0±0.1) U/mL的姜黄色素溶液(色价以最大吸收波长424 nm计算)。所有实验组设置三个平行。
1.3 数据处理
采用Excel 2007和Origin 7.5进行数据处理及作图。
2 结果与分析
2.1 红曲黄色素和红曲橙色素的分离制备
红曲色素粗提物经CAD-40大孔树脂柱层析分离后,共收集到2个洗脱组分F1和F2。由图2可知,F1在400 nm附近有最大吸收峰,表明主要为黄色素组分;F2在470 nm附近有最大吸收峰,表明主要为橙色素组分(图2a和2b)。经HPLC和LC-MS分析发现,F1主要含2个黄色素物质Y1和Y2(图2c),二者百分含量之和达79.8%±3.3%(以HPLC峰面积计),准分子离子[M+H]+峰分别为m/z 359.14 和m/z 387.20,分别与2种主要红曲黄色素组分红曲素(C21H26O5)和安卡红曲黄素(C23H30O5)的分子量一致。F2主要含2个橙色素物质O1和O2(图2d),二者百分含量之和达91.3%±1.3%(以HPLC峰面积计),准分子离子[M+H]+峰分别为m/z 355.15和m/z 383.12,与2种主要红曲橙色素组分红斑红曲素(C21H22O5)和红曲玉红素(C23H26O5)的分子量一致。后续实验中,均以该红曲黄色素F1和红曲橙色素F2为材料进行稳定性研究。

图2 洗脱组分F1和F2的紫外-可见吸收光谱图及HPLC色谱图Fig.2 UV-Vis spectra and HPLC chromatograms of fractions F1 and F2注:HPLC分析时,分别于380、470和520 nm下监测红曲黄色素、橙色素和红色素。图4同。
2.2 pH稳定性分析
由图3a、3b可知,在pH2~4范围内,红曲黄色素F1和红曲橙色素F2的颜色和紫外-可见吸收光谱均无明显变化;在pH5~9范围内,红曲黄色素F1和红曲橙色素F2的颜色较pH2~4时明显偏红,紫外-可见吸收光谱也均在520 nm附近出现吸收峰,不同的是,红曲黄色素F1在400 nm处的特征吸收峰保持不变,且对应的吸收强度未有明显变化,而红曲橙色素F2在470 nm处的特征吸收峰消失,但在410和520 nm附近分别出现一个新的吸收峰。
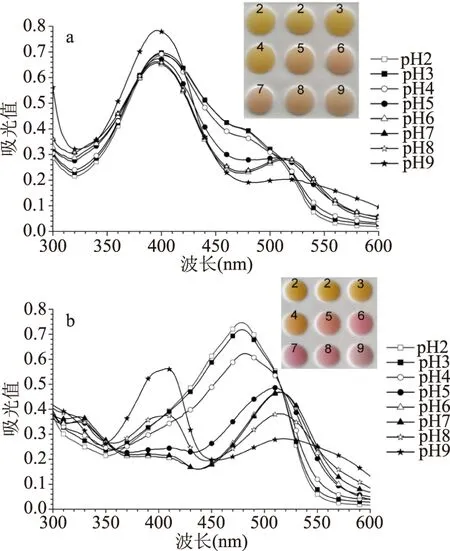
图3 不同pH下红曲黄色素F1和红曲橙色素F2的稳定性Fig.3 Stability of the yellow fraction F1 and orange fraction F2 at different pH
关于红曲橙色素的pH敏感性,石侃[21]也报道了相似的实验现象,并推测pH升高促使了橙色素的内酯键断裂以及生色团上共轭双键发生了重排,使其光谱出现了明显的红移。另外,研究发现,高pH环境(特别是pH≥6)有助于促使红曲橙色素发生亲氨反应生成红曲红色素[22-23],而食品基质中通常含有丰富的氨基酸等含-NH2的化合物,若不能维持较低的pH,作为着色剂添加的红曲橙色素也会发生明显的颜色变化。
据Shi等[22]的研究结果,2种主要红曲黄色素组分红曲素和安卡红曲黄素对pH不敏感,在pH2.5~8范围内不会发生颜色变化。然而,在本研究中,红曲黄色素F1在pH5~9范围内,颜色及光谱发生了改变(图3a)。由于红曲黄色素F1中含有少量红曲橙色素组分(图2c,HPLC峰面积百分含量约为20%),由此推测红曲黄色素F1颜色及光谱的变化是由于所含的少量不稳定的红曲橙色素所导致的。HPLC分析结果证实了这一推测。如图2c、2d和图4所示,在pH7的条件下,红曲黄色素F1和红曲橙色素F2所含的黄色素组分红曲素(Y1,RT=17.38 min)和安卡红曲黄素(Y2,RT=22.89 min)均可检出,但二者所含的橙色素组分红斑红曲素(O1,RT=18.20 min)和红曲玉红素(O2,RT=24.10 min)均未检出,且均在2.84 min出现一个新的流出峰。该新流出峰可能为红曲橙色素降解所产生的小分子物质。

图4 pH7条件下红曲黄色素F1 和红曲橙色素F2的HPLC分析Fig.4 HPLC analysis of the yellow fraction F1 and orange fraction F2 at pH7注:虚线所对应的位置标示橙色素 O1或O2所对应的保留时间。
2.3 光稳定性分析
在紫外光(254 nm)的照射下,分析了红曲黄色素F1和红曲橙色素F2的光稳定性,结果见图5。随着紫外光照射的时间延长,红曲黄色素F1和红曲橙色素F2颜色不断变浅,照射270 min时,其色素残留率分别为70.4%±0.2%和64.4%±0.9%,明显高于姜黄色素的色素残留量7.9%±0.7%(图5a)。由此可见,红曲黄色素和红曲橙色素的光稳定性均明显优于姜黄色素,其光稳定性顺序为红曲黄色素>红曲橙色素>姜黄色素。刘轶[24]通过密度泛函理论(DFT)和含时密度泛函理论(TDDFT)分析计算发现,红曲黄色素的光稳定性最强,其次为红曲橙色素,红曲红色素的光稳定性最弱,本实验结果与该理论计算十分吻合。
通过对比紫外光照射前后的光谱图(图5b和5c),发现紫外光不影响红曲黄色素和红曲橙色素的吸收光谱形状和最大吸收波长,表明紫外光破坏红曲黄色素和红曲橙色素结构后,生成的新物质在300~600 nm范围内没有强吸收,除了引起褪色,不会引起色调的变化。本实验现象与徐海笑[25]的结论一致。徐海笑[25]通过分析黄色素组分红曲素的光处理产物的液相图谱,发现除未反应的红曲素之外,所有光降解产物的色谱峰对应的最大吸收波长均不超过275 nm。

图5 红曲黄色素F1和红曲橙色素F2的紫外光稳定性Fig.5 UV-light stability of the yellow fraction F1 and orange fraction F2
2.4 热稳定性分析
在60和80 ℃条件下分析了红曲黄色素F1和红曲橙色素F2的热稳定性,结果见图6。由图6a可知,红曲黄色素F1表现出良好的热稳定性,处理120 min后,其在60和80 ℃下的色素残留率性分别为94.3%±2.6%和87.4%±3.2%,与对照组的姜黄色素的色素残留率无明显差异(92.9%±0.6%和90.9%±4.5%)。相比之下,红曲橙色素F2的热稳定性较差,随着加热时间的延长,色素残留率急剧下降,60和80 ℃下处理120 min后,色素残留率性分别为58.3%±7.1%和40.8%±1.9%。甘纯玑[26]的研究也发现了红曲黄色素具有良好的热稳定性,80 ℃加热30 h后色素保存率达到90%以上。
紫外-可见光谱分析发现,加热处理前后,红曲黄色素F1的吸收光谱形状和最大吸收波长没有发生明显变化(图6b),而红曲橙色素F2的吸收光谱由1个吸收峰(470 nm)变成2个吸收峰(410和470 nm)(图6c),推测加热处理后红曲橙色素结构受到破坏,生色团共轭体系缩小,最大吸收峰蓝移,颜色由橙色逐渐转为橙黄色。
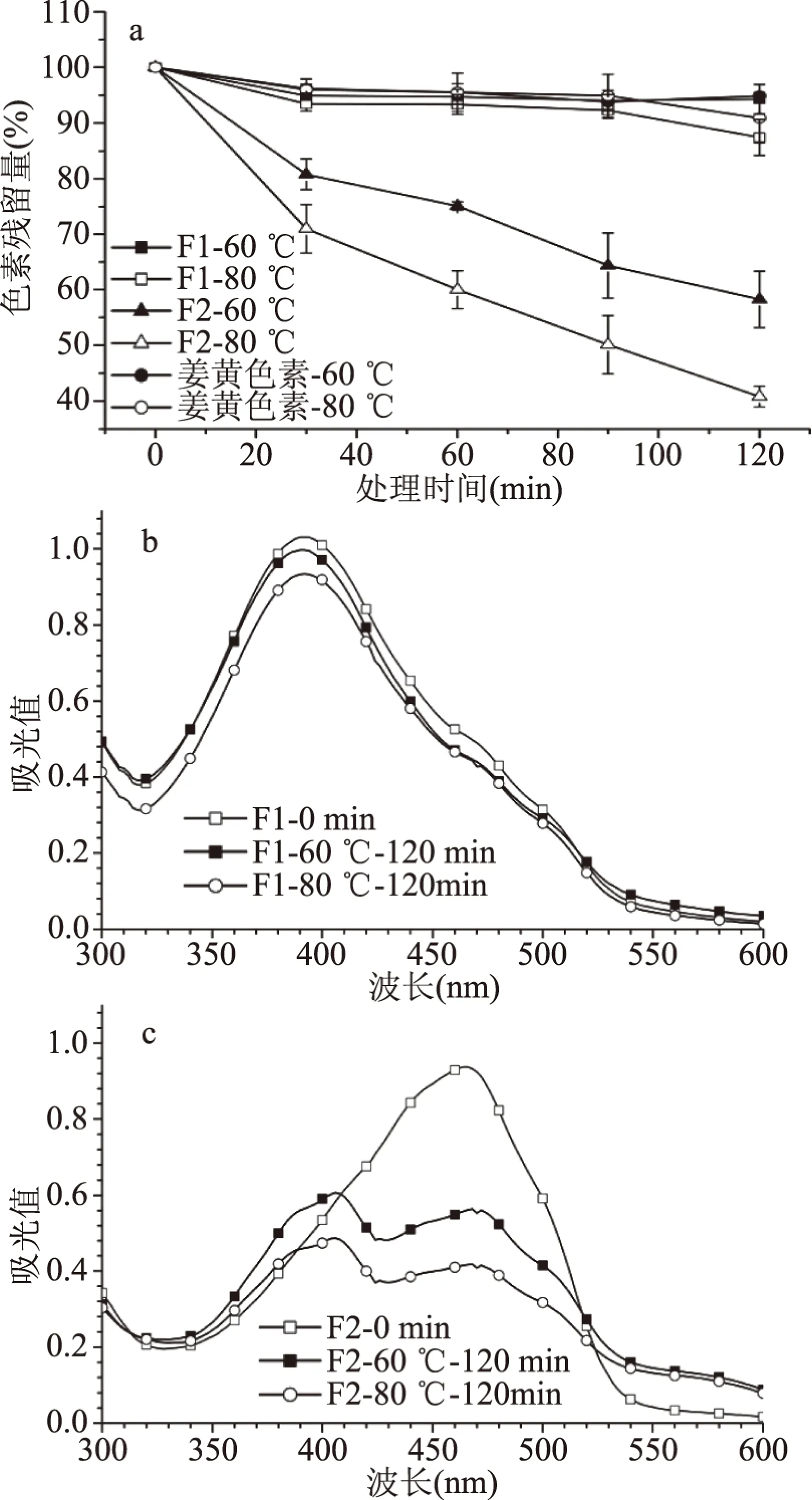
图6 红曲黄色素F1和红曲橙色素F2的热稳定性Fig.6 Thermal stability of the yellow fraction F1 and orange fraction F2
3 结论
红曲黄色素是一种稳定性好的红曲色素组分,在pH2~9范围内无明显颜色变化;紫外光照射270 min后,色素残留率(70.4%±0.2%)明显高于对照组姜黄色素(7.9%±0.7%);80 ℃处理120 min后,色素残留率(87.4%±3.2%)与对照组姜黄色素无明显差异(90.9%±4.5%)。相比之下,红曲橙色素的pH及温度稳定性较差,其稳定的pH范围为2~4,80 ℃处理120 min后,色素残留率为40.8%±1.9%,约为红曲黄色素残留率的一半。但红曲橙色素在光稳定性方面与红曲黄色无明显差异,但明显优于对照组姜黄色素。该研究不仅可以为不同红曲色素的应用范围及条件提供参考,还可为高稳定性红曲色素产品的开发提供理论依据。由于本研究是在特定的溶剂体系中进行的,环境条件与复杂的食品基质有很大差异,因此,红曲黄色素和橙色素在不同种类食品中稳定性及其它食品添加剂对红曲黄色素和橙色素的影响还有待进一步研究。
