血糖波动对2型糖尿病大鼠认知功能的影响
2021-06-16戴悦萱秦明阳梁芙茹
李 志 张 郡 戴悦萱 秦明阳 梁芙茹
(1. 内蒙古医科大学包头临床医学院,呼和浩特 010000; 2. 包头市中心医院神经内科,内蒙古包头 014040; 3.鞍山市长大医院神经内科,辽宁鞍山 114000;4.中国医学科学院北京协和医院神经内科,北京 100730; 5. 内蒙古呼伦贝尔第二人民医院内二科, 内蒙古扎兰屯 162650)
随着糖尿病患病率的逐年递增,糖尿病所导致的认知功能障碍日益受到广泛重视。流行病学研究[1]已证实,2型糖尿病(type 2 diabetes mellitus, T2DM)与阿尔茨海默病(Alzheimer’s disease, AD)之间存在病理生理联系。国际糖尿病联盟2007年发布的《餐后血糖管理指南》[2]中曾明确指出波动性高血糖产生的危害远高于慢性持续性高血糖,且血糖波动幅度越大,慢性并发症的发病率越高,预后也越差。临床研究[3]显示,T2DM患者的认知功能与急性血糖波动有明显的相关性。糖尿病患者日常生活中不可避免地存在异常的血糖波动,研究波动性高血糖影响认知功能的可能机制,探索新的治疗靶点,对预防和治疗糖尿病认知功能障碍具有重大的意义。
氧化应激损伤是机体或细胞内以氧自由基为代表的氧化性物质产生与消除的一种失平衡状态。临床试验[4]显示:与持续高血糖相比,糖尿病患者血糖波动更显著增加氧化应激产物的生成,提示异常的血糖波动与氧化应激密切相关。关于血糖波动与氧化应激损伤的研究不多,主要集中于体外细胞培养:与持续高血糖环境相比,人脐静脉内皮细胞培养在血糖波动环境中时,线粒体产生更多的活性氧簇[5],细胞外环境中的葡萄糖浓度上下波动比持续高糖浓度对细胞的危害更大,导致氧化应激产物过度生成,继而引发细胞凋亡增加[6]。但糖尿病患者血糖波动所致的认知功能下降是否与体内氧化应激损伤相关,其具体机制尚未在动物模型体内实验中验证。由此本课题组建立了糖尿病血糖波动模型,观察认知功能改变情况,并检测其海马氧化应激指标——丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活性,研究血糖波动是否导致认知下降,是否与氧化应激相关联,为糖尿病合并认知功能障碍的防治提供一定的实验依据。
1 材料与方法
1.1 实验动物
36只Wistar大鼠:健康、雄性,体质量90~130 g,4~6周,由内蒙古大学动物中心提供[实验动物使用许可证号:SCXK(蒙)2016-0001]。
1.2 2型糖尿病大鼠模型的制备
在温度为22 ℃±2 ℃,相对湿度为50%~60%的环境中适应性喂养1周。将36只大鼠采用简单随机化分组法分为对照组(C组,n=10)及2型糖尿病组(T2DM组,n=26)。C组以维持饲料喂养,T2DM组以高糖高脂饲料喂养(猪油12%,糖10%,奶粉6%,鸡蛋5%,油炸花生5%,盐1%和麻油1%)。T2DM组高糖高脂饲料喂养6周后,过夜禁食不禁水15 h,用现配的柠檬酸缓冲液溶解链脲菌素(streptozotocin,STZ)粉末,配成质量分数为1%(质量分数)的STZ溶液,按30 mg/kg的剂量通过腹腔注射诱导2型糖尿病。1周后,禁食不禁水16 h,随机测定两次非同日空腹血糖,血糖浓度≥16.7 mmol/L的24只大鼠视为糖尿病模型成功[7],成功率为92.3%。
1.3 建立反复餐后血糖波动的糖尿病大鼠模型
选取造模成功的糖尿病大鼠24只,采用简单随机化分组法分为持续高糖组(sustained hyperglycemia group,SHG,n=12)和血糖波动组(intermittent hyperglycemia group,IG,n=12)。将所有大鼠均建立12 h的反向光/暗周期(暗:7:00~19:00;光:19:00~7:00),并对C组继续以维持饲料不计时不计量喂养,SHG组继续以高糖高脂饲料不计时不计量喂养,对IG组大鼠的进食时间进行限制,每个时间段1 h,每天两个时间段(分别为9:00~10:00和15:00~16:00[8]),造成人为的餐后血糖波动模式。
1.4 指标观察及检测方法
1.4.1 各组大鼠日内9次血糖浓度及量化血糖稳定性指标检测
血糖波动成模6周后,每周1次,测1 d内8时~12时、15时~18时中9个整点的血糖值,并绘制血糖变化趋势曲线。用日内血糖波动评估参数——血糖日平均水平(mean blood glucose,MBG)、日平均血糖的标准差(standard deviation of daily average blood glucose, SDBG)、最大血糖波动幅度(largest amplitude of glycemic excursions, LAGE)量化各组大鼠血糖稳定性,并采用广大学者公认的血糖波动金标准——平均血糖波动幅度(mean amplitude of glycemic excursion, MAGE)作为重要的血糖波动衡量参数,因其并非某个时间点或某个时间段的血糖数据的统计学离散特征,而是反映一天整个观察时段的血糖波动情况。根据MAGE的原始定义,通过比较筛选数据的人工计算方法进行参数值计算。具体计算方法如下:
(1)绘制血糖数据曲线。利用EXCEL将日内所有血糖数据点绘制成血糖曲线,便于后续观察筛选血糖波动数据点。
(2)计算日内所有血糖数据点的标准差(SDBG),作为血糖数据筛选的参考值。
(3)在血糖数据曲线图中,标记出所有的峰谷血糖值点(即极值点)。
(4)从始到末,观察并记录连续两个相邻极值点的差是否均大于1个SDBG,若是则记录为一个有效血糖波动,重复此步骤,直到观察完所有的极值点。
(5)统计(4)中有效血糖波动的个数,根据第一个有效波动的方向(从波谷到波峰或从波峰到波谷)计算MAGE。计算公式如下:
式中,AGEi(i=1…n)(amplitude of glycemic excursions, AGE)表示根据第一个有效波动的方向(从波谷到波峰或从波峰到波谷)的所有有效血糖波动的波动幅度,n表示有效血糖波动个数[9]。
1.4.2 Morris 水迷宫实验
血糖波动第10周进行Morris水迷宫实验,每只动物每天训练4次,共训练4 d。将各组大鼠分别于相同时间段放入水中,测定大鼠对水迷宫学习和记忆的能力,并用摄像头记录结果。(1)定位航行试验:前4天,每天将大鼠面向池壁依次从4个象限的中点放入水中,并记录其120 s内寻找到隐藏在水面下平台的时间——逃避潜伏期(escape latency),且每次训练间隔60 s以上,记录并比较各组第4天的逃避潜伏期。(2)空间探索实验(spatial probe test):第5天任选1个入水点(本实验采用平台对面的象限中点为入水点),将大鼠放入水池中,并记录大鼠在120 s内的游泳轨迹,考察大鼠对原平台的记忆能力。
1.4.3 海马区氧化应激指标 MDA、SOD、GSH-Px的测定
于血糖波动成模后第11周,从各组中随机选取6只,断头法处死大鼠,取海马组织,并用镊子在冰冷的0.9%(质量分数)氯化钠注射液(以下简称生理盐水)中漂洗,除去血液,滤纸擦干,称其质量。取双侧海马组织按质量体积比1∶9加入预冷的匀浆介质[0.86%(质量分数)的氯化钠注射液],用超声波细胞粉碎机破碎组织,将制备好的10%(质量分数)的匀浆用4 ℃低温离心机3 000 r/min离心12 min,用移液器吸出上清液,转移至1.5 mL离心管中,测定各组上清液中MDA、SOD、GSH-Px浓度。
1.5 统计学方法
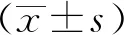
2 结果
2.1 血糖波动6周后各组大鼠日内血糖变化及血糖波动参数
与对照组相比,T2DM组(IG组和SHG组)血糖明显增高,且IG组比SHG组血糖波动范围大,IG组SDBG、LAGE、MAGE高于SHG组,差异有统计学意义(P<0.05),MBG低于SHG组,详见表1。其中,IG组血糖值在10:00和11:00较高,然后呈现出下降趋势至15:00,之后血糖持续上升至17:00左右达到高峰(图1)。
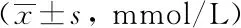
表1 血糖波动6周后各组大鼠MBG、SDBG、LAGE、MAGE比较

图1 血糖波动 6 周后各组大鼠日内血糖变化趋势图
2.2 各组大鼠学习记忆能力情况
血糖波动第10周时,通过Morris水迷宫实验检测发现,T2DM组大鼠第4天的潜伏期长于对照组(P<0.05)。与SHG组相比,IG组第4天的潜伏期呈现延长的趋势,但差异无统计学意义(P>0.05),详见表2。与C组相比,T2DM组大鼠第5天的穿越平台次数、经过目标象限(定位航行实验中平台所在象限)的活动路程比(经过目标象限路程与运动总路程的比值)和活动时间比(经过目标象限时间与运动总时间的比值)均减少(P<0.05)。IG组与SHG组相比,第5天穿越平台次数、经过目标象限的活动路程比与活动时间比均进一步降低(P<0.05)。C组大鼠与T2DM大鼠上台前游动距离和平均速度之间的差异无统计学意义(P>0.05),详见表3。
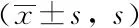
表2 Morris 水迷宫测试大鼠逃避潜伏期

表3 Morris水迷宫实验大鼠空间探索数据
2.3 各组大鼠海马组织氧化应激指标的测定
与C组相比,T2DM大鼠MDA升高(P<0.05),SOD、GSH-Px降低(P<0.05)。与SHG组相比,IG组大鼠MDA升高(P<0.05),SOD及GSH-Px降低(P<0.05)(表4)。

表4 大鼠海马组织内MDA、SOD及GSH-Px测定
2.4 氧化应激指标与学习记忆能力的相关性
采用Pearson相关分析分别评价MDA、GSH-Px、SOD与3组大鼠(n=18)活动路程比、活动时间比的关系,结果显示:MDA与大鼠活动路程比、活动时间比呈负相关;GSH-Px、SOD与大鼠活动路程比、活动时间比呈正相关。采用Spearman相关分析分别评价MDA、GSH-Px、SOD与大鼠穿越平台次数的关系,结果显示MDA与大鼠穿越平台次数呈负相关;GSH-Px、SOD与大鼠穿越平台次数呈正相关,详见表5。
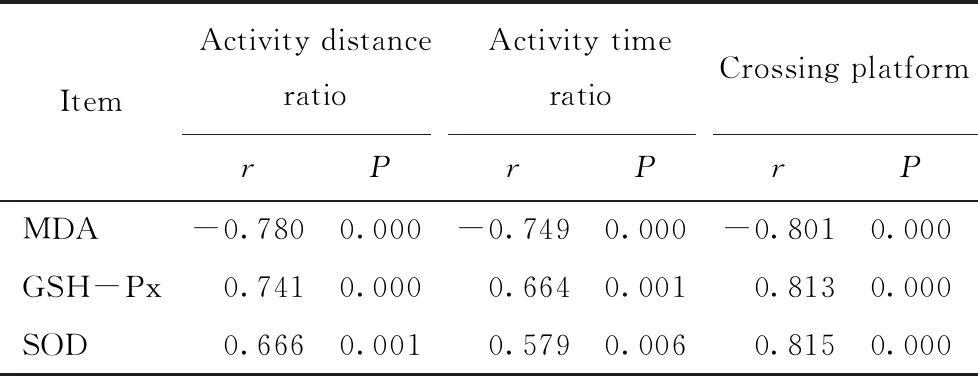
表5 氧化应激指标与大鼠活动路程比、活动时间比及穿越平台次数的相关性
3 讨论
文献[10]报道,制备糖尿病大鼠模型的方法有单纯腹腔注射大剂量的STZ(50~70 mg/kg)和高糖高脂饮食(4~8周)联合小剂量STZ(30~50 mg/kg)两种。后一种方法制备的动物模型类似2型糖尿病特点,如高糖高脂饮食会诱导胰岛素抵抗,同时低剂量的STZ诱导胰岛素分泌轻度损伤,这是T2DM后期的特征[11]。研究[12]显示,高糖高脂饲料诱导时间过短或者STZ剂量过小都不容易诱导糖尿病模型的建立,而且STZ诱导成功后如果停止高糖高脂饲料的喂养,空腹血糖会在一周内又恢复到正常浓度。本试验选择高脂高糖饲料喂养联合单次注射STZ(30 mg/kg)造成血糖相对较低的2型糖尿病模型,以注射后7 d后,测非同日2次随机血糖浓度≥16.7 mmol/L作为糖尿病大鼠模型成功的标准[7],成模率为92.3%。
关于血糖波动模型的建立,有文献[13]报道通过给予T2DM组大鼠皮下注射胰岛素,人为造成血糖波动状态。但有研究[14]报道经鼻胰岛素的短期治疗可以改善早期阿尔茨海默病特征性的病理沉积,从而改善认知功能,如若采用外源性胰岛素来制造血糖波动模型,很可能人为影响大鼠的认知功能,无法对大鼠认知改变情况进行客观评判。国外有报道[8]通过改变大鼠日常饮食习惯和生物节律的方式来模拟糖尿病患者随进食而产生的血糖波动状态,由此本实验采用该方法造成血糖波动状态,避免了外源性胰岛素对T2DM大鼠认知水平可能造成的影响,从而能够客观体现血糖波动对T2DM大鼠认知功能的影响。在诸多血糖波动的评估参数中,MBG、SDBG、LAGE能够比较直观地反映血糖波动性,是主要体现血糖离散特征的衡量指标。而富有代表性的MAGE最早于2006年提出,它反映的血糖波动状况具有其独特优势,是反映日内血糖波动的“金标准”。本实验通过检测日内9个整点的血糖值,得到日内MBG、SDBG、LAGE等量化指标来评价血糖的稳定性。实验显示,IG组大鼠SDBG、LAGE、MAGE高于SHG组,MBG低于SHG组。通过以上结果证实:改变大鼠日常饮食习惯和生物节律可以成功建立血糖波动模型,能够有效地模拟临床糖尿病患者的血糖波动状况。
Morris水迷宫主要测试实验动物对空间位置感和方向感(空间定位)的学习记忆能力,用于检测动物的认知功能。本研究通过Morris水迷宫实验发现,与C组相比,T2DM大鼠第4天逃避潜伏期延长,第5天穿越平台次数、经过目标象限活动路程比和活动时间比减少,提示T2DM组大鼠存在学习记忆障碍。最近研究[15]显示,T2DM可以累及中枢神经系统,进而导致认知功能损害,其机制可能与氧化应激、胰岛素抵抗、脑血管病变、糖、能量代谢受损以及突触的可塑性有关[16]。而且本研究显示,IG组与SHG组相比,上述检测指标均有显著变化,表明血糖波动更易导致T2DM大鼠认知功能受损。为阐明具体机制,笔者进而检测了大鼠海马组织的氧化应激指标。正常情况下,机体内抗氧化系统和氧化系统处于动态平衡,而氧化应激损伤是细胞或机体内氧化性物质产生与消除失衡的一种状态。常用的检测指标MDA不但是膜脂过氧化反应的总产物,而且是反映机体氧化损伤的指标。SOD和GSH-Px是主要的抗氧化酶,其中SOD是评价机体的抗氧化能力的经典指标,GSH-Px的作用是保护细胞膜结构和功能完整。本实验显示:T2DM大鼠较正常对照组海马组织MDA升高,而SOD、GSH-Px明显下降,同时血糖波动组比持续高糖组变化更明显。T2DM是AD公认的危险因素之一,T2DM的外周胰岛素抵抗与AD患者脑内的胰岛素抵抗非常相似,而且研究[17]显示,T2DM与氧化应激密切相关。本实验验证了T2DM与氧化应激密切相关,并且提示血糖波动比持续高血糖更易诱发氧化应激,表现为氧化应激损伤更明显、抗氧化能力也随之降低。而且最近也有类似报道[18],经静脉短时间(48 h)灌注葡萄糖的大鼠,波动性高糖灌注组比持续高糖灌注组的血管内皮细胞产生更多的氧化应激产物。
本研究通过相关与回归分析发现:大鼠海马组织氧化应激指标MDA、GSH-Px和SOD与大鼠活动路程比、活动时间比及穿越平台次数明显相关。MDA与大鼠的活动路程比、活动时间比及穿越平台次数均呈负相关,即大鼠的学习记忆能力随着MDA的增加而降低;而抗氧化酶GSH-Px、SOD与大鼠的活动路程比、活动时间比及穿越平台次数均呈正相关,即随着GSH-Px、SOD的增加,大鼠学习记忆能力表现越好。进一步说明了T2DM引发的认知功能受损很可能与海马组织氧化应激失衡密切相关。
上述研究结果表明,在高糖高脂饮食联合腹腔注射小剂量的STZ(30 mg/kg)基础上,通过改变大鼠饮食习惯及生物节律可以建立血糖波动模型;血糖波动比持续高血糖更易影响T2DM大鼠的认知功能;血糖波动会加剧海马区氧化应激损伤,氧化应激损伤很可能是引起T2DM认知功能受损的重要发病机制之一。
