活性污泥中硝酸盐异化还原为铵的影响因素研究
2021-06-16郝婧羽张新艳王文静任迎春
万 琼,郝婧羽,张新艳,鞠 恺,王文静,任迎春,黄 鑫
(西安科技大学 建筑与土木工程学院,陕西 西安 710054)
0 引言
硝酸盐在厌氧或缺氧状态下可以发生硝酸盐还原过程,自然条件下,完全反硝化过程为主要反应过程,而在人工湿地、土壤、河流、湖泊和海洋底泥等生态环境中,存在明显的硝酸盐异化还原为铵(dissimilatory nitrate reduction to ammonium, DNRA)的过程[1-6]。近年来,在活性污泥中也发现了DNRA氨化过程[7-11]。DNRA氨化将硝化生成的硝酸盐氮还原为氨氮,浪费曝气耗能、降低系统碳源利用率,进一步影响系统脱氮除磷性能。因此,探讨活性污泥中DNRA氨化的影响因素,对于减少或消除DNRA氨化,提高脱氮效率有重要意义。
目前,针对DNRA氨化过程影响因素的研究多集中在生态环境领域。生态环境中已发现硝酸盐限制、碳源、碳氮比是影响DNRA氨化和反硝化竞争的关键因素[2-3],除此之外,温度[12]、pH[13]、氧化还原电位[14]、高盐[15]、硫化物[16]、水力停留时间(hydraulic retention time,HRT)[17]和污泥龄(sludge retention time, SRT)[3]等也会影响两者竞争。DNRA氨化环境具有低流速(HRT长、稀释率较高、硝酸盐限制)、低扰动(水力剪切力弱、SRT长)和具备载体等共性[16-20],而城市污水处理厂具备低流速、连续流、硫酸盐含量高等特点,因此,研究流态、水力停留时间和硫离子(sulfion, S2-)对DNRA氨化的影响,对于提高污水厂脱氮效率具有重要意义。
本文通过连续流和间歇流两种流态下硝酸盐还原试验,分析了HRT和投加硫化物(S2-)对反应过程中化学需氧量(chemical oxygen demand, COD)、氨氮、硝酸盐氮、亚硝酸盐氮质量浓度变化的影响,且针对DNRA氨化过程中的微生物进行高通量测序,探讨流态、HRT和S2-的投加对活性污泥DNRA氨化的影响规律。
1 试验材料和方法
1.1 试验材料
试验污泥取自实验室两个反应器(1#间歇流和2#连续流)。两个反应器均采用有机玻璃制成,结构为立式圆柱形,内径14 cm,外径16 cm,高50 cm,有效体积5.0 L。反应器启动时,接种污泥为西安市某污水处理厂A2O工艺剩余污泥。1#间歇流反应器进水0.25 L/min,出水1.25 L/min,加热搅拌300 min。2#连续流反应器(连续进水,间歇出水)进水0.008 1 L/min,出水1.25 L/min,加热搅拌310 min。两个反应器运行温度是25 ℃,HRT为6 h,SRT为10 d。测试开始时均已稳定运行140 d,系统COD去除率分别是70.7%及71.7%,硝酸盐去除率分别是28%及31%,出水氨氮质量浓度分别为2.32 mg/L和2.68 mg/L。
试验废水为人工配制,按照文献[17]提供的活性污泥系统DNRA菌富集方法驯化活性污泥:采用易降解基质乙酸钠为碳源,磷酸二氢钾为磷源,硝酸钠为氮源和电子受体,CH3COONa 770 mg/L,NaNO3100 mg/L,KH2PO472 mg/L,微量元素溶液使用量为0.6 mL/L,每升组份如下:90 g MgSO4·7H2O,14 g CaCl2·5H2O,7.5 g FeSO4·7H2O,0.15 g H3BO3,0.03 g CuSO4·5H2O,0.18 g KI,0.12 g MnCl2·H2O,0.06 g Na2MoO4·2H2O,0.12 g ZnSO4·7H2O,0.15 g CoCl2。配水中加入1 mol/L HCl调节初始pH值为6.50±0.05。为消除氨氮的影响,试验废水采用纯水配制。
1.2 试验方法
本试验反应器为500 mL广口瓶,有效体积为500 mL。试验步骤如下:选取1#间歇流反应器中1 500 mL的泥水混合液离心淘洗3次,均分成3份,分别加入空白试验(只投加碳源COD 300 mg/L,未投加硝酸盐氮和S2-)、HRT试验(投加硝酸盐氮80 mg/L和碳源COD 300 mg/L,未投加S2-)与S2-投加试验(投加20 mg/L的S2-、碳源COD 300 mg/L及硝酸盐氮80 mg/L),反应器分别记为1a、1b、1c。用1 mol/L的HCl调节各反应器初始pH为6.50±0.05。且用高纯氮气曝气3 min以脱除反应器混合液中的氧气。将反应器置于恒温旋转水浴摇床中,控制转速为140 r/min,温度为30 ℃,分别在HRT为0 h、1 h、3 h、6 h、12 h、24 h、36 h和48 h时取样,进行相关指标的测定分析。同样选取2#连续流反应器中的泥水混合液重复如上试验,反应器分别记为2a、2b、2c。反应结束后,取1b、1c、2b、2c的污泥进行高通量测序。
1.3 分析方法
试验中常规水质项目的测定采用国家标准方法[21],pH由pH计(PHS-3C,雷磁)测定。氮物料平衡计算时,总氮的损失量认为是通过反硝化生成了N2或N2O,氨氮质量浓度均已除去空白试验中氨氮产生的质量浓度。
高通量测序送至上海美吉公司测定,首先提取污泥脱氧核糖核酸(deoxyribonucleic acid,DNA),在DNA样品定量和检查合格后,进行高通量测序。引物选取V3-V4区Nobar_341F(CCTACGGGNGGCWGCAG)及Nobar_805R(GACTACHVGGGTATCTAATCC)。具体扩增程序如文献[22],测序平台为Illumina Miseq,进行双端测序。
2 结果与讨论
2.1 不同流态下HRT和S2-的投加对硝酸盐还原方式的影响
2.1.1 间歇流下HRT和S2-投加对硝酸盐还原方式的影响
取1#间歇流反应器中驯化的活性污泥作批式试验,得到空白试验样1a、HRT试验样1b和S2-投加试验样1c的COD、氨氮、硝酸盐氮、亚硝酸盐氮质量浓度随HRT的变化,如图1所示。
空白试验因未投加任何形式的氮和S2-,其他运行条件相同,增加的氨氮可认为是由内源呼吸产生。由图1a可得:当HRT在36 h以内,氨氮质量浓度均小于5.00 mg/L,因此内源呼吸的影响可忽略不计。当HRT为48 h时,氨氮质量浓度为11.40 mg/L,且COD质量浓度有所上升,此时活性污泥内源呼吸的影响较大,因此不再继续延长HRT。
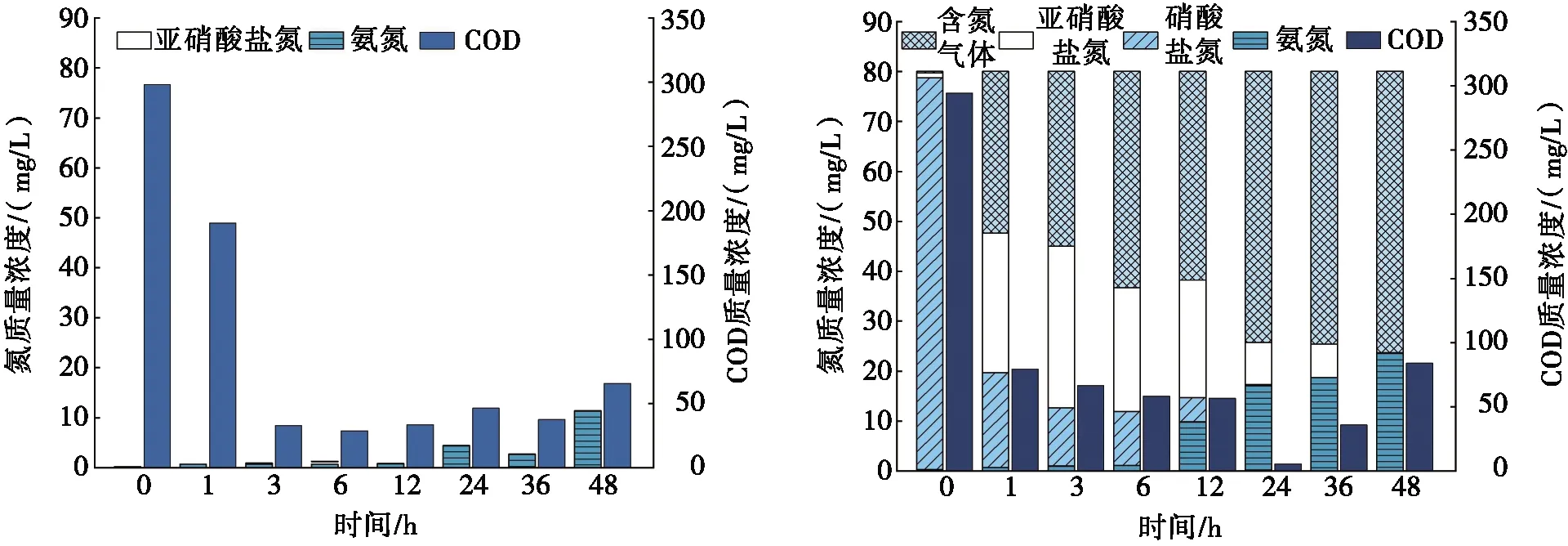
(a) 空白试验,无硝酸盐氮,无S2- (b) HRT试验,c(碳)/c(氮)=300/80,无S2-
由图1b可得:当HRT小于6 h时,硝酸盐氮质量浓度下降较快,亚硝酸盐氮积累较多(最高积累到28.00 mg/L,3 h),生成含氮气体较多,反硝化占据主导地位。氨氮质量浓度较低(0.43 mg/L),只发生了少量DNRA氨化。随着HRT逐渐延长,DNRA作用逐渐增强,36 h时达到峰值(氨氮质量浓度为15.98 mg/L),之后趋于平缓。说明延长HRT能够促进DNRA氨化,这也与文献[23]研究结果类似,世代时间(或生长速度)是影响反硝化和DNRA对硝酸盐竞争的关键要素,反硝化在较短的SRT(高增长率)下占优势。且DNRA氨化菌还原单位硝酸盐所需的碳源多,受到电子供应瓶颈的影响,DNRA反应速率较低(所需HRT较长),世代时间较长(所需SRT较长)。
由图1b与图1c对比可知:当HRT为6 h时,投加S2-后,亚硝酸盐氮质量浓度增加6.83 mg/L,说明投加S2-促进了亚硝酸盐氮的积累,从而有利于将部分亚硝酸盐氮转化为氨氮。当HRT为36 h时,投加S2-后氨氮质量浓度为17.83 mg/L,比投加前增加11.58%。表明投加S2-对于间歇流驯化的活性污泥系统的DNRA氨化有促进作用,但不显著。
2.1.2 连续流下HRT和S2-的投加对硝酸盐还原方式的影响
取2#连续流反应器中驯化的活性污泥作批式试验,得到空白试验样2a、HRT试验样2b与S2-投加试验样2c的COD、氨氮、硝酸盐氮和亚硝酸盐氮质量浓度随HRT的变化,如图2所示。
与间歇流相比,内源呼吸对连续流的影响较小。由图2a可得:当HRT为48 h时,空白试验反应器产生氨氮质量浓度为5.90 mg/L。与间歇流类似,为避免内源呼吸影响,HRT同样不适合再延长。
由图2b可知:当HRT由6 h延长至48 h时,氨氮质量浓度由2.03 mg/L升至20.78 mg/L,氨氮质量浓度峰值比间歇流条件下增加4.80 mg/L。文献[17]在富集培养DNRA菌时也发现,连续流的环境更适合DNRA菌的生长。连续流条件下HRT为48 h更有利于DNRA氨化。

(a) 空白试验,无硝酸盐氮,无S2- (b) HRT试验,c(碳)/c(氮)=300/80,无S2-
对比图2b和图2c可知:当HRT为36 h时,投加S2-后,氨氮质量浓度达到峰值,为24.49 mg/L,比投加前增加24.82%。说明投加S2-对DNRA氨化有促进作用,且这种促进作用对于连续流驯化的活性污泥更有效果。
2.2 不同流态下微生物群落差异
取反应48 h后的活性污泥进行高通量测序,测定污泥中所含DNRA菌的丰度及群落结构的组成。并比较投加S2-前后活性污泥中所含DNRA菌的占比及细菌的α-多样性指数,验证S2-对DNRA菌的促进作用。结果如图3、图4及表1所示。

表1 细菌的α-多样性指数
2.2.1 间歇流下投加S2-前后的DNRA细菌群落组成
参照文献[7,9,24-25]中的生态环境及活性污泥常见DNRA功能菌属,本试验中间歇流下投加S2-前的样本中主要DNRA菌属(见图3)为:丛毛单孢菌属(Comamonas)(相对丰度最大,为29.82%),接下来依次为梭菌属(Clostridium)(相对丰度为7.01%)、索氏菌属(Thauera)(相对丰度为6.74%)、厌氧醋菌属(Acetoanaerobium)(相对丰度为4.18%)、铁杆菌属(Ferruginibacter)(相对丰度为3.51%)、红细菌属(Rhodobacter)(相对丰度为0.93%)、氢噬胞菌属(Hydrogenophaga)(相对丰度为0.71%)。间歇流下投加S2-前DNRA功能菌属的总相对丰度为52.90%。投加S2-后,样本中的主要DNRA菌属发生了明显变化。丛毛单孢菌属(Comamonas)的相对丰度降至16.82%,厌氧醋菌属(Acetoanaerobium)增至14.52%,索氏菌属(Thauera)增至6.78%,铁杆菌属(Ferruginibacter)增至5.06%,红细菌属(Rhodobacter)增至1.35%,氢噬胞菌属(Hydrogenophaga)增至0.74%。样本中新增变形菌属(Proteocatella)(相对丰度为5.58%)和不动杆菌属(Acinetobacter)(相对丰度为1.02%)。投加S2-后DNRA功能菌属的总丰度为51.87%,与投加前相差不大。说明在间歇流条件下活性污泥系统中,投加一定质量浓度的S2-可以引起系统中DNRA功能菌菌群结构变化,但对DNRA功能菌的总相对丰度影响不大。
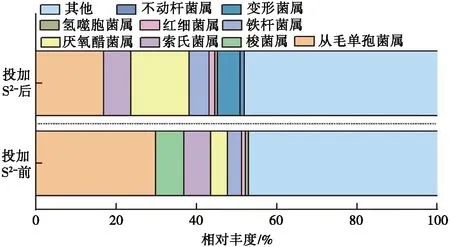
图3 间歇流下投加S2-前后的DNRA细菌群落组成
2.2.2 连续流下投加S2-前后的DNRA细菌群落组成连续流下投加S2-前的样本中主要DNRA菌属(见图4)为:红细菌属(Rhodobacter)(相对丰度最大,为16.02%)、丛毛单孢菌属(Comamonas)(相对丰度为8.78%)、脱氮单孢菌属(Dechloromonas)(相对丰度为2.37%)、氢噬胞菌属(Hydrogenophaga)(相对丰度为2.00%)、索氏菌属(Thauera)(相对丰度为1.38%),这些优势菌属大多具有脱氮除磷功能,生长周期短,生长速率远大于自养菌,环境适应性强[26]。连续流下投加S2-前DNRA功能菌属的总相对丰度为30.55%。投加S2-后索氏菌属(Thauera)的相对丰度增加至42.61%,红细菌属(Rhodobacter)降至5.51%,丛毛单孢菌属(Comamonas)降至2.49%,氢噬胞菌属(Hydrogenophaga)降至0.98%,样本中新增假单胞菌属(Pseudomonas)(相对丰度为0.82%)、不动杆菌属(Acinetobacter)(相对丰度为0.47%)和铁杆菌属(Ferruginibacter)(相对丰度为0.32%)。投加S2-后DNRA功能菌属的总丰度为53.20%,比投加前增加了22.65%。说明在连续流活性污泥系统中,投加一定质量浓度的S2-可显著改变DNRA菌群结构和提高DNRA氨化菌的相对丰度,且这种促进作用对于连续流驯化的活性污泥更为显著。

图4 连续流下投加S2-前后的DNRA细菌群落组成
比较图3和图4可知:间歇流和连续流条件下活性污泥系统中,DNRA氨化菌菌种和菌群结构明显不同。连续流缓慢但不间断地提供基质,细菌处于饥饿状态的较少,而间歇流一次性提供充足的基质,其余时间细菌均处于饥饿状态,因此部分细菌无法适应而死亡,继而产生新的菌群种类[27],如变形菌属和不动杆菌属等。投加一定质量浓度的S2-后,较高的硫化物条件促进了硫化细菌(脱硫球菌科、酸铁菌科、黄单胞菌科)和硫酸盐还原菌(脱硫单胞菌科、脱硫杆菌科)的活性及种群数量[20],显著提高了菌种的多样性。
2.2.3 细菌α-多样性指数分析
本研究选取丰富度指数(Chao1指数)和多样性指数(Shannon指数)对菌群的α-多样性进行分析,结果见表1。由表1可得:4个样本的覆盖率均达到90%以上,说明此测序结果反映了样本的真实情况。连续流样本的Chao1指数小于间歇流,且投加S2-后的样本Chao1指数高于投加前,说明连续流系统下种群的丰富度低于间歇流,投加S2-能够增加样本的丰富度。连续流样本Shannon指数低于间歇流,投加S2-后的样本Shannon指数高于投加前。说明连续流下种群的多样性低于间歇流,多样性高说明系统更稳定,但是对于富集DNRA氨化菌的系统,多样性高意味着富集效果较差,且连续流DNRA氨化菌富集数量(53.20%)高于间歇流(51.87%),因此连续流富集效果优于间歇流,这与前面的试验结果一致。综上,连续流序批式反应器(sequencing batch reactor, SBR)富集效果优于间歇流,但间歇流的种群丰富度和多样性更高。S2-的投加增加了样本微生物丰度及多样性。
3 结论
(1)延长HRT对不同流态下活性污泥中DNRA氨化速率均具有明显促进作用。
(2)投加S2-对不同流态下活性污泥中DNRA氨化速率均具有促进作用,且这种促进作用在连续流下比间歇流下的效果更为明显。投加S2-后,连续流下DNRA细菌丰度增加了约22.65%。
(3)连续流系统比间歇流系统更适合DNRA细菌的生长繁殖。两种流态下DNRA优势菌略有不同。在间歇流样本中DNRA氨化优势菌是丛毛单孢菌属(Comamonas),在连续流样本中优势菌是红细菌属(Rhodobacter)和索氏菌属(Thauera)。
