人工湿地植物根际降解β-HCH细菌筛选及鉴定
2021-06-16梁延鹏曾鸿鹄覃礼堂
罗 爽,梁延鹏,3,曾鸿鹄,3,覃礼堂,4
(1.桂林理工大学 环境科学与工程学院,广西 桂林541004;2.广西岩溶地区水污染控制与用水安全保障协同创新中心,广西 桂林541004;3.广西环境污染控制理论与技术重点实验室,广西 桂林541004;4.广西环境污染控制理论与技术重点实验室科教结合科技创新基地,广西 桂林541004)
0 引言
工业纯六氯环乙烷(hexachlorocyclohexane,HCHs)由苯在紫外光作用下光化学氯化制成,主要由4种同分异构体α-HCH、β-HCH、γ-HCH和δ-HCH组成,其中β-HCH性质最为稳定,极难降解[1]。人工湿地能有效控制农业面源污染,且比常规污水处理厂更灵活简便,投资少[2]。微生物是人工湿地的重要组成部分,研究表明:微生物可将农药通过酶促反应降解,将农药降解为CO2、H2O和N2等无毒物质[3],如土壤中双对氯苯基三氯乙烷(dichlorodiphenyltrichloroethane,DDT)等难降解有机氯农药,通过投加外源降解菌以及降解菌提取物,能显著提高系统中DDT等有机氯农药的去除效率[4-8]。迄今,国内外微生物用于降解HCHs的研究中,大多数是放线菌中链霉菌的降解效果较好[9-13]。也有学者报道鞘脂鞘氨醇单孢菌(Sphingobiumpaucimobilis)对HCHs的4种异构体均能起到降解作用,鞘脂醇单胞菌B90A(SphingobiumindicumB90A)与β-HCH于30 ℃下反应72 h,对β-HCH的降解率为86%[14]。其他农药方面,比如秦晶筛选的硫丹耐受菌,在外加碳源情况下,对硫丹的最高降解率仅为31.02%[15]。目前,微生物去除农药的研究主要应用于特定条件下的微生物培养分离技术,对利用人工湿地优势微生物去除农药的研究特别是针对β-HCH的研究较少。
本文选取已稳定运行超60 d的用于降解β-HCH的人工湿地模型,采集植物根际泥水混合物,进行富集筛选分离β-HCH降解菌,以期得到对β-HCH降解能力强且具有耐药性的优势细菌。并探究了时间、菌株投加量和复合菌群对β-HCH的降解效果,为实际工程应用提供基础数据支撑。
1 材料与方法
1.1 菌源
通过从本课题组试验结果得知:种植美人蕉的人工湿地模型对β-HCH降解效果最佳[15],于是从已建立的用于β-HCH降解研究稳定运行超60 d的人工湿地模型装置微宇宙系统中,采集美人蕉根区的泥水混合物,进行富集培养。
1.2 材料
富集培养基:蛋白胨0.6 g,NaCl 0.1 g,KH2PO40.1 g,蒸馏水1 000 mL,pH7。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂粉15 g,蒸馏水1 000 mL,pH7.4~pH7.6。
高氏1号培养基:可溶性淀粉2 g,K2HPO40.05 g,MgSO40.05 g,KNO30.1 g,NaCl 0.05 g,FeSO4·7H2O 0.01 g,琼脂15 g,蒸馏水1 000 mL,pH7.2~pH7.4。
马丁氏培养基:KH2PO41 g,MgSO4·7H2O 0.5 g,蛋白胨5 g,葡萄糖10 g,琼脂粉15 g,蒸馏水1 000 mL,pH自然,向1 000 mL培养液中加入质量分数为1%的孟加拉红水溶液3.3 mL。临用时以无菌操作在100 mL培养基中加入1%的链霉素0.3 mL,使其终质量浓度为30 μg·mL-1。
不含碳不含硫无机盐培养基:KH2PO42 g,NH4Cl 1 g,K2HPO47.5 g,NaCl 0.5 g,MgCl 0.1 g,蒸馏水1 000 mL,pH自然[16]。
β-HCH混合标准溶液购自农业部环境质量监督检测测试中心;正己烷、丙酮、乙酸乙酯、二氯甲烷均为色谱纯,硝酸混合标准溶液、无水硫酸钠为分析纯,购自天津光复精细化工研究所;甲醇为色谱纯,购自西陇化工股份有限公司。
1.3 菌株的筛选
富集:将植物根区的泥水混合物充分振荡摇匀后,吸取1 mL至100 mL富集培养基中,并作纯培养液空白对照,平行3组。在30 ℃、200 r·min-1恒温摇床培养箱中富集培养48 h得到悬浊液。
分离纯化:将待测的悬浊液按照10倍梯度稀释法进行稀释,其中细菌的培养稀释度为10-4、10-5、10-6,放线菌的培养稀释度为10-3、10-4、10-5,真菌的培养稀释度为10-1、10-2、10-3,做3次平行试验。细菌、放线菌和真菌分别采用牛肉膏蛋白胨固体培养基、高氏一号固体培养基和马丁氏固体培养基培养。在恒温培养箱中,细菌在37 ℃下培养24 h,放线菌在30 ℃下培养5 d,真菌在30 ℃下培养4 d。将生长成较为单一但颜色、形态等特征不同的菌落挑出,继续用上述分离培养基划线分离,直至每一个培养基均为单一菌种培养基。
1.4 菌株的鉴定
菌株DNA的提取、PCR扩增及纯化、测序等操作过程,委托上海生工生物工程技术服务有限公司进行,并通过MEGA 4.0软件将基因序列构建系统进化树。
1.5 菌液前处理方法
菌液在14 000 r·min-1离心10 min,收集上清液,再对上清液采用0.45 μm玻璃纤维滤膜抽滤,滤后菌液按体积比100∶1加入甲醇,用硝酸调节至pH<2。用10 mL乙酸乙酯/二氯甲烷(体积比1∶1)混合溶液、10 mL甲醇和10 mL超纯水依次活化C18柱,活化后以10 mL·min-1流量将滤后水样连续通过C18柱,再用10 mL超纯水淋洗C18柱,氮气加压干燥小柱40 min。用6 mL乙酸乙酯/二氯甲烷(体积比1∶1)混合液分两次洗脱目标组分,收集洗脱液,高纯氮气吹至近干,正己烷定容至1 mL,混匀待测[17]。
1.6 色谱分析与质量控制
仪器:采用配备电子捕获器(electron capture detector,ECD)的气相色谱仪(Clarus 600)。
色谱条件:起始柱温为80 ℃,以8 ℃· min-1的速度升至210 ℃,保持2 min,以2 ℃· min-1的速度升至230 ℃,保持2 min。进样口、检测器温度分别为280 ℃、320 ℃。
载气:高纯氮气;不分流进样1 μL;柱流量为0.6 mL·min-1。
运用气相色谱-电子捕获器(gas chromatography-eletron capture detector,GC-ECD)对样品进行测试分析,根据外标校正曲线法进行定量(R>0.995)。菌液样空白加标回收率为82.2%~102.2%。
2 结果与讨论
2.1 驯化及结果
挑取反复分离纯化后的单一菌落,接种于无机盐液体培养基中,使培养基β-HCH质量浓度为10 μg·L-1,在30 ℃、200 r·min-1条件下培养,7 d后转接至含β-HCH质量浓度为15 μg·L-1的无机盐液体培养基,再过7 d测定培养基内β-HCH剩余质量浓度,得到对β-HCH降解效果最佳的3株菌。将这3株菌分别命名为B、F、J。
2.2 菌株降解β-HCH效果分析
菌株纯化结束后,平板上挑取典型菌落,接种于牛肉膏蛋白胨培养基中进行扩增培养,采用微孔板分光光度计测量波长为600 nm的光密度(optical density,OD),待其长到OD600=0.5~0.6,取各菌种培养液10 mL于7 000 r·min-1离心10 min,丢弃上清液,用无菌磷酸缓冲盐溶液(PBS)反复冲洗2~3次,重悬于同等体积的无菌PBS中,作为降解菌液备用。以1%的接种量将各菌株分别接种至含有β-HCH(10 μg·L-1)的100 mL无机盐液体培养基和含有β-HCH(100 μg·L-1)的100 mL无机盐液体培养基中,每组均加入1 g酵母浸出粉作为辅助碳源,在30 ℃、200 r·min-1条件下摇床培养,采用微孔板分光光度计连续5 d测量每瓶菌液OD600,5 d后取出测定β-HCH剩余质量浓度。结果如图1和图2所示。
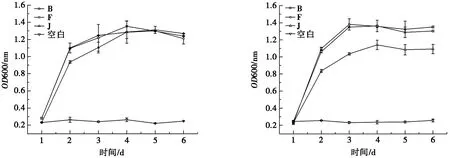
(a) 10 μg·L-1 β-HCH环境下菌株的生长曲线 (b) 100 μg·L-1 β-HCH环境下菌株的生长曲线
由图1可见:B菌株在10 μg·L-1β-HCH环境下比在100 μg·L-1β-HCH环境下生长速率更快;F菌株在10 μg·L-1β-HCH环境下于第4天停止增长,在100 μg·L-1β-HCH环境下第3天停止生长;J菌株在10 μg·L-1和在100 μg·L-1β-HCH环境下均于第4天进入稳定期,但J菌株在10 μg· L-1β-HCH环境下的生长速率于第2天后明显比100 μg·L-1β-HCH环境下要低,并且5 d后最终菌株数量也低于100 μg·L-1β-HCH环境下的菌株数量,由此说明,B、F和J这3株菌均因为β-HCH质量浓度的提高受到了一定程度的抑制。由图2a可知:3株菌5 d后对10 μg·L-1的β-HCH的平均降解率达66.31%、67.38%和62.68%。图2b中,3株菌5 d后对100 μg·L-1的β-HCH的平均降解率分别达61.61%、64.07%和59.26%。3株菌对10 μg·L-1、100 μg·L-1的β-HCH降解率差距不大,酵母浸出粉能显著提高菌株的生长速率[18],富锗酵母蛋白粉对不同的菌株有一定的增菌效果[19],可缩短反应时间[20]。由此认为试验组内所生长的菌株已足够降解培养基内溶解的β-HCH。
2.3 不同时间菌株对β-HCH的降解
为了探究不同时间降解菌对β-HCH的降解效果,以及培养基对β-HCH的吸附作用,共设置10组试验:①(B+培养基)×3瓶,②(F+培养基)×3瓶,③(J+培养基)×3瓶,④培养基×3瓶,⑤超纯水×3瓶,①~⑤组均设置β-HCH质量浓度为10 μg·L-1;⑥(B+培养基)×3瓶,⑦(F+培养基)×3瓶,⑧(J+培养基)×3瓶,⑨培养基×3瓶,⑩超纯水×3瓶,⑥~⑩组均设置β-HCH质量浓度为100 μg·L-1。
采用2.2中的方法制备降解菌液,并以1%的接种量接种至100 mL无机盐液体培养基中,每组均加入1 g酵母浸出粉作为辅助碳源,在30 ℃、200 r·min-1条件下摇床培养,分别于第2天、第3天和第5天在①~⑩组中各取出1瓶,测量OD600,并检测培养基内剩余β-HCH的质量浓度。结果如图3和图4所示。
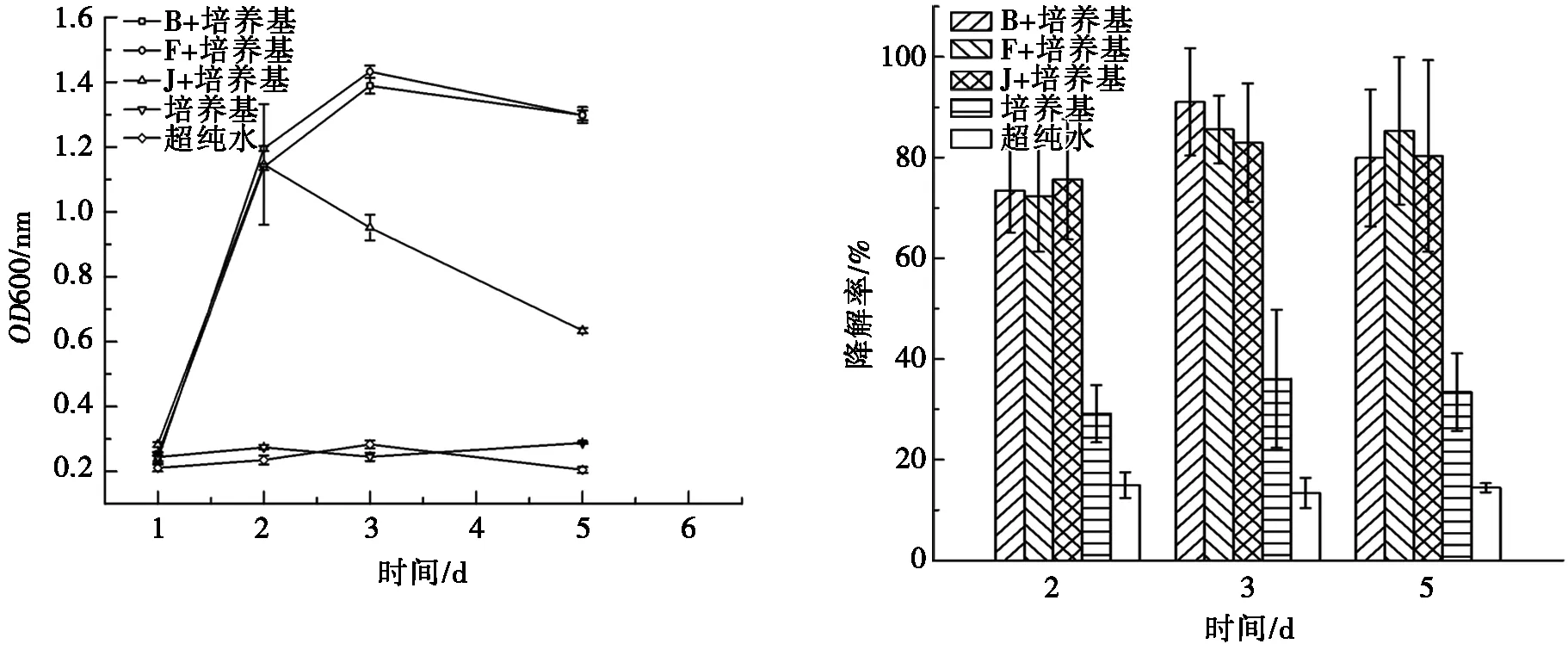
(a) 菌株生长曲线 (b) 菌株对β-HCH的降解率
由图3a可见:B、F菌株在10 μg·L-1β-HCH环境下生长至第3天后进入稳定期,J菌株在10 μg· L-1β-HCH环境下生长至第2天后开始衰亡期。由图4a可见:B、F和J在100 μg· L-1β-HCH环境下第2天后进入稳定期,并且B、F这2株菌在10 μg·L-1β-HCH环境下比在100 μg·L-1β-HCH环境下生长数量高,也说明β-HCH质量浓度的提高对B、F这2株菌有一定程度的抑制作用。研究表明:药品及个人护理用品(pharmaceuticals and personal care products, PPCPs)初始浓度越高,对菌株生长抑制效果越明显[21],阿特拉津、有机磷农药初始浓度的升高会抑制降解菌的生长[22-23]。
由图3b可见:B、F和J菌株在10 μg·L-1β-HCH环境下,第2天对β-HCH的平均降解率达到约44.31%,43.21%和46.54%,均于第3天达到平均降解率最高值,约54.95%、49.49%和46.88%,与两种菌株的对数生长期相对应。由图4b可见:B、F和J菌株在100 μg·L-1β-HCH环境下,也是在第2天对β-HCH的降解率达到峰值后下降。且菌株无论是在10 μg·L-1β-HCH环境下还是在100 μg·L-1β-HCH的环境下,待菌株进入衰亡期后,降解率均有所下降。由此说明,菌株对β-HCH的降解主要在对数生长期,在菌株进入稳定期甚至衰亡期后,菌株的死亡可能造成了菌株体内β-HCH的释放,导致进入稳定期和衰亡期的试验组β-HCH检测含量较对数期更高。文献[24]研究表明:降解菌主要是在对数生长期降解,因为菌株的扩增对其污染物进行降解,后期碳源不足,菌株自溶死亡。如图3b和图4b空白对照所示,10 μg·L-1β-HCH环境下和100 μg·L-1β-HCH环境下的培养基与超纯水都没有对菌株生长形成污染,但培养基对10 μg-1L β-HCH的平均降解率较超纯水平均高约18.61%,对100 μg·L-1β-HCH的平均降解率较超纯水平均高约24.06%,说明培养基会吸附部分β-HCH。
2.4 菌株接种量对降解β-HCH效果的影响
为了确定不同降解菌接种量对β-HCH降解效果的影响,采用2.2中的方法制备降解菌液,每组均加入1 g酵母浸出粉作为辅助碳源,设置11组试验:①0.1 mL B+培养基;②0.5 mL B+培养基;③1.0 mL B+培养基;④0.1 mL F+培养基;⑤0.5mL F+培养基;⑥1.0 mL F+培养基;⑦0.1 mL J+培养基;⑧0.5 mL J+培养基;⑨1.0 mL J+培养基;⑩培养基对照;超纯水对照。β-HCH质量浓度均设置为100 μg·L-1。在30 ℃、200 r·min-1条件下摇床培养,连续5 d采用微孔板分光光度计测量每瓶菌液OD600,5 d后取出测定培养基内β-HCH剩余质量浓度。结果如图5~图7所示。

(a) 菌株生长曲线 (b) 菌株对β-HCH的降解率
由图5和图6可见:B、F菌株的生长速率均是接种量越高生长速率越快,6个试验组于第3天左右进入稳定期,第3天后B菌株生长曲线下降速率接种量为0.5 mL的试验组小于接种量为1 mL和0.1 mL的试验组,对应B菌株3个试验组对β-HCH的降解率,说明B菌株接种量为0.5 mL时对β-HCH降解效果最佳。第3天后F菌株接种量为1 mL的试验组直至试验结束一直处于稳定期,菌株仍有少量的增长,接种量为0.1 mL和0.5 mL的试验组于第3天后菌株生长量呈下降趋势,至试验结束,接种量为1 mL的试验组OD600大于接种量0.5 mL和0.1 mL的试验组,对应F菌株3个试验组对β-HCH的降解率,说明F菌株接种量越高对β-HCH的降解效果最佳。
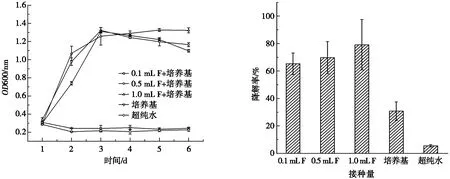
(a) 菌株生长曲线 (b) 菌株对β-HCH的降解率
由图7可见:J菌株生长速率同样是接种量越高生长速率越快,接种量为0.1 mL和1.0 mL的试验组于第4天后完全进入稳定期,接种量为0.5 mL的试验组在试验周期内一直在生长,没有进入衰亡期。接种量为1 mL的试验组降解率大于接种量为0.5 mL和0.1 mL的试验组,但3组对β-HCH的降解率差距不大,说明J菌株降解β-HCH时,接种量越高对β-HCH的降解效果越好。研究表明:Sphingobiumpaucimobilis降解HCH异构体的降解效率时,反应72 h后,提高接种量的试验组中,菌株对α-、β-、γ-和 δ-HCH 的降解率均明显提高[25],产漆酶血红密孔菌对城市污泥堆肥过程中有机氯农药的降解效应表明供试菌剂剂量大小对HCH不同异构体降解效果不尽相同[26]。以上的菌株接种量均大于1%,本试验中菌株接种量对其降解β-HCH效果影响不明显,有可能是接种量过低导致。
2.5 复合菌群降解β-HCH效果分析
为了探究复合菌群对β-HCH降解效果的影响,分别将B、F和J这3株菌以相同的体积比和不同的体积比混合,再以1%的接种量接种至100 mL无机盐液体培养基中,共设置两组试验。第1组:①V(B)∶V(F)∶V(J)=1∶1∶2;②V(B)∶V(F)∶V(J)=1∶2∶1;③V(B)∶V(F)∶V(J)=2∶1∶1;④V(B)∶V(F)∶V(J)=1∶2∶2;⑤V(B)∶V(F)∶V(J)=2∶1∶2;⑥V(B)∶V(F)∶V(J)=2∶2∶1;⑦培养基对照;⑧超纯水对照。第2组:①V(B)∶V(F)∶V(J)=1∶1∶1;②V(B)∶V(F)∶1∶1;③V(B)∶V(J)=1∶1;④V(F)∶V(J)=1∶1;⑤培养基对照;⑥超纯水对照。均设置β-HCH质量浓度为100 μg·L-1。每组均加入1 g酵母浸出粉作为辅助碳源,在30 ℃、200 r·min-1条件下摇床培养,连续5 d采用微孔板分光光度计测量每瓶菌液OD600,5 d后取出测定培养基内β-HCH剩余质量浓度。结果如图8和图9所示。

(a) 菌株生长曲线 (b) 菌株对β-HCH的降解率
由图8和图9可见:B、F和J这3株菌株以不同比例和相同比例构建的复合菌群均在第3天后进入稳定期,但其生长速率以及试验结束后剩余的菌株含量对β-HCH的降解率没有明显影响。如图8b所示,3株菌以不同比例复配时,投入B菌株比例为1时,V(B)∶V(F)∶V(J)= 1∶2∶1降解效果最佳,投入F菌株比例为1时,V(B)∶V(F)∶V(J)=2∶1∶2降解效果最佳;投入J菌株比例为1时,V(B)∶V(F)∶V(J)=1∶2∶1降解效果最佳;全部不同比例复合菌群对β-HCH降解效果最佳比例为V(B)∶V(F)∶V(J)=2∶1∶2。
文献[27]研究表明:单一菌种对有机污染物降解能力往往低于复合菌群,这会使得复合菌群具备优于单一菌种生长情况。文献[28]研究发现:单菌种培养降解磺胺甲噁唑(sulfamethoxazole,SMX)降解率仅为0.2%~1.5%,而将生物降解效果最好的4种菌混合培养降解 SMX,降解率提升了约4.2倍,显著提升了其降解效果。如图9b所示,相同比例复合菌群对β-HCH降解效果最佳的试验组比例为V(F)∶V(J)=1∶1。试验组V(B)∶V(F)∶V(J)= 2∶1∶2对β-HCH的平均降解率为57.66%,而V(F)∶V(J)=1∶1对β-HCH的降解率为46%。由此可得:复合菌群V(B)∶V(F)∶V(J)=2∶1∶2对β-HCH的降解效果最佳。但复合菌群的降解效果并未超过单菌,可能是由于降解菌株之间存在拮抗作用。
2.6 菌种鉴定
将以上3株降解菌用试剂盒提取基因组DNA后,进行特异引物PCR扩增,DNA电泳检测结果见图10,PCR电泳检测结果见图11。
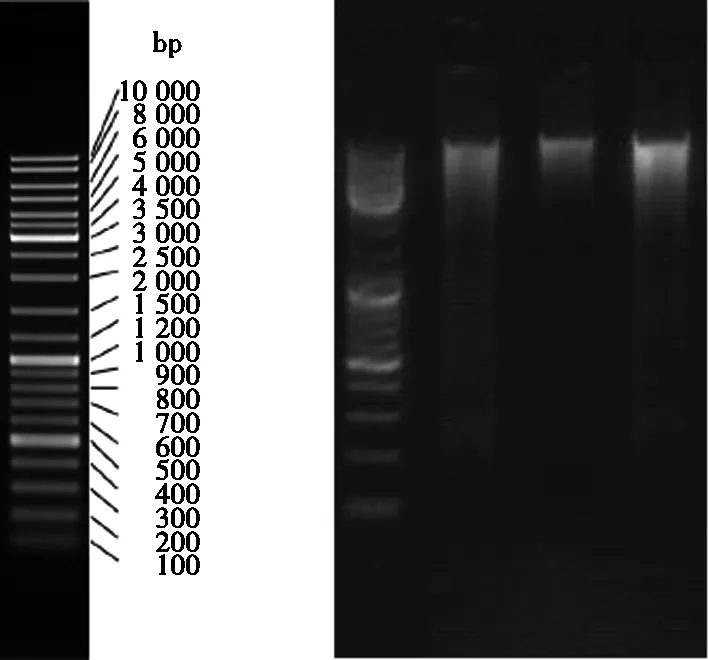
图10 β-HCH降解菌DNA电泳检测结果图

图11 β-HCH降解菌PCR电泳检测结果图
由图10可见:3株降解菌的基因组DNA条带不清晰,DNA有较明显的降解现象,样孔干净,证明DNA样品没有被蛋白质污染。由图11可见:扩增条带清晰,说明这3株菌纯度较高,PCR扩增效果好。
3株菌株进行16S rDNA菌种鉴定后,获得菌种序列。经鉴定,B菌属于苍白杆菌属(Ochrobactrum),疑似为中间苍白杆菌(Ochrobactrumintermedium),其分类单元为:细菌界(Bacteria);变形菌门(Proteobacteria);丙酸杆菌纲(Alphaproteobacteria);根瘤菌目(Rhizobiales);布鲁氏菌科(Brucellaceae);苍白杆菌属(Ochrobactrum)。F菌与B菌同属于苍白杆菌属(Ochrobactrum),分类单元相同。J菌属于假单胞菌属(Pseudomonas),疑似为浅黄假单胞菌(Pseudomonasluteola),其分类单元为:细菌界(Bacteria);变形菌门(Proteobacteria);γ-变形杆菌纲(Gammaproteobacteria);假单胞菌目(Pseudomonadales);假单胞菌科(Pseudomonadaceae);假单胞菌属(Pseudomonas)。
B菌菌落呈白色,半透明,表面光滑水状,隆起,易挑起。F菌菌落较大,为白色,不透明,菌丝细长呈丝状交织,不规则,隆起,易挑起。J菌菌落呈淡黄色,表面较粗糙,不透明,隆起,不易挑起。有文献从农业土壤中发现两个假单胞菌具有γ-六氯环己烷降解能力[29],苍白杆菌属(Ochrobactrum)对有机氯农药DDT具有一定降解能力[30]。
3 结论
(1)从用于降解β-HCH的人工湿地美人蕉根际泥水混合物中筛选分离得到3株优势降解菌,经分子生物学鉴定分属于苍白杆菌属(Ochrobactrum)和假单胞菌属(Pseudomonas)。
(2)β-HCH质量浓度升高会显著抑制菌株的生长速率。
(3)菌株在对数生长期对β-HCH的降解率达到整个降解周期的峰值。
(4)培养基对β-HCH有一定程度的吸附作用,纯水中的β-HCH损失是光解和自然挥发所致。
(5)本试验中,复合菌群对β-HCH降解效果不理想。
本研究筛选出了较好耐药性的菌株,但是对于其对β-HCH的降解机理和降解产物并没有特别深入的研究。本研究结果可为实际工程应用提供基础数据支撑,为优化人工湿地系统,进一步提升人工湿地对β-HCH的降解能力提供技术参考。本文仅选取了一种HCHs的异构体进行研究,可以进一步进行对于其他异构体的研究,以便为人工湿地去除有机氯农药提供多种支持。
