豇豆贮藏期软腐病病原菌鉴定及其生物学特性研究
2021-06-15洪小雨李敏弓德强高兆银杨衍王义胡美姣
洪小雨 李敏 弓德强 高兆银 杨衍 王义 胡美姣

摘 要:豇豆是海南最主要的冬季瓜菜之一。2019年,调查发现豇豆贮运期间出现一种严重的软腐病。通过病原菌分离、致病性测定、形态学观察和分子生物学鉴定,鉴定该病原菌为瓜果腐霉[Pythium aphanidermatum (Edson) Fitzp.]。采用生長速率法对该病原菌生物学特性进行初步研究。结果表明:该菌菌落适宜生长温度范围为30~35 ℃,最适生长温度为35 ℃,菌落致死温度为50 ℃、10 min;适宜生长的pH为7.0~9.0,最适pH为9.0;最适碳源为可溶性淀粉;最适氮源为蛋白胨;不同光照条件对菌落生长没有显著影响。本研究首次报道瓜果腐霉(P. aphanidermatum)引起豇豆的采后病害。
关键词:豇豆;瓜果腐霉;鉴定;贮藏期;生物学特性
中图分类号:S643.4;S435.2 文献标识码:A
Identification and Biological Characteristics of the Pathogen Causing Postharvest Decay of Cowpea
HONG Xiaoyu1, LI Min1, GONG Deqiang1, GAO Zhaoyin1, YANG Yan2, WANG Yi3, HU Meijiao1*
1. Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Integrated Pest Management on Tropical Crops, Ministry of Agriculture and Rural Affairs, Haikou, Hainan 571101, China; 2. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China; 3. School of Life and Pharmaceutical Sciences, Hainan University, Haikou, Hainan 570228, China.
Abstract: Cowpea is one of the most important winter vegetables in Hainan. The postharvest decay was occasionally found during storage of cowpea in 2019. The pathogen was confirmed to be Pythium aphanidermatum (Edson) Fitzp. based on cultural features, pathogenicity, morphological characteristics and molecular identification. In this study, the biological characteristics of P. aphanidermatum were preliminarily studied by the mycelium growth rate method. The results showed that the suitable temperature was 30 ℃ to 35 ℃, and the optimum temperature was 35 ℃. The lethal temperature was 50 ℃ for 10 min. The suitable pH value was 7.0 to 9.0, and the optimum pH value was 9.0. The optimal carbon source and nitrogen source were starch and peptone, respectively. Different light had no effect on the colony growth. To our knowledge, this is the first report of P. aphanidermatum caused postharvest decay of cowpea in China.
Keywords: cowpea; Pythium aphanidermatum; identify; storage; biological characteristics
DOI: 10.3969/j.issn.1000-2561.2021.04.028
豇豆(Vigna unguiculata)是豆科豇豆属的耐热性蔬菜[1],为海南最主要的冬季瓜菜之一。由于海南气候炎热,田间病虫害发生严重,对豇豆产量和农民经济收入造成严重影响。目前,对豇豆田间病害有较多报道,Adegbite等[2]报道瓜果腐霉(Pythium aphanidermatum)可引起豇豆苗期茎腐,造成严重减产;Falade等[3]和Smith等[4]研究发现炭疽菌(Colletotrichum dematium)可侵染豇豆根部,引起植株倒伏,致使豇豆产量下降;毛勇等[5]也在调查中发现瓜果腐霉(P. aphanidermatum)可引起豇豆茎腐;司凤举等[6]发现豆类煤污尾孢菌(Cercospora vignae)可引起豇豆叶片逐渐变黄、脱落,致使植株早衰,采收期缩短,鲜荚产量降低;程晓东[7]在研究中发现豇豆单孢锈菌(Uromyces vignae)可引起豇豆植株发生锈病,导致植株中后期叶片枯黄脱落,有时还引起豆荚病变,严重时植株体内水分大量流失。Emechebe[8]和Suleiman[9]发现瓜果腐霉是豇豆苗期最重要的病原菌,可造成豇豆幼苗茎基和根部快速腐烂软化,从而导致豇豆幼苗大面积死亡。然而迄今,豇豆贮藏期病害鲜有报道。2019年,笔者在豇豆贮藏期间发现一种病害,其在豇豆贮藏期传染迅速,造成较大的经济损失。笔者通过分离纯化、致病性测定、形态学观察和分子生物学鉴定,在确定该病原菌的基础上进一步研究了该病原菌生物学特性,以期为更好防治豇豆贮藏期病害提供参考。
1 材料与方法
1.1 材料
供试材料为购自海南省三亚市崖州区蔬菜批发市场,经采后处理并装箱待运输的健康豇豆。
1.2 方法
1.2.1 癥状观察 将采购回来的豇豆,常温贮藏定期观察发病情况。
1.2.2 病原菌的分离 采用组织分离法,在豇豆病健交界处剪取约0.5 cm×0.5 cm大小的组织,先用0.1%升汞酒精浸洗15 s,无菌水冲洗3次,然后移接至PDA平板上,20 h后自菌落边缘挑取菌丝分离纯化,菌株命名为JD-1,保存备用。
1.2.3 致病性及寄主范围测定 果实:挑选豇豆、黄瓜、马铃薯、茄子和番茄果实,同种大小相似,外形良好的果实置于保鲜盒中,分别采用刺伤接种和无刺伤接种法,将活化菌饼(Φ=5.0 mm)接在果实上,以接种无菌PDA圆块作为对照,并用无菌脱脂棉保湿。24 h后移走脱脂棉,定期观察其发病情况,拍照并记录发病症状。
幼苗:豇豆苗和番茄苗置于保鲜盒中,分别采用刺伤接种法和无刺伤接种法,将活化菌饼(Φ=5.0 mm)接于茎基处,以接种无菌PDA圆块作为对照,并用无菌脱脂棉保湿。24 h后移走脱脂棉,定期观察其发病情况,拍照并记录发病症状。
1.2.4 形态学鉴定 将纯化菌株接于PDA平板中央,置于28 ℃恒温培养箱中,观察菌落形态特征。
孢子囊诱导:将活化后的菌株接在豇豆上,待其长满白色绒毛状菌丝体,直接镜检观察孢子囊形态,测量孢子囊大小。
有性器官诱导:将活化菌丝接在马铃薯琼脂培养基(PDA)上,28 ℃培养1个月,镜检观察卵孢子形态,测量卵孢子大小。
1.2.5 分子生物学鉴定 采用CTAB法提取病原菌DNA,利用不同的引物序列(表1)分别对提取的基因组DNA分别进行PCR扩增[10-11],引物由北京六合华大基因科技有限公司武汉分公司合成。PCR反应体系为10×Taq buffer 3 μL,10 mmol/L dNTP 2 μL,10 μmol/L正反引物各3 μL,模板DNA 1 μL,5 U/μL Taq DNA聚合酶0.2 μL,加ddH2O将反应体系补至30 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min,12 ℃保存。PCR扩增产物在1.0%琼脂糖凝胶电泳检测,送往北京六合华大基因科技有限公司武汉分公司测序。将测序所得序列经过分析,上传至Genbank数据库,获得登录号。通过BLAST进行同源性比对,下载5000条序列比对结果,筛选出ITS和COX1两种基因相似度较高的菌株序列,然后将两种基因序列首尾相连,形成ITS-COX1联合序列,通过MEGA 7.0软件进行联合拼接校正,并构建邻接法(neighbor- joining, NJ)系统进化树,重复1000次,进行聚类分析。
1.2.6 不同培养条件对菌落生长的影响 (1)温度对菌落生长的影响。将活化病原菌用打孔器(Φ=5.0 mm)打菌饼,接病原菌菌饼于9 cm的PDA平板中央,分别放在5、10、15、20、25、28、30、35、40、45 ℃恒温培养箱中,培养20 h,每个处理重复3次,采用十字交叉法测量菌落直径。
(2)菌落致死温度的测定。将恒温水浴锅温度设置为40、45、50、55 ℃共4个温度梯度,将菌饼移入预热好的装有2 mL无菌水的试管中,分别加热10、20、30 min,迅速冷却,菌饼接种于PDA平板中央,每个处理重复3次,于35 ℃恒温培养20 h,观察菌落生长情况。
(3)pH对菌落生长的影响。用1.0 mol/L HCl和1.0 mol/L NaOH,将已灭菌的PDA培养基pH分别调至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0共计10个梯度,接种菌饼于不同pH培养基的平板中央,其余方法同1.2.6(1)。
(4)碳源对菌落生长的影响。以查氏(Czapek)培养基为基础培养基,分别以等质量的木糖、麦芽糖、果糖、乳糖、葡萄糖、纤维素、可溶性淀粉替代蔗糖配成不同碳源培养基,以不加碳源的查氏培养基作为对照,接种菌饼于不同碳源培养基的平板中央,其余方法同1.2.6(1)。
(5)氮源对菌落生长的影响。以查氏(Czapek)培养基为基础,分别以等质量的硫酸铵、氯化铵、脲、蛋白胨、酵母粉、丙氨酸、甘氨酸、缬氨酸替代硝酸钠配成不同氮源培养基,以不加氮源的查氏培养基作为对照,接种菌饼于不同氮源培养基的平板中央,其余方法同1.2.6(1)。
(6)光照对菌落生长的影响。接菌饼于PDA平板中央,分别进行全光照、10 h光照+10 h黑暗、10 h黑暗+10 h光照、全黑暗,其余方法同1.2.6(1)。
1.3 数据处理
采用Microsoft Office 2007软件进行数据整理分析,运用SPSS 17.0软件计算标准误和进行显著性分析。
2 结果与分析
2.1 症状分析
发病初期豇豆豆荚出现褐色水渍状病斑,略凹陷,病部有少量白色绒毛状菌丝体附着,病情扩展迅速,48 h后病部表面被浓密的菌丝体完全覆盖(图1A),严重时整箱豇豆变软腐烂(图1B)。
2.2 致病力及寄主范围测定
刺伤接种后,豇豆、黄瓜、茄子、番茄和马铃薯均发病,发病初期刺伤部位出现浅褐色水渍状病斑,表面有稀疏的白色菌丝体,48 h后,病部被致密的白色菌丝体覆盖;马铃薯感病初期症状较轻,表现为轻微水渍状病斑,表面有稀疏的白色菌丝体,但后期整个快速变软腐烂并有臭味。其中接种发病症状与初期观察到的豇豆腐烂症状一致。未刺伤接种处理和对照组均无症状(图2)。
豇豆苗和番茄苗茎基刺伤接种后均发病,24 h出现暗绿色水浸状病斑,自病部向上快速发病,48 h后整株植物倒伏,表面有绒毛状菌丝层附着,刺伤处略内陷。未刺伤接种处理无症状,对照均无症状(图2)。
2.3 形态学鉴定
将豇豆豆荚上分离出的病原菌进行接种,并重新分离纯化,症状与原培养菌株形态一致。该菌在豇豆病豆荚上产生大量的白色絮状菌丝,有分支、无分隔;菌丝顶生或间生棒状、姜瓣状的孢子囊,大小为15.1 ?m×65.2 ?m;在PDA平板上菌落生长迅速,白色絮状,气生菌丝茂密;黑暗培养30 d后产生卵孢子,卵孢子光滑球形,顶生,有直柄,不满器,直径大小为18.00~18.65 ?m。其形态与陈秀贤[12]、Calvano等[13]、Hashem[14]、徐作珽等[15]和付岗等[16]描述的瓜果腐霉形态相似(图3),初步确定该菌为腐霉属(Pythium sp.)。
2.4 分子生物学鉴定
病原菌株经过rDNA-ITS测定获得828 bp片段,特异性引物(COX1)测序获得1115 bp片段,将其分别上传到NCBI,获得登录号分别为MN911297和MN935645。在GenBank中进行BLAST比对,同源性与P. aphanidermatum达到100%。将ITS序列和COX1基因序列进行联合拼接,通过MEGA 7.0软件进行聚类分析,发现该菌株与瓜果腐霉聚为一支。
通过形态学观察,结合ITS-COX1基因序列联合发育树分析,确定引起豇豆贮藏期腐烂的病原菌为瓜果腐霉(P. aphanidermatum)(图4)。
2.5 不同培养条件对菌落生长的影响
2.5.1 不同温度对菌落生长的影响 试验结果表明,该菌在15~40 ℃范围内均能生长;适宜生长温度为30~35 ℃,并在35 ℃时生长最快,20 h菌落直径为6.1 cm,菌丝体厚实致密,30 ℃生长良好,直径达5.6 cm。但是在5~10 ℃范围内不生长,说明该菌适合在高温生长(图5)。
菌丝致死温度的测定结果表明,在水温≤45 ℃,处理10~30 min,菌落均能生长,而温度在≥50 ℃,处理10 min时,菌落不再生长,表明病菌的致死温度为50 ℃,处理10 min(表2)。
2.5.2 不同pH对菌落生长的影响 试驗结果表明,该菌在pH为5.0~12.0范围内均能生长,适宜pH范围为7.0~9.0,菌落生长较快,气生菌丝发达,致密。在pH为3.0~4.0时,菌落不生长;随着pH增加,菌落直径越来越大;当pH为9时,菌落直径达最大;pH继续增大,菌落直径逐渐减小。说明该菌适合中性偏碱的条件生长(图6)。
2.5.3 不同碳源对菌落生长的影响 试验结果表明,该菌在不同碳源培养基上的生长速率差异较大,在可溶性淀粉培养基生长最快,菌落直径极显著高于其他碳源的培养基,20 h直径达6.2 cm,开始菌丝比较稀薄,3 d后厚实致密。其次在含蔗糖的培养基上生长较好,直径达5.6 cm,再次为在含纤维素、葡萄糖和乳糖的培养基,在含果糖的培养基上生长最差,而在含木糖和麦芽糖的培养基上不生长,在无碳条件下菌落生长较大,直径达5.1 cm,但是菌丝一直稀疏(图7)。
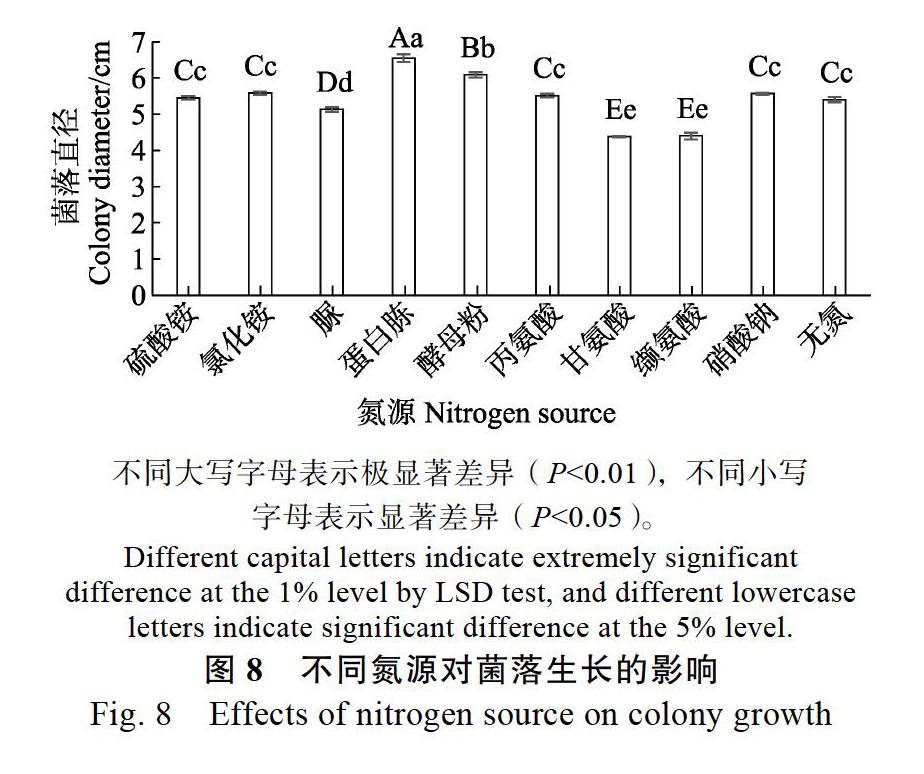
2.5.4 不同氮源对菌落生长的影响 试验结果表明,该菌在含有不同氮源培养基上均能生长,在含蛋白胨培养基上生长最好,菌丝最茂密,20 h菌落直径达6.6 cm,极显著高于其他氮源培养基;其次为含酵母粉的培养基,菌落直径为6.1 cm;在含甘氨酸和缬氨酸的培养基上生长较差,直径为4.4 cm;在无氮培养基上菌落生长较快,但菌丝稀疏(图8)。
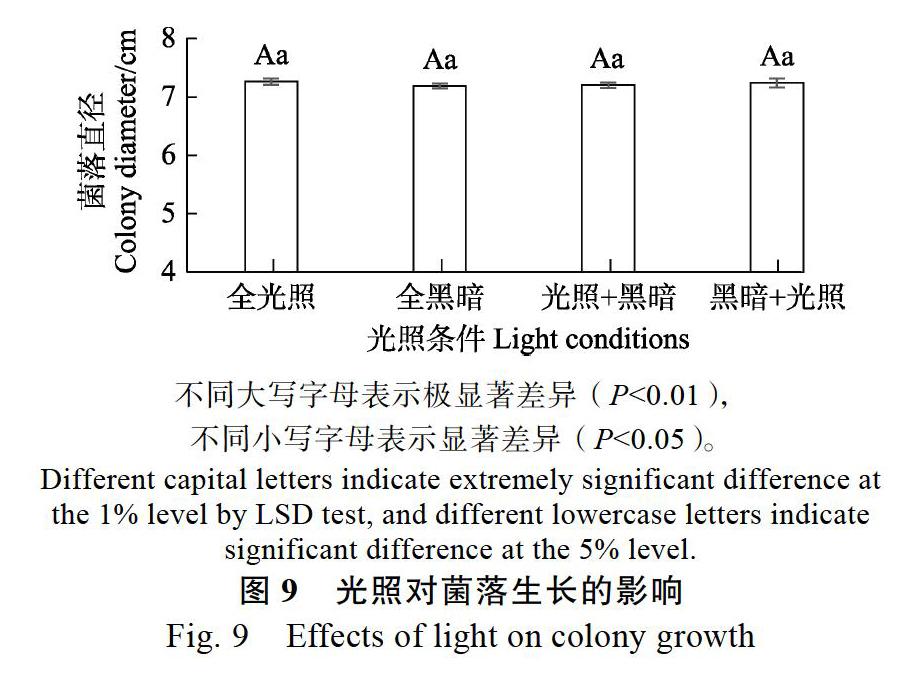
2.5.5 不同光照对菌落生长的影响 试验结果表明,全光照、全黑暗、10 h光照+10 h黑暗、10 h黑暗+10 h光照处理菌落均生长,各处理间的菌落大小没有显著差异(图9)。
3 讨论
腐霉属自1858年被提出,至今在世界各地报道的约有100多种[17],中国对于腐霉的研究始于Yu [18]1934年首次报道了第1个腐霉种——瓜果腐霉引起的黄瓜猝倒病。此后有大量报道表明该腐霉菌可引起寄主植物茎腐和根腐[19-21],严重时可导致幼苗大面积枯死腐烂,导致农作物减产,对当地经济产生一定影响。腐霉属种类较多,形态多样,一般可通过其孢子囊、雄器和卵孢子是否满器等形态进行初步区分,陈秀贤[12]研究发现瓜果腐霉与德里腐霉(P. deliense)形态相似,二者均有姜瓣状孢子囊和不满器的卵孢子,但是瓜果腐霉藏卵器柄较直,雄器较大,同丝生或异丝生,而德里腐霉(P. deliense)柄普遍弯向雄器,雄器较小,多为同丝生。这2种腐霉通过形态学观察很难完全区别,因此采用分子生物学技术作为辅助鉴定方法不可或缺[22]。本研究在形态学观察基础上,结合分子生物学手段,确定引起贮藏期豇豆腐烂病的病原菌为瓜果腐霉。
瓜果腐霉除引起多种植物的茎腐和根腐外,还引起葫芦科果实[23]、茄子[24]、番茄[25]、四季豆[26]、丝瓜[27]、生姜[28]、芋[29]等的采后腐烂。而该菌引起贮藏期豇豆腐烂病则为首次报道。
Thomson等[30]研究结果表明,瓜果腐霉菌丝在24~37 ℃最易侵染大豆;古丽君等[31]指出该菌最佳温度为30~35 ℃,最适pH为7.0~8.0,最适碳源为淀粉,最适氮源为脲,黑暗条件有利于对菌落生长;毛勇等[5]研究结果表明该菌最适碳源和氮源分别是淀粉和磷酸氢二铵;刘志恒等[32]认为该菌在温度为35 ℃和pH为6.0~8.0时生长最快,光照对菌丝生长影响较小;菌丝致死温度为51 ℃,处理10 min。而本研究与上述结论略存在差异,即不同光照条件对瓜果腐霉没有影响,最适氮源为蛋白胨;此外该菌在温度范围为15~40 ℃均能生长,最佳温度为30~35 ℃,这结果与古丽君等[31]的结果基本一致。海南岛地处热带北缘,四季如夏,平均气温为22.4~25.5 ℃[33],冬季平均温度亦在18~25 ℃之间。冬季高温有利于瓜果腐霉快速生长,为豇豆腐烂病的发生提供了条件。
此外瓜果腐霉主要通过伤口侵染[5],在运输过程中减少机械伤是避免腐烂病的关键。目前海南冬季豇豆北运多采用泡沫箱加冰水进行低温贮运,有利于豇豆保鲜的同时抑制病原菌扩展。但仍需在采摘、清洗、包装及销售环节减少机械伤害和温度升高,从而避免和降低贮运期间豇豆腐烂病的发生。
参考文献
[1]罗金梅, 张忠武, 孙信成, 等. 豇豆种子水引发研究[J]. 农学学报, 2019, 9(9): 45-48.
[2]Adegbite A A, Amusa N A. The major economic field diseases of cowpea in the humid agro-ecologies of south-western Nigeria[J]. Archives of Phytopathology and Plant Protection, 2010, 43(16): 1608-1618.
[3]Falade M, Enikuomehin O A, Borisade O, et al. Control of cowpea (Vigna unguiculata L. Walp) diseases with intercropping of maize (Zea mays L.) and spray of plant extracts[J]. Journal of Advances in Microbiology, 2018, 7(4): 1-10.
[4]Smith J E, Aveling T A S. Colletotrichum dematium: Causal agent of a new cowpea stem disease in South Africa[J]. Plant Disease, 1997, 81(7): 832-832.
[5]毛 勇, 譚志琼, 阮云泽, 等. 豇豆茎基腐烂病病原鉴定及其生物学特性[J]. 中国农学通报, 2011, 27(16): 172-175.
[6]司凤举, 司 越. 豇豆煤霉病的发生与防治[J]. 长江蔬菜, 2006(7): 35, 68.
[7]程晓东. 丽水地区豇豆主要病虫害发生的监测预报和综合防治技术研究[D]. 武汉: 华中农业大学, 2008.
[8]Emechebe A M. Scab disease of cowpea (Vigna unguiculata) caused by Sphaceloma a species of the fungus[J]. Annals of Applied Biology, 2010, 96(1): 11-16.
[9]Suleiman M N. Occurrence of Pythium aphanidermatum on cowpea (Vigna unguiculata (L.) Walp) in Nigeria[J]. Journal of Applied Biosciences, 2010, 26: 1659-1663.
[10]楼兵干, 张炳欣. 基于rDNA ITS序列探讨部分腐霉种的系统发育与其形态特征[J]. 菌物学报, 2005, 24(2): 207-220.
[11]Long Y Y, Wei J G, Sun X, et al. Two new Pythium species from China based on themorphology and DNA sequence data[J]. Mycological Progress, 2012, 11(3): 689-698.
[12]陈秀贤. 海南岛腐霉属菌物资源调查及种类鉴定[D]. 儋州: 华南热带农业大学, 2007.
[13]Calvano T P, Blatz P J, Vento T J, et al. Pythium aphanidermatum infection following Combat Trauma[J]. Journal of Clinical Microbiology, 2011, 49(10): 3710-3713.
[14]Hashem Al-Sheikh. Two pathogenic species of Pythium: P. aphanidermatum and P. diclinum from a wheat field[J]. Saudi Journal of Biological Sciences, 2010, 17(4): 347-352.
[15]徐作珽, 张传模. 山东玉米茎基腐病病原菌的初步研究[J]. 植物病理学报, 1985(2): 103-108.
[16]付 岗, 赖传雅, 袁高庆, 等. 广西北部地区腐霉种类和地理分布研究[J]. 菌物学报, 2005, 24(3): 330-335.
[17]Ainsworth G C, Bisby G R, Beal J M. A dictionary of the fungi[M]. The Commonwealth Mycological Institute, 1954.
[18]Yu T F. Pythium damping-off of cucumber[J]. Agricultura Sinical, 1934(1): 91-106.
[19]赵思峰, 方许阳, 姜海荣, 等. 新疆加工番茄腐霉根腐病病原鉴定及其rDNA的ITS区段分析[J]. 植物保护学报, 2009, 36(3): 219-224.
[20]徐作珽, 张传模. 山东玉米茎基腐病病原菌的初步研究[J]. 植物病理学报, 1985(2): 41-46, 68.
[21]周 黎. 新疆加工番茄根腐病的病原鉴定和防治[D]. 石河子: 石河子大学, 2007.
[22]甘辉林, 柴兆祥, 楼兵干, 等. 中国腐霉新记录种Pythium heterothallicum的分离鉴定及致病性测定[J]. 菌物学报, 2010, 29(4): 494-501.
[23]Sharma B B, Wahab S. Efficacy of acti-dione and aureofungin in the control of post-harvest decay of some cucurbitaceous fruits due to Pythium apharnidermatum[J]. Hindustan Antibiotics Bulletin, 1970, 13(1): 8-13.
[24]Abou-Heilah A N. Postharvest fungal diseases of some vegetables in the two main markets of Riyadh (Saudi Arabia)[J]. Journal of the University of Kuwait Science, 1985, 12(1): 103-112.
[25]習 柳, 田世平. 酵母拮抗菌与碳酸氢钠配合对番茄果实采后病害的防治效果研究[J]. 中国农业科学, 2005(5): 950-955.
[26]Abdel-Mageed M H, Mohamed F G, Soltan H H, et al. Potential effect of plant essential oils as antifungal activity against postharvest decay of snap bean pods[J]. J Biol Chem Environ Sci, 2014, 9(4): 467- 487.
[27]Atm Prakash Patel, Ved Ratan, Abhishek Mishra, et al. Evaluation of plant extracts against Pythium aphanidermatum causing fruit rot disease in Sponge Gourd[J]. Annals of Plant Protection Sciences, 2016, 24(1): 187-189.
[28]Overy D P, Frisvad J C. Mycotoxin production and postharvest storage rot of ginger (Zingiber officinale) by Penicillium brevicompactum[J]. Journal of Food Protection, 2005, 68(3): 607-609.
[29]Ezeibekwe I O, Umeoka N, Izuka C M. Field Survey of Symptoms and isolation of fungi associated with post-harvest rots of white yam (Dioscorea rotundata Poir.)[J]. Journal of Food Processing & Technology, 2016, 7(12): 1-4.
[30]Thomson T B, Athow K L, Laviolette F A. The effect of temperature on the pathogenicity of Pythium aphanidermatum, P. debaryanum, and P. ultimum on soybean[J]. Phytopathology, 1971, 61(8): 933-935.
[31]古丽君, 徐秉良, 李 彬, 等. 草坪禾草根腐病病原菌生物学特性研究[J]. 草业学报, 2012, 21(3): 93-98.
[32]刘志恒, 滕晓菲, 侯 悦, 等. 西瓜绵腐病菌生物学特性研究[J]. 植物保护, 2013, 39(3): 83-88.
[33]杜公福. 海南省冬季蔬菜病原真菌鉴定与生物学特性研究[D]. 重庆: 西南大学, 2012.
责任编辑:沈德发
