逆境信号下木薯MeMYC2转录因子表达及功能分析
2021-06-15于晓玲郭鑫李淑霞阮孟斌彭明
于晓玲 郭鑫 李淑霞 阮孟斌 彭明


摘 要:MYC2是茉莉酸信号途径中的关键节点基因,在植物生长发育及逆境信号响应过程中发挥重要作用。本研究基于木薯基因组数据库序列,以木薯‘cv. 60444品种为材料,采用RT-PCR方法同源克隆得到MYC2基因(数据库No. Manes.17G016000),命名为MeMYC2.1。MeMYC2.1基因开放阅读框(ORF)全长2055 bp,无内含子,氨基酸序列中包含典型的bHLH保守结构域;序列比对分析发现MeMYC2与蓖麻MYC2具有较高同源性。外源施加植物激素水杨酸(SA)、茉莉酸甲酯(MeJA)、过氧化氢(H2O2)以及低温胁迫下,木薯葉片中MeMYC2.1的表达被显著诱导。进一步克隆获得MeMYC2.1基因上游1500 bp启动子序列,利用在线数据库PlantCare分析发现,MeMYC2.1启动子序列中不仅含有响应茉莉酸的顺式元件CGTCA/TGACG,还含有低温响应元件LTR及ABA响应元件ABRE。以上研究结果表明,MeMYC2.1可能是植物激素茉莉酸(JA)、脱落酸(ABA)响应低温物胁迫分子网络中的一个节点基因,对其功能的深入研究将有助于探讨JAs在植物低温胁迫应答中的作用机制。
关键词:木薯;MeMYC2;逆境信号;茉莉酸;低温胁迫
中图分类号:S533 文献标识码:A
Expression Analysis of MeMYC2 Transcription Factor in Cassava under Stress Signal
YU Xiaoling, GUO Xin, LI Shuxia, RUAN Mengbin, PENG Ming*
Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Science / Hainan Academy of Tropical Agricultural Resource, Haikou, Hainan 571101, China
Abstract: MYC2 TFs is a key node member in Jasmonic acid (JA) signaling pathway, which plays an important role in plant growth, development and response to stress signals. In this study, according to the homologous similarity to AtMYC2 protein sequence, the MYC2 gene (No. Manes.17G016000) was cloned from cassava ‘cv. 60444 cultivar, named as MeMYC2.1. The characteristics of MeMYC2 protein was analyzed using bioinformatics, it encodes 2055 bp open reading frame (ORF) without introns. The N-terminal domain of MeMYC2.1 protein contain a conservative bHLH domain. According to the phylogenetic tree analysis of MYC2, the MeMYC2.1 has high homology with Ricinuscommunis. Under different abiotic stress (exogenous SA/MeJA and low-temperature (4 ℃)/H2O2), the expression pattern of MeMYC2.1 in leaf was analyzed using qRT-PCR. The results showed that the expression of MeMYC2.1was significantlyinduced in leaves under exogenous MeJA/SA/Cold/H2O2 stress. A 1500 bp sequence located in MeMYC2.1 promoter was obtained. PlantCare analysis indicates that MeMYC2.1 promoter sequence contains not only CGTCA/TGACG elements in response to Jasmonic acid but also some stress-defense related elements like LTR, ABRE et al cis-elements. Together, these results indicate that MeMYC2.1 might be a node gene in the molecular interactive network of different phytohormone response to abiotic stress, which contributes to understanding plant resisting abiotic stress through JAs signaling pathway.
Keywords: cassava; MeMYC2; stress signals; JA; low-temperature stress
DOI: 10.3969/j.issn.1000-2561.2021.04.003
起源于南美洲的木薯(Manihot esculenta Cra ntz)是热区(尤其非洲地区)主要的块根粮食作物,生产过程中表现出明显的抗旱、耐贫瘠、对低温敏感的特性。低温条件下木薯发育迟缓、毒性物质累积,其品质、产量受到很大的影响[1]。增强木薯对低温的耐受性,对木薯产业发展具有重要作用。
目前国内外对木薯低温响应的研究主要集中在低温下游功能基因的表达对植株耐低温的影响,如苯丙胺代谢途径关键基因(苯丙胺酸解氨酶PAL)的克隆与分析[1];SAD硬酯酞脱-ACP脱饱和酶促進膜脂不饱和脂肪酸的含量[2];ROS清除相关MeCu/ZnSOD和MeCAT1过表达株系对低温表现为显著的耐受性[3]。另外,转录因子对木薯生长发育的影响方面已有一定的研究,如转录因子CBF在木薯中过表达,可增强木薯对低温的耐受[4];植物特异bHLH转录因子家族成员[Teosinte Branched/Cycloidea/PCF(TCP)]在拟南芥中过表达,可诱导ROS途径相关基因的表达增强转基因植株对低温的耐受[5];干扰木薯MYB2的表达也可提高木薯转基因植株对低温的耐受[6]。
植物激素在植物响应环境胁迫中起着重要的作用[7],参与冷胁迫的激素主要包括脱落酸(absc isic acid,ABA)、乙烯(ethylene,ETH)、茉莉酸类物质(jasmonate,JAs)、赤霉素(gibberellins,GAs)等。茉莉酸(jasmonic acid,JA)与茉莉酸甲酯(methyl jasmonate,MeJA)等衍生物统称为JAs,是植物激素中的重要成员。现研究表明JAs不仅广泛参与光合作用、各组织器官的发育[8]、调控植物的生长发育,同时作为脂肪酸衍生物的MeJA可作为内源信号分子调节植物防御外来侵害,对干旱[9]、高盐[10]等环境胁迫也有重要作用。由于MeJA能够抑制膜脂组分的变化,降低膜透性[11],生产中,人们用MeJA做保鲜剂和冷害保护剂,在西红柿[12]、黄瓜[13]、水蜜桃[14-15]、柠檬[16]、石榴[17]等作物中已得到应用。同时,JAs可以通过与其他激素如ABA、水杨酸(salicylic acid,SA)等或转录因子(transcription factors,TFs)间的互作完成发育过程的调控,而其中多涉及MYC2转录因子[18]。
木薯受低温胁迫过程中茉莉酸发挥着怎样的作用,目前尚无详细报道。本研究通过克隆木薯MYC2基因,分析其在不同逆境胁迫下的表达差异,可为阐述木薯MYC2参与非生物胁迫的生物学功能提供理论依据。
1 材料与方法
1.1 材料
本实验在中国热带农业科学院热带生物技术研究所实验室进行,所用植物材料为木薯‘cv. 60444。以pCAMBIA1300-35S::GFP为基因表达载体。主要试剂:植物总RNA提取/反转录试剂盒(天根)、植物DNA提取试剂盒(天根)、DNA回收纯化试剂盒(艾德莱)、平末端克隆试剂盒(天根)、荧光定量PCR反应试剂(大连宝生物)。主要仪器设备:GEL DOC.XR凝胶成像系统(BIO-RAD,美国)、DYY-4C电泳仪(北京六一)、5804R离心机(Eppendorf,美国)、Mastercyclernexus PCR仪(Eppendorf,德国)、Stepone plus荧光定量PCR仪(ABI,美国)。
1.2 方法
木薯盆栽苗种植于中国热带农业科学院热带生物技术研究所实验大棚中,栽培基质采用营养土/蛭石=1∶1(体积比)。待苗长至高1 m左右时,进行以下胁迫处理:100 mol/L MeJA、5 mmol/L水杨酸甲酯(Salicylate,SA)、100 mol/L ABA、10 mmol/L H2O2以及冷害(4 ℃)处理1、3、6、12 h,以未经胁迫处理的木薯植株作为对照(CK),每个处理设置3次生物学重复。取其顶端伸展叶片,液氮速冻后?80 ℃保存备用。
1.2.1 MeMYC2基因的克隆 采用天根植物RNA提取试剂盒(DP441)提取木薯叶片总RNA,利用FastKing RT kit(KR116)将提取的总RNA反转录获得cDNA。基于拟南芥MYC2基因序列特征,通过在木薯基因组数据库(https://phy to z o me.jgi.doe.gov/pz/portal.html#!search?show=BL A ST)搜索MYC2同源基因。利用TaKaRa高保真酶(R045),以木薯DNA/cDNA为模板,以特异性引物PCR克隆木薯MeMYC2基因序列。PCR反应程序:98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸10 s,共计35个循环。PCR产物通过1.2%琼脂糖凝胶电泳回收纯化、与T载体连接后转化大肠杆菌DH5;经菌落PCR及酶切鉴定为阳性克隆的送往生工生物工程(上海)股份有限公司进行测序。所用引物及其序列见表1,下划线表示酶切位点。
1.2.2 MeMYC2基因生物信息学分析 利用生物信息学在线分析软件ProtParam(http://web.expasy. org/protparam)预测MeMYC2.1蛋白理化性质,TMHMM 2.0 Server(http://www.-cbs.dtu.dk/ser vices/TMHMM)预测蛋白跨膜结构,SignalP (http://www.cbs.dtu.dk/services/SignalP)预测蛋白的信号肽,Plant-mPLoc软件预测其亚细胞定位;NCBI(https://www.ncbi.nlm.nih.gov/Structure/ cdd/wrpsb.cgi)预测蛋白功能结构域,Swiss- Model在线分析软件(https://www.swissmodel. expasy.org/interactive/d697dL/models/)预测三级结构;采用MEGA 7.0软件构建不同物种MYC2蛋白序列的系统进化树。
1.2.3 MeMYC2基因表达谱分析 分别提取不同处理下木薯叶片RNA,进而反转录成cDNA,再以稀释20倍的cDNA为模板进行实时定量PCR反应。以木薯看家基因Actin为内参基因,对木薯MeMYC2.1进行相对表达量分析。每个样品设置3个技术重复。定量PCR试剂采用TB Green Premix Ex TaqTM (TliRNaseH Plus,TaKaRa-RR820A),利用ABI stepone plus定量PCR仪完成实验。数据分析采用2CT法计算目的基因的相对表达量。
1.2.4 MeMYC2基因启动子的克隆与分析 以天根DNA提取试剂盒(DP305)获得木薯DNA。利用TaKaRa高保真酶(R045),以DNA为模板克隆木薯MeMYC2.1基因上游启动子序列,通过凝胶回收纯化、与T载体连接后转化大肠杆菌DH5α;经菌落PCR及酶切鉴定为阳性克隆的送往生工生物工程(上海)股份有限公司进行测序。所用引物及其序列如表1所示。采用在线数据库(http://bioin formatics, psb.ugent.be/webtools/pla n tc are)对获得的启动子序列进行顺式作用元件分析。
2 结果与分析
2.1 目标基因的选择
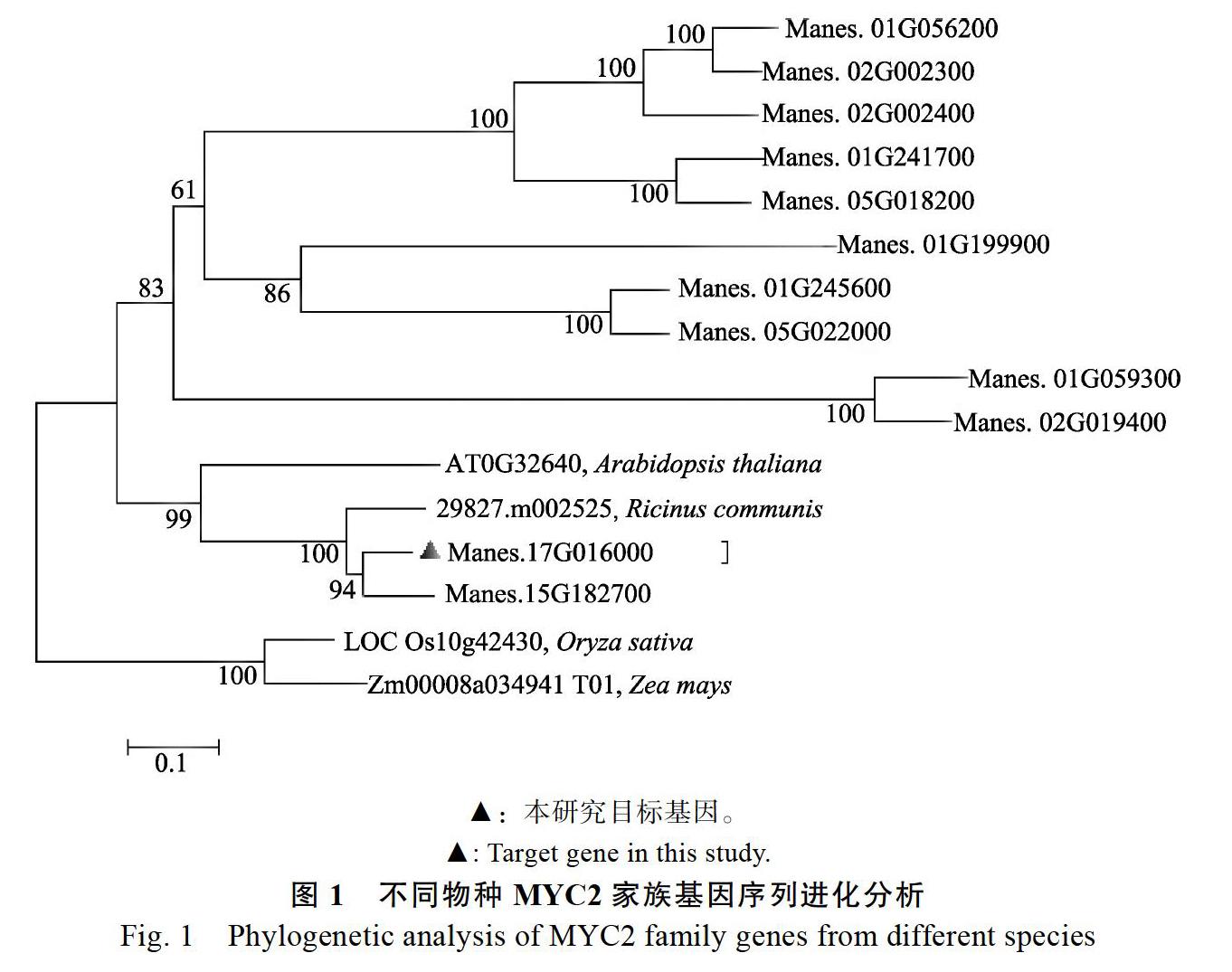
通过搜索Phytozome数据库,获得12个木薯MYC2相似基因,经过Blast数据比对,结合相关文献查阅,筛选出蓖麻(29827.m002528, Ricinus communis L.)、拟南芥(AT1G32640,Arabidopsis thaliana)、玉米(Zm00008a034941_T01,Zea mays)、水稻(LOC_Os10g42430,Oryza sativa)的MYC2基因序列,利用MEGA 7.0软件,结合Neighbor-Joining计算方法(Bootstrap值设置为1000),构建MeMYC2与其他物种(拟南芥、水稻、蓖麻、玉米)系统进化树。比对结果显示(图1),Manes.17G016000(命名为MeMYC2.1)和Manes.15G182700(命名为MeMYC2.2)与已报道的MYC2同源性最高;木薯MYC2与蓖麻MYC2的亲缘关系最近,其次是双子叶拟南芥,与单子叶植物水稻、玉米MYC2亲缘关系稍远;其他木薯MYC基因亲缘关系则较远。本研究选择MeMYC2.1作为目标基因进行研究。
2.2 MeMYC2.1克隆及序列分析
采用同位克隆的方法,根据Phytozome数据库中Manes.17G016000.1核酸序列,以木薯叶片基因组DNA及cDNA为模板,设计特异引物PCR扩增,获得一个具有2055 bp开放阅读框,684个氨基酸的序列(图2、图3B)。基因组DNA及cDNA来源的序列完全一致,证明该基因序列仅含有1个外显子,无内含子,将其命名为MeMYC2.1。
采用在线软件ProtParam理化性质预测MeMYC2.1蛋白质的分子量为75 043.89 Da,理论等电点(pI)为5.49,该蛋白因不包括任何Trp,这可能导致消光系数超过10%的计算误差;氨基酸N末端为A(Ala),估计其半衰期为4.4 h,不稳定指数为37.06,归类为稳定性蛋白;脂肪系数28.93,亲水系数为0.755。用Plant-mPLoc软件预测其亚细胞定位表明,该蛋白定位于细胞核;TMHMM 2.0 Server软件预测MeMYC2.1蛋白无跨膜区,为非膜蛋白;通过SignalP(http:// www.cbs.dtu.dk/services/SignalP/)在线查找信号肽,结果表明MYC2.1不存在信号肽序列,为非分泌蛋白。
利用NCBI-CDD数据库进行保守功能结构域(图3A)预测,结果表明该蛋白含有bHLH-MYC保守结构域(N69~250),及HLH DNA结合域(N505~556),表明克隆得到的基因为木薯MeMYC基因。利用在线软件SOPMA分析蛋白二级结构,结果显示MeMYC2.1蛋白结构中α-螺旋占31.73%,延伸链占11.84%,β-转角占1.46%,无规则卷曲占54.97%。通过SWIS-MODEL在线软件对MeMYC2.1蛋白进行三级结构分析(图3C),其N端主要由α-螺旋和β-折叠构成;C端主要由α-螺旋构成。预测N端5-243片段,为MYC3晶体结构,可与JAZ9结合位点(218~ 239 aa);C端α-螺旋PDB预测可能是MYC2转录因子DNA结合位点。此结果佐证了MeMYC2.1具有的典型HLH结构域,通过与JAZ互作参与JA信号途径。
2.3 不同胁迫条件下MeMYC2.1表达模式分析
qRT-PCR结果显示:受外施MeJA诱导,MeMYC2.1基因表达显著上调(图4A),在外施MeJA 1 h时,MeMYC2.1的表达量约为处理前(CK)40倍;H2O2(图4C)及冷害(4 ℃,图4D)胁迫时,MeMYC2.1基因受诱导表达上调。这说明木薯在JA信号通路上对低温敏感。总体来说,低温胁迫增强了JA信号途径中节点基因MYC2的转录活性,诱导JA参与抗低温生理效应。MeMYC2.1的表达也受外施SA(图4B)诱导,且呈逐渐增强趋势,到处理6 h时到达最高峰(约为处理前的25倍),随后回落。
2.4 MYC2.1启动子分析
获得MeMYC2.1基因5端1500 bp启动子区域,采用Plantcare在线软件进行分析。结果显示(图5),MeMYC2.1基因启动子具有丰富的常见順式作用元件,如TATA-box和CAAT-box,还具有与非生物胁迫逆境相关响应元件,如2个JA相关CGTCA、TGACG顺式元件,2个低温相关LTR元件,以及ABA应答元件ABRE和抗性元件W-box。预示着MeMYC2.1基因可能参与多重信号调控系统。
3 討论
植物在应对低温等环境胁迫时,JA信号途径
发挥着重要作用。目前对拟南芥JA信号转导途径的研究较为清晰,认为COI1-JAZ-MYC2复合体是其信号传导途径的核心元件[19]。正常情况下JAZ(Jasmonate ZIM-domain)阻遏蛋白与MYC2转录因子结合,阻遏了MYC2下游基因的转录;当植物接收外界刺激信号后,细胞内JA累积,与异亮氨酸形成JA-Ile结合物,激活SCFCOI1(Skpl/ Cullin1/F-box protein)受体,使COI1与JAZ阻遏蛋白结合,并将JAZ泛素化进而被26S蛋白酶体降解,从而释放MYC2,启动JA信号途径下游基因的转录[19-22]。因此,在整个JA信号通路中,MYC2是JA信号传导途径的核心调控元件。近年来,在拟南芥、番茄、烟草、长春花、丹参等多种植物中对MYC2基因进行了研究[23],在植物应答逆境刺激时起重要调控作用。
MYC2转录因子是bHLH家族成员之一,有bHLH保守结构域,可与DNA结合发挥作用[18];拟南芥MYC2定位于细胞核[19],本研究中MeMYC2.1序列具有典型bHLH类功能结构域,蛋白三级结构中,其C末端-螺旋PDB预测可能是MYC2转录因子DNA结合位点,结合核定位预测结果与已有MYC2基因特征相符,推测目标基因MeMYC2.1为MYC2基因家族成员。生物信息学分析结果显示,MeMYC2.1与蓖麻、拟南芥等MYC2具有很高的同源性,佐证了MeMYC2.1为MYC2基因家族成员。
MeMYC2.1蛋白N末端包含MYC3晶体结构可与JAZ9结合;且具有的典型HLH结构域,通过与JAZ互作参与JA信号途径。外源MeJA处理木薯叶片1 h后,MeMYC2.1的表达量即可飙升至制高点,因此MeMYC2.1可能是木薯JA信号途径的早期应答基因,这与番茄中MYC2的表达模式相符[24]。低温胁迫(4 ℃)也可诱导MeMYC2.1基因的上调表达,但其表达存在滞后,随着低温胁迫的加深缓慢上升。另外,本研究对MeMYC2.1基因上游启动子区顺式作用元件进行分析,也发现其具有JA信号相关CGTCA、TGACG顺式元件和低温相关LTR元件。综上所述,MeMYC2.1可能通过调控JA信号途径参与木薯逆境胁迫应答反应。MeMYC2.1受低温胁迫诱导表达在冷害24 h后表达量提高显著,这可能与低温胁迫下木薯体内JA的累积有关。MeMYC2.1基因具体如何参与木薯响应低温胁迫的过程,有待进一步实验证明。本研究团队已构建了MeMYC2.1过量表达和基因编辑载体,期望获得MeMYC2.1转基因植株,进行后续研究。
同时MYC2是茉莉酸通路与其他植物激素信号通路交互的关键节点[25]。已有研究显示:GA途径DELLA阻遏物和JAZ与MYC2相互作用以抑制花中倍半萜的生物合成[26];ABA促进其受体PYL6与MYC2的相互作用,并阻遏MYC2与靶启动子的结合[27];拟南芥MYC2可能在EDR1基因上游调控JA-SA的信号互作[28]。在本研究中,外施SA与MeJA皆可显著诱导MeMYC2.1上调表达,因此推测,MeMYC2.1在JA/SA信号途径中的协调作用是同向的。具体如何调控,有待后续深入研究。
参考文献
[1]吴远航, 刘 秦, 刘攀道, 等. 木薯苯丙氨酸解氨酶基因的克隆及其对低温胁迫的响应[J]. 热带作物学报, 2019, 40(3): 483-489.
[2]林 萍, 齐力旺, 汪阳东, 等. 植物抗寒工程中脂肪酸去饱和酶研究进展[J]. 分子植物育种, 2006, 4(3): 404-410.
[3]Xu J, Duan X, Yang J, et al. Coupled expression of Cu/Zn-superoxide dismutase and catalase in cassava improves tolerance against cold and drought stresses[J]. Plant Signaling and Behavior, 2013, 8(6): e24525.
[4]Dong A, Ma Q X, Wei Y, et al. Divergent regulation of CBF regulon on cold tolerance and plant phenotype in cassava overexpressing Arabidopsis CBF3 gene[J]. Frontiers in Plant Science, 2016, 7(64): 1866
[5]Cheng Z, Lei N, Li S, et al. The regulatory effects of MeTCP4 on cold stress tolerance in Arabidopsis thaliana: a transcriptome analysis[J]. Plant Physiology and Biochemistry, 2019, 138: 9-16.
[6]Ruan M B, Guo X, Wang B, et al. Genome-wide characterization and expression analysis enables identification of abiotic stress-responsive MYB transcription factors in cassava (Manihot esculenta)[J]. Journal of Experimental Botany, 2017, 68(13): 3657-3672.
[7]Hong J H, Seah S W, Xu J. The root of ABA action in environmental stress response[J]. Plant Cell Reports, 2013, 32(7): 971-983.
[8]Cheng Z, Sun L, Qi T, et al. The bHLH transcription factor MYC3 interacts with the Jasmonate ZIM-domain proteins to mediate jasmonate response in Arabidopsis[J]. Molecular Plant, 2011, 4(2): 279-288.
[9]Brossa R, López-Carbonell M, Jubany-Marí T, et al. Interplay between abscisic acid and jasmonic acid and its role in water-oxidative stress in wild-type, ABA-deficient, JA-deficient, and ascorbate-deficient Arabidopsis plants[J]. Journal of Plant Growth Regulation, 2011, 30(3): 322-333.
[10]Zhao Y, Dong W, Zhang N, et al. A wheat allene oxide cyclase gene enhances salinity tolerance via jasmonate signaling[J]. Plant Physiology, 2014, 164(2): 1068-1076.
[11]Turner J G, Ellis C, Devoto A. The jasmonate signal pathway[J]. Plant Cell, 2002, 14(Suppl 1): 153-164.
[12]Ding C K, Wang C E, Gross K C, et al. Jasmonate and salicylate induce the expression of pathogenesis-related-protein genes and increase resistance to chilling injury in tomato fruit[J]. Planta, 2002, 214(6): 895-901.
[13]韓 晋, 田世平. 外源茉莉酸甲酯对黄瓜采后冷害及生理生化的影响[J]. 园艺学报, 2006, 33(2): 289-293.
[14]韩 涛, 李丽萍. 外源水杨酸对冷藏桃果实的生理效应(简报)[J]. 植物生理学通讯, 2001, 37(3): 203-206.
[15]张红宇, 尹京苑, 万嗣宝. 水杨酸和茉莉酸甲酯处理对水蜜桃低温贮藏冷害的影响[J]. 食品工业, 2012, 33(10): 88-91.
[16]Siboza X I, Bertling I, Odindo A O. Salicylic acid and methyl jasmonate improve chilling tolerance in cold-stored lemon fruit (Citrus limon)[J]. Journal of Plant Physiology, 2014, 171(18): 1722-1731.
[17]Mirdehghan S H, Ghotbi F. Effects of salicylic acid, jasmonic acid, and calcium chloride on reducing chilling injury of pomegranate (Punica granatum L.) Fruit[J]. Journal of Agricultural Science and Technology, 2014, 16(1): 163-173.
[18]李 罡, 李文龙, 许雪梅, 等. MYC2转录因子参与植物发育调控的研究进展[J]. 植物生理学报, 2019, 55(2): 125-132.
[19]Chini A, Boter M, Solano R. Plant oxylipins: COI1/ JAZs/MYC2 as the core jasmonic acid-signalling module[J]. FEBS Journal, 2009, 276(17): 4682-4692.
[20]Balbi V, Devoto A. Jasmonate signalling network in Arabidopsis thaliana: crucial regulatory nodes and new physiological scenarios[J]. New Phytologist, 2008, 177(2): 301- 318.
[21]Sheard L B, Tan X, Mao H, et al. Jasmonate perception by inositol-phosphate-potentiated COI1-JAZ co-receptor[J]. Nature, 2010, 468(7322): 400-405.
[22]Ballaré C L. Jasmonate-induced defenses: a tale of intelligence, collaborators and rascals[J]. Trends in Plant Science, 2011, 16(5): 249-257.
[23]周文平, 王怀琴, 郭晓荣, 等. 丹参bHLH转录因子基因SmMYC2的克隆和表达分析[J]. 植物科学学报, 2016, 34(2): 246-254.
[24]Boter M, Ruíz-Rivero O, Abdeen A, et al. Conserved MYC transcription factors play a key role in jasmonate signaling both in tomato and Arabidopsis[J]. Genes and Development, 2004, 18(13): 1577-1591.
[25]Hu Y, Jiang Y, Han X, et al. Jasmonate regulates leaf senescence and tolerance to cold stress: crosstalk with other phytohormones[J]. Journal of Experimental Botany, 2017, 68(6): 1361-1369.
[26]Hong G J, Xue X Y, Mao Y B, et al. Arabidopsis MYC2 interacts with DELLA proteins in regulating sesquiterpene synthase gene expression[J]. Plant Cell, 2012, 24(6): 2635- 2648.
[27]Aleman F, Yazaki J, Lee M, et al. An ABA-increased interaction of the PYL6 ABA receptor with MYC2 transcription factor: a putative link of ABA and JA signaling[J]. Cell Reports, 2016, 6: 28941.
[28]Hiruma K, Nishiuchi T, Kato T, et al. Arabidopsis ENHANCED DISEASE RESISTANCE 1 is required for pathogen-induced expression of plant defensins in nonhost resistance, and acts through interference of MYC2-mediated repressor function[J]. Plant Journal, 2011, 67(6): 980-992.
責任编辑:黄东杰
