黑喉石斛DoFT1基因在花发育过程中的表达模式分析及功能验证
2021-06-15杜致辉杨澜姚新转陈之林
杜致辉 杨澜 姚新转 陈之林

摘 要:FT(FLOWERING LOCUS T)基因是植物開花调控过程中的关键整合基因。为探明黑喉石斛(Dendrobium ochreatum)FT同源基因功能及其在黑喉石斛嫩茎开花过程中扮演的角色,本研究以黑喉石斛为试验材料,基于转录组测序结果,克隆得到黑喉石斛FT同源基因,命名为DoFT1。DoFT1基因编码区长度为537 bp,共编码178个氨基酸;生物信息学分析结果表明,该基因编码的蛋白属于PEBP家族蛋白,其含有关键保守氨基酸位点Tyr84和11个连续保守氨基酸残基序列,为FT同源基因;进化树分析结果显示,DoFT1氨基酸序列与铁皮石斛和小兰屿蝴蝶兰同源基因亲缘关系较近;Real-time PCR分析结果显示,DoFT1主要在黑喉石斛叶片部位表达,其表达量在花芽开始分化阶段出现上调,并在花芽成熟期达到峰值后呈下降趋势;将DoFT1导入烟草中超量表达,可以显著促进烟草提前开花。
关键词:黑喉石斛;DoFT1基因;嫩茎开花;成花诱导中图分类号:Q789 文献标识码:A
Expression Pattern Analysis of Dendrobium ochreatum DoFT1 Gene During Flower Development and Its Functional Verification
DU Zhihui1, YANG Lan1, YAO Xinzhuan2, CHEN Zhilin1*
1. Guizhou Horticulture Institute, Guizhou Academy of Agricultural Sciences, Guiyang, Guizhou 550006, China; 2. Tea College, Guihzou University, Guiyang, Guizhou 550025, China
Abstract: TheFLOWERING LOCUS T (FT) gene plays a key role in integrating flowering signals in plants.To study the function of the FT homologous gene and its role in tender stem flowering ofDendrobium Ochreatum, theFT homologous gene, named asDoFT1, was cloned from Den. Ochreatumon the basis of transcriptome sequencing results.DoFT1 contained a 537 bp open reading frame which encoding 178 amino acids. Bioinformatic analysis showed that the DoFT1 belonged to the PEBP family, the conserved key amino acid residue Tyr84 and 11-AA stretch of FT homologs were identified in DoFT1. Phylogenetic tree results showed that DoFT1 was closely related to DcFT inDendrobium candidum and PeFT inPhalaenopsis Equestris. Real-time PCR results indicated that the expression ofDoFT1 was mainly located in leaf tissues, and its expression level was up-regulated during the flower bud differentiation phase, then showed a downward trend after reaching its peak at the flower bud phase. Over-expression ofDoFT1 in transgenic tobacco plants resulted in earlier flowering compared to wild-type plants.
Keywords: Dendrobium ochreatum;DoFT1gene; tender stem flowering; flower induction
DOI: 10.3969/j.issn.1000-2561.2021.04.006
黑喉石斛(Dendrobium ochreatum)是兰科(Orchidaceae)石斛属(DendrobiumSw.)多年生附生草本植物[1],属于春石斛。相比于大多石斛只能在2年生老茎上开花,黑喉石斛在新长出的嫩茎上就能抽出花序并开花[2],其开花时间明显早于其他春石斛,是珍贵的育种亲本,也是研究石斛早开花机理的重要材料。
花期调控是石斛生产中的关键技术,也是近年研究的热点[3]。花发育主要分为成花诱导、花发端及花器官发育3个阶段。其中,植物从营养生长向生殖生长的转换即成花诱导是植物发育中最显著的过程,也是植物繁殖的关键事件[4-6]。在成花诱导过程中已知的成花诱导途径有光周期途径(photoperiodic pathway)、春化途径(vernalization pathway)、赤霉素途径(GA gibberellin pathway)和自主调控途径(autonomous pathway)等[7-8]。而FT作为开花途径中的重要整合因子,其同源基因的结构与功能在不同物种之间高度保守。
目前关于FT及其相关基因在拟南芥等模式植物开花过程中的表达模式与作用机制的研究已较为深入,FT作为多条开花途径的信号整合因子受其上游基因CO的调控,在植物叶片中表达后通过韧皮部运输至茎尖分生组织,结合FD蛋白后激活其下游基因AP1和SOC1的表达,进而调控植物的成花转变[9]。而在兰科植物的相关研究中,Li等[10]发现在拟南芥中超量表达金钗石斛DnFT基因可以通过调控AP1和LHY促进拟南芥提前开花。孙崇波等[11]的研究表明转蕙兰CfFT基因烟草植株的开花提前时间与该基因在转化植株中的表达量呈正相关。黄玮婷等[12]发现墨兰CsFT基因具有拟南芥同源基因类似的促进开花的作用。但关于黑喉石斛FT同源基因功能的研究仍未见报道。
本实验室前期对黑喉石斛转录组数据分析结果显示,FT同源基因同时参与了生物节律钟、光周期、生殖转换3个开花重要生物过程。所以,本研究以黑喉石斛为材料,克隆得到了其FT同源基因DoFT1,分析该基因在黑喉石斛开花前后不同部位的表达模式,并进一步构建超量表达载体遗传转化烟草,对其功能进行初步验证。为明确其在黑喉石斛成花诱导过程中的作用,探明黑喉石斛开花机制提供新的参考。
1 材料与方法
1.1材料
本研究所用材料黑喉石斛(Dendrobium ochreatum)由贵州省园艺研究所保存并提供。植物表达载体pSH 737、农杆菌LBA 4404、普通烟草(Nicotiana tabacumL.)栽培品种‘Xanthi由贵州大学山地植物资源保护与种质创新省部共建教育部重点实验室提供。
1.2方法
1.2.1 DoFT1的克隆 结合转录组测序结果和GenBank中多个FT同源基因序列比对结果,使用DNASTAR设计PCR扩增引物。DoFT F:5?- GGAGAGAACACGGGGGACTCTAGA-3?,DoFT R:5?-CGTACCGAATTCGAGCTCGGTACC-3?,由生工生物工程(上海)股份有限公司合成。以黑喉石斛不同时期叶片cDNA为模板进行PCR扩增。PCR反应体系为:cDNA 1 μL、上游引物DoFT F 1 μL、下游引物DoFT R 1 μL、PCR Mix 10 μL和ddH2O 7 μL,共20 μL。PCR扩增反应程序为:94 ℃ 5 min预变性;94 ℃ 30 s,55 ℃ 40 s,72 ℃ 1 min,35个循环;72 ℃延伸3 min。PCR产物经1.2%琼脂糖凝胶电泳检测后,进行胶回收实验并连接T4载体,遗传转化大肠杆菌感受态并送出测序。拼接测序结果后获得该基因cDNA全长序列。
1.2.2 DoFT1的生物信息学分析 采用BALST分析DoFT1基因的氨基酸序列同源性,下载相似性较高的其他植物同源氨基酸序列,使用MEGA 6.0软件根据相邻连接方法(neighbor jointing,NJ)构建DoFT1系統进化树并分析;通过ExPASy Proteomics Server在线软件ProtParam分析其理化性质,分别使用SOMPA和SWISS MODEL预测其二、三级结构。
1.2.3 DoFT1及其相关基因的表达模式分析 采用华越洋RNA提取试剂盒分别提取黑喉石斛营养生长阶段、花芽分化阶段、花芽阶段和开花阶段4个阶段的总RNA,逆转录为cDNA备用。采用实时荧光定量PCR方法检测DoFT1基因的表达情况,根据DoFT1基因的cDNA全长序列,运用DNASTAR设计实时荧光定量PCR引物,由生工生物工程(上海)股份有限公司合成。实时荧光定量PCR反应体系为:SYBR Premix Ex Taq(2×) 10 μL、上游引物DoFT1 RF 1 μL、下游引物DoFT RR 1 μL、cDNA 1 μL、ddH2O 7 μL,共20 μL。于冰上配制反应液,置于实时荧光定量PCR仪上进行反应,每个样品3次重复。反应完成后计算基因的相对表达量。
1.2.4 转DoFT1基因植株的获得及开花观察期 获得DoFT1编码区序列后,在其5?端和3?分别加入XbaⅠ和KpnⅠ酶切位点序列,送由上海旭冠生物公司合成后通过双酶切反应连接至pSH 737植物表达载体,得到pSH-35S-DoFT载体,该载体含有35S启动子驱动的GUS::NPT II作为报告基因。通过冻融法导入农杆菌LBA 4404,以叶盘法遗传转化模式植物烟草。对经过鉴定的转基因烟草植株开花情况进行观察。
2 结果与分析
2.1黑喉石斛DoFT1基因序列全长克隆及分析
以黑喉石斛不同时期叶片cDNA为模板,结合转录组测序拼接结果和GenBank中多個FT同源基因序列设计特异引物,经过PCR扩增后,得到一条约500 bp大小的基因片段,与预期结果一致(图1)。PCR扩增产物胶回收后,连接T载体后测序,拼接后获得黑喉石斛FT基因cDNA全长序列585 bp。序列分析结果表明,该基因包含1个长度为537 bp的完整开放阅读框, 编码178个氨基酸残基。
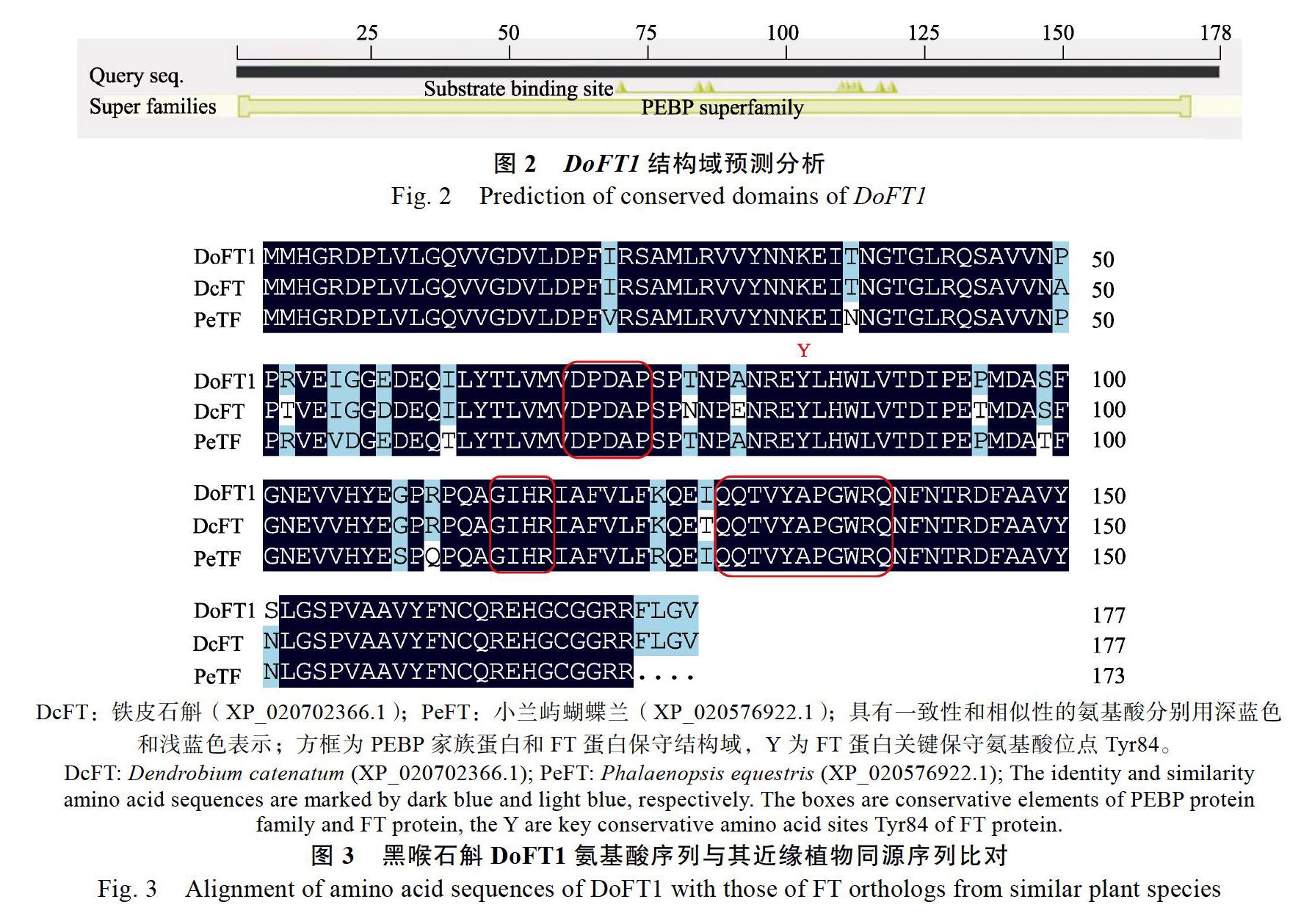
其氨基酸序列BLAST比对结果表明(图2),该基因氨基酸序列包含DPPAP和GIHR等模块,
具有磷脂酰乙醇胺结合蛋白(phosphatidyletha- nolamine-binding protein, PEBP)家族典型功能结构域。进一步比对其与2个兰科近缘物种氨基酸序列(图3),发现其含有关键保守氨基酸位点Tyr84和对FT活性起关键作用的11个保守氨基酸残基序列,为FT同源基因,命名为DoFT1。
DoFT1编码的蛋白质分子式为C887H1365N251O257S7,原子总数为2767,预测其相对分子质量为19.88 kDa,等电点为5.69。分析结果显示,此蛋白含有20个缬氨酸(Val),占氨基酸总数的11.2%;含有16个甘氨酸(Gly),占氨基酸总数
DcFT:铁皮石斛(XP_020702366.1);PeFT:小兰屿蝴蝶兰(XP_020576922.1);具有一致性和相似性的氨基酸分别用深蓝色和浅蓝色表示;方框为PEBP家族蛋白和FT蛋白保守结构域,Y为FT蛋白关键保守氨基酸位点Tyr84。
DcFT:Dendrobium catenatum (XP_020702366.1); PeFT:Phalaenopsis equestris (XP_020576922.1); The identity and similarityamino acid sequences are marked by dark blue and light blue, respectively. The boxes are conservative elements of PEBP proteinfamily and FT protein, the Y are key conservative amino acid sites Tyr84 of FT protein.的9%;不含有吡咯赖氨酸(Pyl)以及硒半胱氨酸(Sec)。亲水性平均系数为–0.248,为亲水性蛋白。
通过SOMPA软件分析DoFT1蛋白二级结构,发现其蛋白质二级结构中含有13.48%的α-螺旋、25.84%的延伸链、5.06%的 β-折叠和55.62%的无规则卷曲。BLAST和SWISS-MODEL预测DoFT蛋白三级结构具有典型的PEBP基因家族蛋白质结构域,其中心具有1个大的由5个反向平行肽链组成的β-折叠区域。此外,其N端有1个α-螺旋、1个β-折叠,C端有1个α-螺旋。
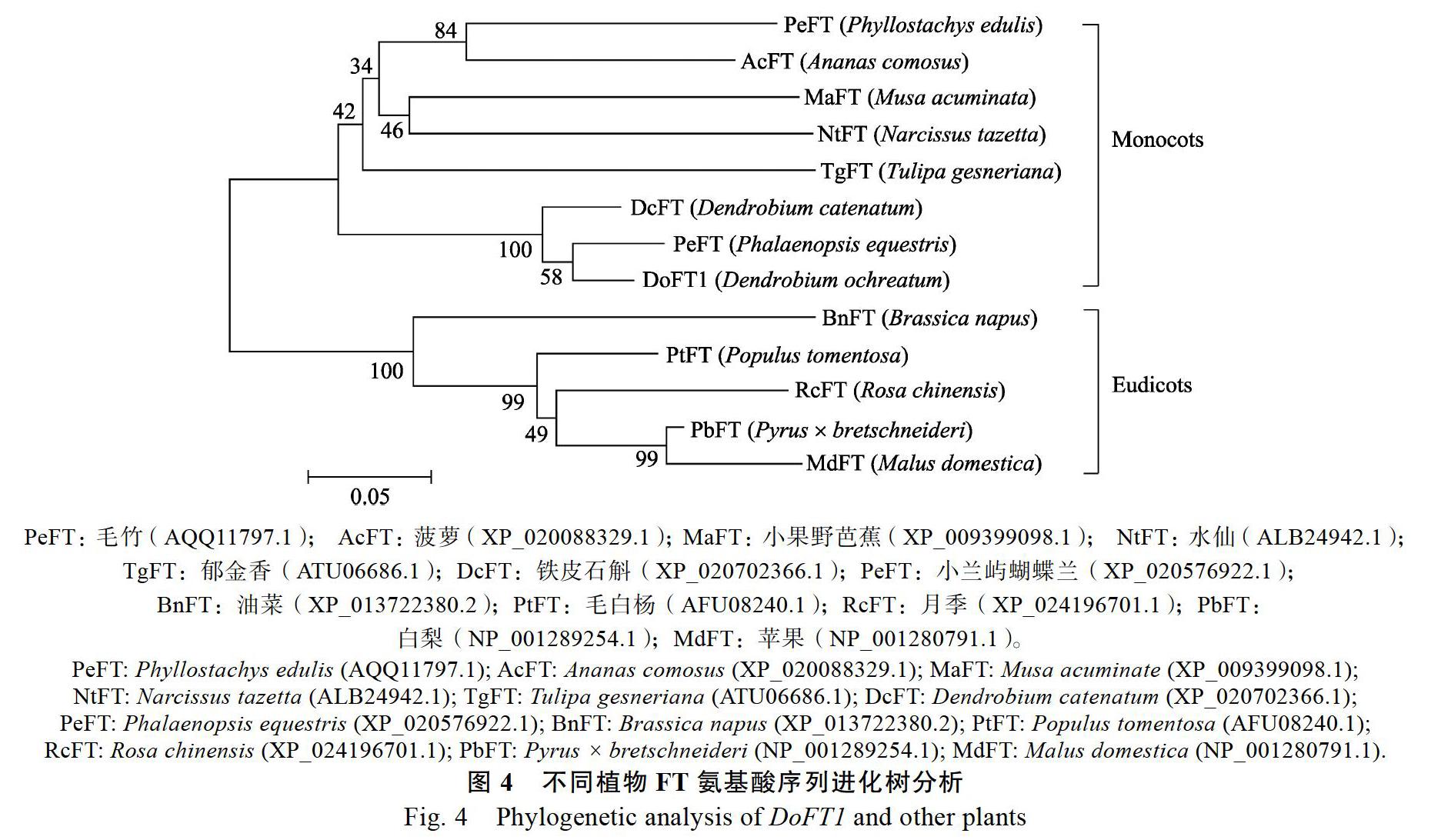
2.2 黑喉石斛DoFT1基因氨基酸序列进化分析
通过NCBI中的BLAST在线软件将DoFT1
推导的氨基酸序列进行搜索比对(图4),发现DoFT1与铁皮石斛FT基因氨基酸序列具有较高的同源性和一致性,序列一致性为96%;其次为小屿蝴蝶兰,其氨基酸序列一致性为94%;此外,DoFT1与月季、郁金香、水仙、苹果等10个物种的FT氨基酸序列相似性皆在80%以上,说明FT基因在其长期进化中的保守性。采用MEGA 6.0软件对DoFT1基因编码的氨基酸序列和GenBank收录的12种植物的同源序列构建系统进化树,聚类后进行分析,结果表明黑喉石斛首先与小兰屿蝴蝶兰、铁皮石斛等兰科植物亲缘关系最为接近,然后与郁金香、菠萝、水仙等单子叶植物FT同源氨基酸归为一类。
2.3黑喉石斛DoFT1基因表达模式
图5为黑喉石斛不同阶段形态特征,利用Real-time PCR技术分析黑喉石斛自然开花过程不同组织中DoFT1基因的表达模式。结果表明:DoFT1基因主要在叶片中表达,随着黑喉石斛从营养生长期向生殖生长期的转换,DoFT1的表达量在花芽分化期出现上调,并在花芽形成期达到峰值,最终在开花期出现下调(图6)。此外,开花期时,DoFT1在叶片和花器官中均有所表达,但叶片的表达量远高于花器官,而在花芽中则未检出DoFT1基因的表达(图7)。
2.4黑喉石斛DoFT1基因遗传转化烟草及转化植株的表型分析
将得到的抗性幼苗植株移栽至营养土中,取4~6叶期抗性烟苗的叶片进行GUS化学组织染色。提取GUS染色阳性植株叶片总DNA,以DoFT1基因的特异性引物进行PCR扩增,在抗性植株中扩增得到500 bp左右的特异性条带(图8)。经鉴定,最终获得20余株T0代转DoFT1基因烟草株系。选取其中开花较早的株系提取总RNA,反转为cDNA后进行PCR扩增,最终筛选出2个超量表达DoFT1基因的烟草株系。
收取筛选得到的T0代转DoFT1基因烟草株系种子,播种后再次经过鉴定得到T1代转DoFT1基因烟草植株,对其开花性状进行觀察(图9)。结果表明(表1),在正常光照条件下,转基因烟草植株的开花期相比于野生型植株提前了15 d,而转基因植株的盛开期(50%植株开花)相比于野生型提前了13 d。初步推测DoFT1基因的超量表达在正常光照条件下可以促进植株提前开花。
3 讨论
目前黑喉石斛的研究主要集中在多倍体诱导[13]和试管苗开花[2]等技术层面,尚未见到有关其开花基因的研究报道。本实验室前期已完成黑喉石斛无参考基因组试管开花组培苗与对照样本的转录组测序工作,分析对照组差异显著基因发现,有7440个基因参与到黑喉石斛花发育过程,其中直接参与成花诱导的基因有94个,包括光周期及自主途径上的促进基因和抑制基因。如CRY1、CRY2、GI、CO、FT、FD、SOC1、LFY、AP1等促进开花转型基因均上调,SVP、CCA1、LHY、CDF、SPA1等抑制基因显著下调。进一步分析发现FT同源基因同时参与了生物节律钟、光周期、生殖转换3个开花重要生物过程。
为探究FT基因对黑喉石斛开花机制的调控作用,结合转录组测序结果在黑喉石斛叶片中克隆得到了FT同源基因DoFT1。序列BLAST结果表明,该基因的序列与铁皮石斛和小兰屿蝴蝶兰FT同源基因编码的氨基酸序列具有较高的一致性,分别为96%和94%,与月季、郁金香等10种植物的相对应氨基酸序列相似性皆在80%以上,说明不同物种FT基因序列较为保守[14]。对黑喉石斛DoFT1氨基酸序列进行生物信息学分析,结果表明该蛋白三级结构具有DDPxD和GxHR等典型PEBP家族蛋白质功能结构域[15],这些保守序列均与磷脂酰乙醇胺的结合位点形成有关。同源序列比对结果表明,其序列含有关键保守氨基酸位点Tyr84和对FT活性起关键作用的11个保守氨基酸残基序列[10],说明本研究克隆得到的DoFT1基因为FT同源基因。
不同植物中FT同源基因的表达模式有一定区别。如拟南芥和水稻的FT同源基因在叶片中表达,其表达产物移动到茎尖组织之后与FLOWERING LOCUS D (FD)等蛋白结合后促进开花[16-18];荔枝FT同源基因仅在叶片中表达,遗传转化模式植物烟草后部分转基因植株出现早花表型[19];而黄瓜FT同源基因在花器官和果实中表达,在叶片中不表达[20]。本研究发现DoFT1基因在黑喉石斛的叶片组织中表达量最高,在花器官中表达量少,在花芽中未检测出表达量,与拟南芥和荔枝FT同源基因的表达模式相似。不同发育时期的叶片组织中,DoFT1基因表达量在花芽始分化阶段出现上调,在花芽形成时期的基因的表达量达到最高,开花后该基因的表达量下降。这与文心兰OnFT基因的表达量在其叶片中随着成熟度的增长呈现先升后降的表达模式相似[14]。本研究构建了DoFT1的过表达载体,利用农杆菌介导的叶盘法导入烟草中。观察T1代转基因烟草植株的开花性状,发现其整体呈现早花趋势。与拟南芥[16]、水稻[17-18]、蕙兰[11]、墨兰[12, 21]等物种中的FT同源基因具有相似的正向调控开花作用。初步推测黑喉石斛中的DoFT1可能在成花诱导和花发端过程中发挥重要作用。
本研究结合转录组数据克隆获得了黑喉石斛FT同源基因DoFT1序列,序列分析结果表明该基因为铁皮石斛和小兰屿蝴蝶兰FT基因的同源基因。荧光定量分析结果表明该基因主要在黑喉石斛叶片中表达,且在花芽分化形成期叶片中表达量最高。将DoFT1导入烟草中超量表达,可以使烟草开花时间明显提前。该结果为探明DoFT1在黑喉石斛嫩茎成花机制中的作用提供参考。
参考文献
[1]Lavarack B, Harris W, Stocker G. Dendrobium and its relatives[M]. Portland, Oregon: Timber Press, 2000: 14.
[2]杨 澜, 王爱华, 石乐娟, 等. 植株成熟度与生长调节剂对黑喉石斛花芽诱导的影响[J]. 江苏农业科学, 2019, 47(12): 190-192.
[3]张东雪, 廖 易, 陆顺教, 等. 石斛兰花期调控研究进展[J]. 中国农学通报, 2017, 33(1): 72-77.
[4]Poethig R S. Phase change and the regulation of developmental timing in plants[J]. Science, 2003, 301(5631): 334-336.
[5]Baurle I, Dean C. The timing of developmental transitions in plants[J]. Cell, 2006, 125(4): 655-664.
[6]Jung J H, Seo P J, Kang S K,et al. miR172 signals are incorporated into the miR156 signaling pathway at theSPL3/4/5genes inArabidopsisdevelopmental transitions[J]. Plant Molecular Biology, 2011, 76(1-2): 35-45.
[7]Fornara F, Maontaigu A, de Coupland G. SnapShot: Control of flowering inArabidopsis[J]. Cell, 2010, 141(3): 550-550.e2.
[8]Wellmer F, Riechmann J L. Gene networks controlling the initiation of flower development[J]. Trends in Genetics, 2010, 26(12): 519-527.
[9]Jaeger K E, Wigge P A. FT protein acts as a long-range signal inArabidopsis[J]. Current Biology, 2008, 17(12): 1050-1054.
[10]Li R H, Wang A K, Sun S L,et al. Functional characterization of FT and MFT ortholog genes in orchid (Dendrobium nobileLindl) that regulate the vegetative to reproductive transition inArabidopsis[J]. Plant Cell Tissue & Organ Culture, 2012, 111(2): 143-151.
[11]孙崇波, 向 林, 李小白, 等. 蕙兰Flowering locus T基因的克隆及其對开花的影响[J]. 中国农业科学, 2013, 46(7): 1419-1425.
[12]黄玮婷, 吴博文, 方中明. 墨兰FT同源基因的时空表达及功能分析[J]. 安徽农业大学学报, 2017, 44(1): 135-141.
[13]王爱华, 吴青青, 杨 澜, 等. 秋水仙素诱导黑喉石斛多倍体研究[J]. 西南大学学报(自然科学版), 2017, 39(1): 55-60.
[14]林榕燕, 方能炎, 罗远华, 等. 文心兰FT同源基因的克隆及其表达分析[J]. 西北植物学报, 2019, 39(10): 1718-1724.
[15]常丽丽, 吴连成, 库丽霞, 等. 植物FLOWERING LOCUS T/TERMINAL FLOWER1基因家族的研究进展[J]. 西北植物学报, 2008, 28(4): 4843-4851.
[16]Corbesier L, Vincent C, Jang S,et al. FT protein movement contributes to long-distance signaling in floral induction ofArabidopsis[J]. Science, 2007, 316(5827): 1030-1033.
[17]Tamaki S, Matsuo S, Wong H L,et al. Hd3a protein is a mobile flowering signal in rice[J]. Science, 2007, 316(5827): 1033-1036.
[18]Taoka K, Ohki I, Tsuji H,et al. Shimamoto, Ko4.14-3-3 proteins act as intracellular receptors for rice Hd3a florigen.[J]. Nature, 2011, 476(7360): 332-335.
[19]丁 峰. 荔枝FLOWERING LOCUST(FT) 同源基因的克隆及功能研究[D]. 南宁: 广西大学, 2012.
[20]张 娟, 颜爽爽, 赵文圣, 等. 黄瓜CsFT基因的克隆及其功能分析[J]. 园艺学报, 2013, 40(11): 2180-2188.
[21]Huang W, Fang Z, Zeng S,et al. Molecular cloning and functional analysis of Three FLOWERING LOCUS T (FT) homologous genes from ChineseCymbidium[J]. International Journal of Molecular Sciences, 2012, 13(9): 11385- 11398.
责任编辑:崔丽虹
