龙眼体胚发生早期4CL基因家族鉴定与功能分析
2021-06-15洪平静徐小萍王静宇陈晓慧申序林玉玲赖钟雄
洪平静 徐小萍 王静宇 陈晓慧 申序 林玉玲 赖钟雄

摘 要:為了解龙眼4-香豆酸:辅酶A连接酶(Dl4CL)基因家族的分子特性及生物学功能。采用生物信息学分析方法进行龙眼4CL基因家族的成员鉴定,蛋白结构域及特性、分子进化树、体胚发生过程和组织器官中的表达规律分析以及可能互作的miRNA预测。结果显示,Dl4CL基因家族包含43个成员,分为6个亚家族;不同亚家族成员的基本理化性质包括等电点、相对分子量、氨基酸个数及信号肽有所差别;Dl4CL蛋白均属于非分泌型蛋白,具有多个保守的motif;各成员基因结构特性与进化树中家族成员亲缘关系的远近有关;Dl4CL启动子序列包含大量光响应元件、厌氧诱导响应元件及MYB结合位点,推测Dl4CL家族成员可能参与龙眼生长发育过程中黄酮类物种的生物合成以及色素的积累;Dl4CL可能参与不同胚胎发育过程和不同组织器官的形态建成;43个Dl4CL成员共有10个受miRNA调控,并且不同成员受不同的miRNA靶向调控,推测Dl4CL可能通过与miRNA互作参与体胚发生、响应环境胁迫等过程。研究表明,Dl4CL在龙眼体胚发生早期除了参与木质素的合成之外,还可能参与色素合成、组织器官特异表达等多种生物代谢途径,表现其生物学功能的复杂性。
关键词:龙眼;4CL基因家族;基因鉴定;功能分析
中图分类号:S667.2 文献标识码:A
Identification and Functional Analysis of 4CL Gene Family During Early Somatic Embryogenesis in Dimocarpus longan Lour.
HONG Pingjing, XU Xiaoping, WANG Jingyu, CHEN Xiaohui, SHEN Xu, LIN Yuling, LAI Zhongxiong*
Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract: To understand the molecular characteristics and biological functions of the 4-coumarate: coenzyme A ligase (Dl4CL) gene family in Dimocarpus longan Lour., bioinformatics analysis was used to identify the members of the 4CL gene family of longan, to analyse the protein domain and characteristics, molecular evolutionary tree, expression patterns in somatic embryogenesis and tissue-organ, and to predict the possible interaction of miRNAs. There were 43 members of the Dl4CL gene family, which could be divided into six subfamilies. The basic physical and chemical properties of different subfamilies including isoelectric point, relative molecular weight, amino acid number and signal peptide were different. Dl4CL proteins belonged to the non-secretory pathway, there were multiple conserved motifs. The structural characteristics of the genes were related to the kinship of family members in the evolutionary tree. The Dl4CL promoter sequence contained a large number of light responses elements, anaerobic induction response elements, and MYB binding sites, which suggesting that the Dl4CL gene family may be involved in the biosynthesis of flavonoids and the accumulation of pigments during the growth and development of longan. Dl4CL gene family might be involved in different somatic embryogenesis process and tissue-organ morphogenesis. A total of 10 Dl4CL members were likely to be regulated by miRNA, and different members were targeted by different miRNA, it was speculated that Dl4CL may interact with miRNA regulation process to participate in somatic embryogenesis, response to environmental stress and other biological processes. This study shows that Dl4CL might not only participate in lignin synthesis, but also participate in a variety of biological metabolic pathways, such as pigment synthesis, tissue-organ specific expression, showing the complexity of its biological functions.
Keywords: longan; 4CL gene family; gene identification; functional analysis
DOI: 10.3969/j.issn.1000-2561.2021.04.001
4-香豆酸:辅酶A连接酶(4-coumarate: coenzyme A ligase, EC 6. 2. 1. 12)是苯丙烷类代谢途径中第3个步骤的关键酶,对木质素和黄酮类化合物的合成发挥重要的调控作用[1],同时决定着植物中苯丙烷类途径代谢物质的合成方向,是植物与环境间相互作用的重要枢纽[2]。
近年来,随着对4CL基因的深入研究,已逐渐从多种植物中分离出4CL基因,如水稻(Oryza sativa)[3]、拟南芥(Arabidopsis thaliana)[4]、欧芹(Petroselinum crispum)[5]、毛白杨(Populus tomentosa Carr.)[6]和烟草(Nicotiana tabacum)[7]等约40多种植物[8-17]。Hu等[18]在对山杨的研究中发现,Pt4CL1和Pt4CL2是结构和功能完全不同的2个基因,Pt4CL1在木质化的组织中特异性表达,参与木质素的生物合成;而Pt4CL2则在茎和叶的表皮层中特异性表达,参与类黄酮及其他酚类化合物的生物合成。在拟南芥中[19],At4CL1、At4CL2、At4CL3和At4CL5均能编码具有催化活性蛋白的4CL基因,At4CL3受光诱导调控,蓝光能诱导其表达,调控生成类黄酮物质,在叶片、花中具有较高表达,并且具有明显的昼夜节律性。前人通过对多种植物的4CL基因序列进行分析发现[20],植物中的4CL基因是以基因家族的形式存在,主要被划分为2类,分别是以拟南芥、烟草等为代表的大部分双子叶植物和以水稻、玉米等为代表的单子叶植物的4CL基因,这表明4CL基因与单子叶植物向双子叶植物进化有着密切的关联。也进一步证明4CL基因在植物中开始进化的时间比单子叶植物和双子叶植物开始进化的时间均要早,甚至可以大胆推测在单子叶植物开始进化之前,植物中的4CL基因就可能已经存在[21]。
龙眼(Dimocarpus longan Lour.)原产于中国南部和越南南部的亚热带区域,是我国著名的热带亚热带果树,具有很高的药用价值。研究表明,龙眼胚胎的发育状况在很大程度上影响果实的产量和品质[22],但各种生物胁迫及盐碱、寒冷、干旱等非生物胁迫均会对龙眼胚胎的生长发育造成不良影响。因此,了解龙眼胚胎发育过程的生理生化反应变化对龙眼的生物学研究有着重要意义。据Zimmerman[23]报道,植物体胚和合子胚在分子水平上具有相似性,体胚发生系统是研究植物胚胎发育的理想模式系统,尤其对龙眼这类遗传背景复杂、杂合度高的乔木。鉴于此,对龙眼体胚发生过程中4CL基因家族进行全基因组范围的鉴定和表达模式分析,不仅为研究植物体胚发生发育过程中4CL的作用机制提供理论依据,而且为研究龙眼胚胎发育过程中4CL的调控作用提供重要参考。
1 材料与方法
1.1 材料
以无患子科红核子龙眼为研究对象,龙眼全基因组的数据库来源于实验室构建的龙眼基因组数据库(NCBI登录号:BioProject PRJNA305337)[24]、龙眼转录组数据库(SRA050205)[25]。于Phytozome在线软件上下载拟南芥以及甜橙(Citrus sinensis)的4CL家族成员序列。
1.2 方法
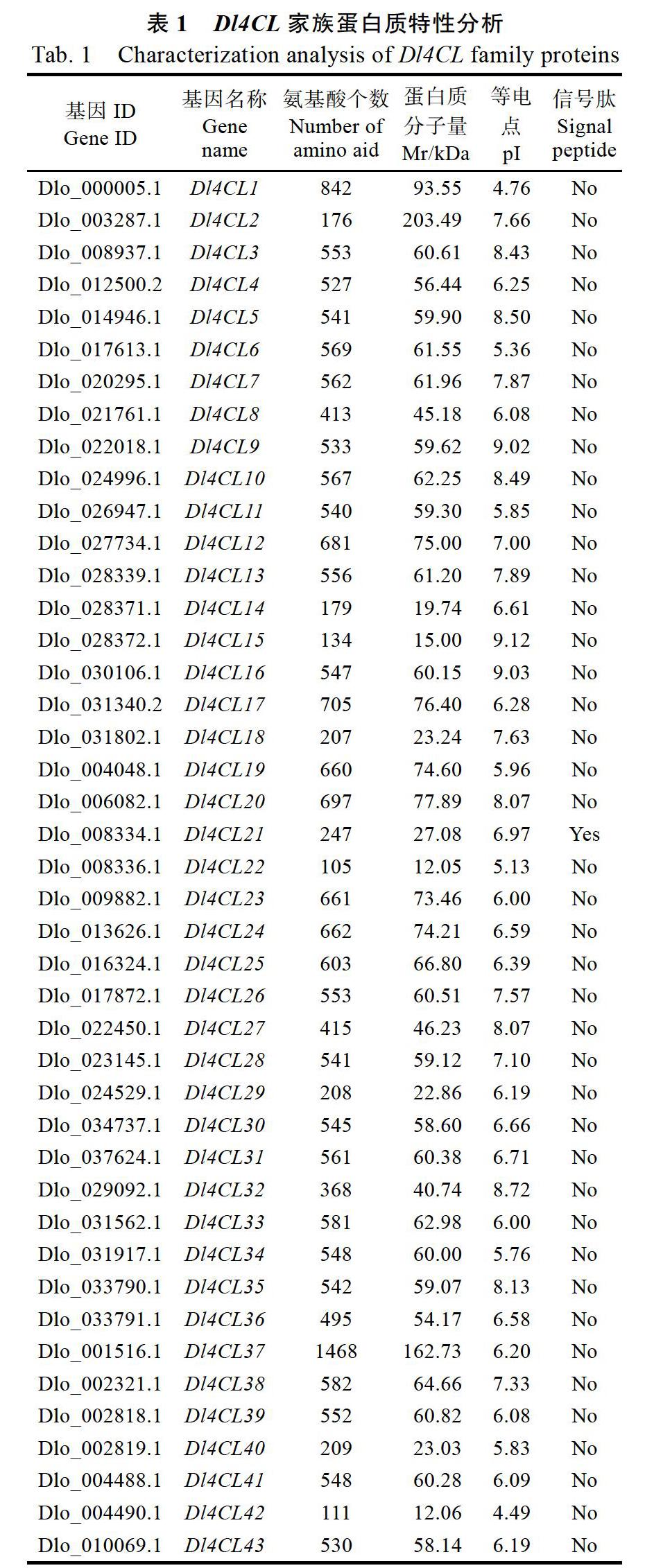
1.2.1 Dl4CL基因家族成员的鉴定及其基本理化性质分析 经过龙眼基因组数据库的同源对比,通过筛选初步获得43条具有完整开放阅读框(open reading frame, ORF)的龙眼4CL候选序列。利用NCBI Blast进行4CL序列同源比对分析,同时结合该序列的基因注释,通过DNAMAN 6.0软件对4CL的CDS、gDNA及启动子序列进行比对后,可以基本确定龙眼4CL家族的基因成员。采用ExPASy分析43条Dl4CL氨基酸序列的等电点(pI)、分子量(Mr)、氨基酸个数(aa)、信号肽等相关数据。
1.2.2 Dl4CL家族成员进化树的构建 为了对Dl4CL基因家族成员进行更加准确地分类,将对4CL基因有系统研究的甜橙和模式植物拟南芥与龙眼一同分析。采用MEGA 6.06软件的邻近法(neighbor-joining method)对龙眼的43条序列、拟南芥的23条序列以及甜橙的26条序列,3个物种共92条4CL氨基酸序列进行系统进化树的构建,自展法系数(bootstrap)設为1000,最后利用ITOL(https://itol.embl.de/)在线网站导入进化树对其进行美化。
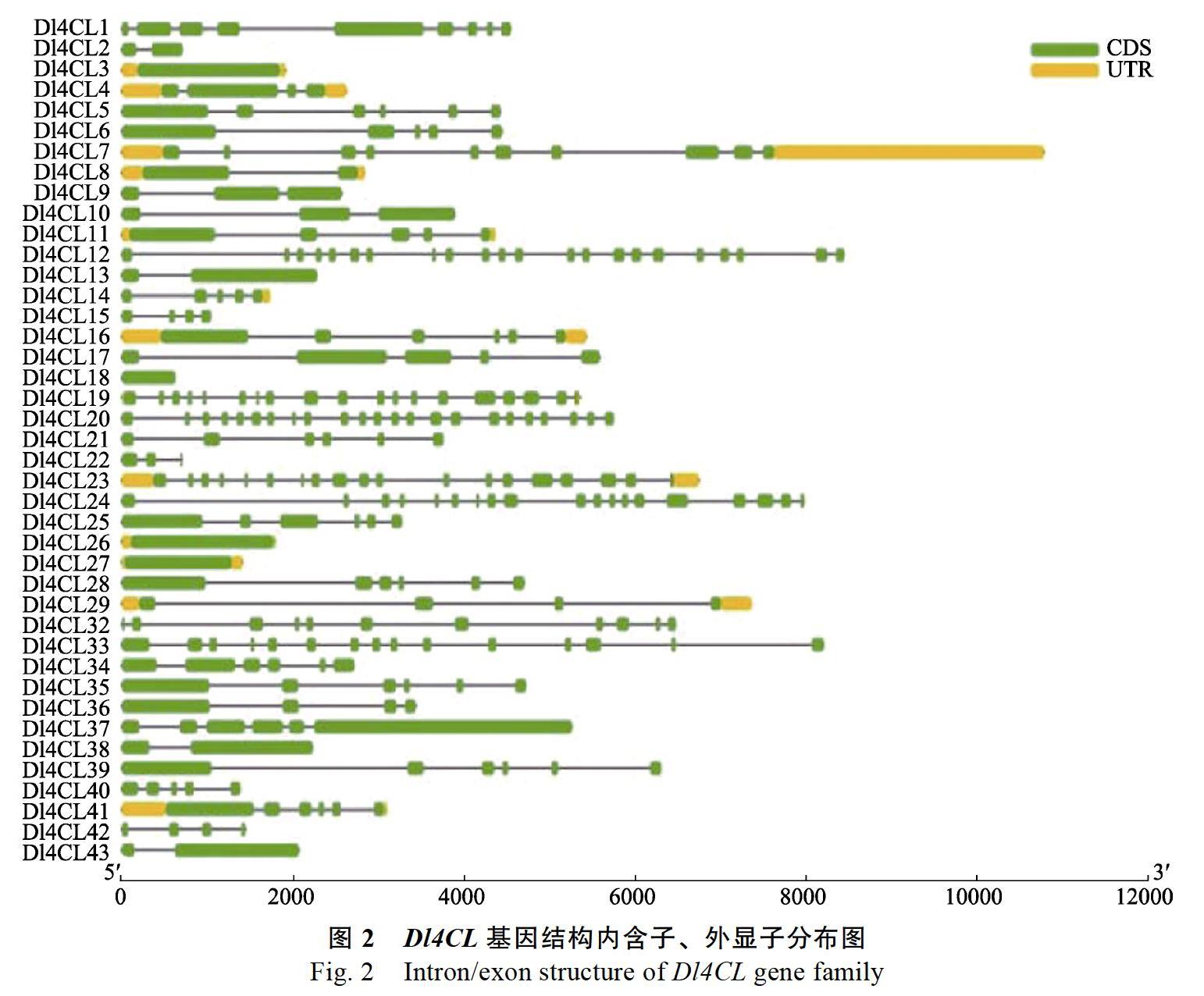
1.2.3 Dl4CL基因结构及蛋白结构域分析 采用GSDS 2.0分析龙眼4CL成员的内含子、外显子特征,通过The MEME Suite(http://meme-suite.org/)在线分析Dl4CL的蛋白保守基序,基序数值设置为20,采用TBtools对获得的motif进行绘制。
1.2.4 Dl4CL基因启动子分析 常规而言,启动子序列为CDS ATG上游1500~2000 bp,因此,利用TBtools提取CDS ATG上游2000 bp序列,采用Plant Care在线网站分析Dl4CL家族成员的启动子特征及顺式作用元件特点,利用Excel软件对预测结果进行整理和简化,最后采用TBtools对顺式作用元件进行可视化。其中由于Dl4CL29、Dl4CL27和Dl4CL24三个成员的启动子序列含有较多N,不进行后续分析。
1.2.5 Dl4CL基因家族不同组织器官特异表达模式分析 为了解4CL基因家族在龙眼不同体胚发生过程和不同组织器官中的生物学功能,利用龙眼基因组数据库提取的Dl4CL基因成员在体胚发生的不同阶段包括非胚性愈伤组织(non-embr yonic callus, NEC)、胚性愈伤组织(embryonic callus, EC)、不完全胚性紧实结构(incomplete compact pro-embrogenic cultures, ICpEC)、球形胚(globular embryos, GE)和不同组织器官中特异表达的FPKM值,分析Dl4CL基因家族各成员的表达情况。
1.2.6 Dl4CL家族成员受调控的miRNA预测 以本实验室构建的龙眼体胚发生过程的miRNA文库为数据库[26],利用在线软件psRNATtarget对龙眼的43条4CL基因成员进行可能互作的miRNA预测,期望值E设为3.5。
2 结果与分析
2.1 Dl4CL家族基因鉴定与蛋白理化性质分析
通过4CL家族成员的基因座位置将43个成员命名为Dl4CL1~Dl4CL43。通过对龙眼43条4CL氨基酸序列的蛋白质特性分析发现(表1),该家族的氨基酸个数在105~1468之间;蛋白质分子量在12.05~203.49 kDa之间;等电点在4.49~ 9.12之间,其中pI小于7的有25条,说明大部分为碱性;除了Dl4CL21含有信号肽外,其余42条成员均不含信号肽。
2.2 Dl4CL家族进化树的构建
为进一步了解Dl4CL家族的生物学功能,利用MEGA 6.06软件对拟南芥、甜橙和龙眼3个物种共92条氨基酸序列进行系统进化树的构建(图1)。
参考拟南芥中4CL基因的分类,并结合聚类分析,可大致将拟南芥、甜橙和龙眼3个物种的4CL基因家族分为6类。Group1中只包含拟南芥和龙眼的4CL家族基因,这部分基因与甜橙4CL基因同源差异性较大;拟南芥、甜橙和龙眼3个物种的4CL基因在其余各组均有存在,具有较高同源性。
2.3 Dl4CL基因结构分析
为进一步分析Dl4CL基因家族的基因结构特征,了解Dl4CL的生物学功能,对龙眼43条基因的基因结构进行内含子、外显子的数目及位置分析(图2)。从图2中可见,所有4CL基因的核苷酸序列基本可以分为2个部分:CDS区和UTR区。结果显示,所有Dl4CL基因家族成员的第1个内含子都落在成熟编码序列内部,从而有利于区别信号序列和编码序列。Dl4CL含有1~23个内含子,以6个内含子为主,说明Dl4CL基因家族的蛋白质编码区有很高的保守性。其中Dl4CL18、Dl4CL27、Dl4CL26、Dl4CL3只有1个内含子,最多的是Dl4CL20有23个内含子,其次是Dl4CL12有22个内含子。此外,Dl4CL基因家族成员的基因长度存在明显差异,其中最短序列Dl4CL22的基因长度只有105 bp,而最长序列Dl4CL37的基因长度为1468 bp,不同分支的Dl4CL基因CDS-UTR结构数量分布差异较大,可能会影响其基因功能的分化。由于基因同源关系越近,其结构越相似[27],因此聚集在同一分枝的Dl4CL基因具有相似的内含子、外显子结构。
2.4 Dl4CL蛋白结构域分析
为了解Dl4CL家族基因在龙眼中的蛋白保守结构域特点与分布情况,使用MEME软件对4CL氨基酸序列进行保守序列分析,共鉴定出20个motif(图3)。43条序列中大部分序列(30条以上)包含motif 1~3、motif 5、motif 7、motif 10共6个motif,表明这6个基序在Dl4CL中排序及位置都非常保守。其中最保守的基序motif 1长为29个氨基酸,41个成员中均包含该基序。通过43个序列成员的序列比较,有些序列缺少或多出几个保守基序,推测植物4CL基因家族的不同成员所表达的功能有所不同。Dl4CL基因家族具有相对保守的蛋白功能结构域(图4),结果显示,Dl4CL家族中有16条基因均含有AFD_class_I superfamily结构域,并且其中有14条基因是只有该结构域。值得注意的是,Dl4CL家族的大部分基因成员都只含有1个蛋白结构域,Dl4CL37是具有最多蛋白结构域的序列,包括FAAL、NRPS_term_dom superfamily、HemY superfamily和PP-binding 4个结构域。猜测Dl4CL基因家族成员广泛参与龙眼体胚和组织器官发育过程,在植物的生长发育过程中发挥特异的生物学功能。
2.5 Dl4CL家族啟动子顺式作用元件分析
对Dl4CL家族基因上游2000 bp的启动子顺式作用元件进行预测,以了解Dl4CL不同成员启动子之间存在的功能差异。其中Dl4CL29、Dl4CL27和Dl4CL24无完整启动子,无法进行分析。对4CL基因组启动子序列主要的顺式作用元件分析发现(图5),大部分Dl4CL基因家族启动子均包含大量的光响应元件、厌氧诱导响应元件以及MYB结合位点,还有部分基因响应脱落酸、赤霉酸、水杨酸、茉莉酸甲酯等激素应答,以及热胁迫、低温胁迫、创伤修复等非生物胁迫;其中,Dl4CL15、Dl4CL43包含与黄酮类化合物生物合成相关基因调控的MYB转录因子结合位点,该现象表明,Dl4CL可能参与龙眼生长发育过程的色素合成途径;此外,发现65%的基因序列均包含干旱胁迫下MYB转录因子的结合位点,还有部分响应光胁迫下MYB转录因子结合位点。由此可见,Dl4CL基因家族中存在大量的核心启动子元件,不同成员拥有不同种类和数目的作用元件,从而导致不同成员间功能的差异性和复杂性。
2.6 Dl4CL家族基因组织特异表达分析
为分析Dl4CL家族成员在龙眼不同体胚发生阶段和组织器官中的表达情况,根据从龙眼基因组数据库中提取的Dl4CL家族特异表达的FPKM值,利用TBtools绘制成聚类分析图(图6)。结果表明,在不同体胚发生过程中,大致有9种表达模式:NEC阶段上调表达,其他阶段下调表达
(Dl4CL4、28、6、9、18、11、8、13、20、16、33、35、36);EC阶段上调表达,其他阶段下调表达(Dl4CL12、1、30、3、41、23、14);ICpEC阶段上调表达,其他阶段下调表达(Dl4CL39、38、29、27);GE阶段上调表达,其他阶段下调表达(Dl4CL32);EC和ICpEC阶段上调表达,其他阶段下调表达(Dl4CL10、17、19、24、5);NEC和GE阶段上调表达,其他阶段下调表达(Dl4CL34、43);EC和GE阶段上调表达,其他阶段下调表达(Dl4CL21、25、7、31);NEC和EC阶段上调表达,其他阶段下调表达(Dl4CL32);NEC、ICpEC和GE阶段上调表达,其他阶段下调表达(Dl4CL23、14)。其中Dl4CL15在整个体胚发生过程中均不表达。可见,Dl4CL家族大部分成员在龙眼体胚发生过程中主要呈现下调表达的趋势。
在不同组织器官中(图7),Dl4CL表达情况总体而言仍是下调为主,其中Dl4CL1、5、9、15、18、21、25、39在所有组织器官中均几乎不表达,而Dl4CL4和Dl4CL10则是均有较高表达;Dl4CL26、14、23在果肉阶段下调表达,其他阶段均上调表达;Dl4CL12、16在花蕾和种子阶段上调表达,其他阶段下调表达。在不同组织器官中Dl4CL家族成员表达情况较为分散,但总体仍呈下调趋势。
2.7 Dl4CL家族基因miRNA预测分析
通过psRNATarget在线预测软件分析Dl4CL家族受miRNA文库中靶向调控的miRNA种类。结果表明:43个Dl4CL家族成员预测出10个成员受miRNA调控(表2)。10个Dl4CL基因家族成员所受到调控的miRNA种类均不同,可能受10个miRNA调控。根据结果可以发现Dl4CL家
族成员受到的miRNA调控种类较多,基本上是1个基因只受到1种miRNA的调控,可能是Dl4CL家族的各成员之间的结构与功能特异性所致。
3 讨论
3.1 Dl4CL家族成员可能具有功能上的多样性
4CL作为苯丙烷类代谢途径的主要分支酶,除了调控合成多种次生代谢产物外,还调控着植物的生长发育,同时在保护植物免受生物和非生物胁迫的过程中发挥重要作用[28-30]。目前植物4CL家族的基因组分析已有相应的报道[3-17],且有众多关于4CL基因克隆以研究其功能表达及植物生长发育规律的报道[18-21]。龙眼4CL基因组具有43条序列,结合从拟南芥和甜橙中分别提取的23条和26条4CL序列进行系统进化树的构建,结合聚类分析,可将龙眼4CL分为6大类,在进化上多于拟南芥和甜橙。
结合Dl4CL基因启动子顺式作用元件分析发现,有65%的基因序列含有调控干旱的MYB转录因子结合位点,还有部分响应光胁迫下的MYB转录结合因子。MYB转录因子在植物的形态建成、生长发育中起着重要的调控作用[31],推测Dl4CL家族基因可能受MYB转录因子调控途径作用,从而通过改变细胞壁木质化程度,提高抵抗逆境胁迫的能力;MYB转录因子同时还参与植物的初生代谢和次生代谢等多种生命活动,调节苯丙烷类代谢途径[32]。通过对Dl4CL基因家族的顺式作用元件分析发现,Dl4CL43以及Dl4CL15包含参与黄酮类化合物生物合成的MYB轉录因子结合位点,植物中的花青素属于黄酮类化合物中的一种,而MYB转录蛋白能够通过调节结构基因的转录,从而影响花青素的合成积累,因此推测Dl4CL可能参与龙眼生长发育过程中色素的积累[33-35]。另外还发现79% Dl4CL启动子序列均包含茉莉酸甲酯反应性响应元件,推测Dl4CL家族可能在促进鳞茎的形成与膨大过程中发挥重要作用[36]。另外值得注意的是,所有基因家族成员都含有光响应元件,但包含的数量不同,个数介于4~18之间,推测该家族在调节植物昼夜节律上发挥着重要作用。
在Dl4CL家族基因组织特异表达中发现,Dl4CL4和Dl4CL10在龙眼非胚性阶段和体胚发生阶段均有高表达,暗示这2个基因在龙眼的体胚发生过程和生长发育过程均发挥重要的生物学功能。在龙眼不同体胚发生过程和不同组织器官中4CL家族的不同成员存在明显的功能多样性,这与前人报道4CL调控胚胎发育、花器官发育及木质素生物合成等生物学功能类似[1]。而Dl4CL家族各成员是如何影响体胚发生过程和不同组织器官形态建成的生物机制,还有待后续进一步深入研究。
miRNA调控途径参与植物体的生长发育,以及各种生物与非生物胁迫响应过程,通过调控转录水平或转录后水平翻译,以及参与转录水平甲基化起重要作用,在植物体细胞胚胎发生过程miRNA也具有重要的分子调控作用[37-38]。通过对Dl4CL家族进行的miRNA预测,发现Dl4CL家族43个成员中有10个受miRNA靶向调控,并且10个家族成员所受调控的miRNA种类均不同,并且1个Dl4CL基因只受1个miRNA调控,1种miRNA也只调控1个4CL基因。其中Dl4CL4在不同龙眼体胚发生阶段和不同组织器官中均有高表达,推测miR5170可能也通过调控Dl4CL进而参与龙眼体胚的形态建成。根据调控4CL基因家族的miRNA种类特异性,初步推测Dl4CL通过参与miRNA的调控过程,进而参与龙眼胚胎发育及不同组织器官发育过程及多种植物生长发育过程,但至今关于miRNA靶向调控4CL基因家族的具体调控机制尚无报道,需要进一步深入研究。
3.2 Dl4CL基因可能參与龙眼不同组织部位的生长发育
4CL作为苯丙烷类代谢途径中的第3个关键步骤酶,在木质素合成过程中发挥重要的调控作用。在木质素的生物合成过程中发现,4CL基因对羟基肉桂酸衍生物的表达模式有较大差异。例如,At4CLl、At4CL2编码的同工酶与木质素的合成有着紧密的联系,同时At4CLl和At4CL2在幼苗的根中具有很高的表达活性,而At4CL3则主要在植物的花中有较高的表达活性。另外,At4CL3能够通过激活p-香豆酸作为查耳酮合成酶的底物,参与植物中类黄酮物质的合成[39],同一物种中4CL基因家族中不同成员在器官、组织和细胞的表达上表现出较大的特异性,而这些也是4CL基因组织特异性表达的表现。本次在对Dl4CL家族基因成员在不同体胚发生过程和不同组织器官的表达研究中也发现了这一点,Dl4CL11和Dl4CL26在龙眼体胚发生早期NEC阶段具有高表达,并且Dl4CL26包含水杨酸和脱落酸响应元件,而水杨酸在促进植物体细胞胚胎发育和抗环境胁迫方面发挥重要作用[40],因而初步推测Dl4CL11和Dl4CL26对龙眼胚性愈伤组织的形成以及抗逆性的提高起促进作用。另外值得注意的是,Dl4CL4和Dl4CL10在龙眼胚胎发育早期各阶段以及各组织器官中均有较高的表达,并且Dl4CL10含有茉莉酸甲酯反应性响应元件以及干旱的MYB转录因子结合位点,可见Dl4CL10在促进龙眼早期胚胎发育和各器官形成的同时,还参与了黄酮类的生物合成以及色素的积累。4CL基因家族在植物中的组织特异性表达,也反映出4CL家族成员可能参与了植物体内不同的生物代谢途径。
3.3 Dl4CL可能响应多种激素应答和非生物胁迫
根据Dl4CL家族的启动子顺式作用元件的分析,得知该家族中的大部分成员具有响应多种激素调控及抵抗非生物胁迫的顺式作用元件,包括低温胁迫、热胁迫、干旱胁迫等非生物胁迫,响应茉莉酸甲酯、ABA、赤霉素等激素应答。67%的Dl4CL家族成员可响应ABA调控,ABA不仅影响植物胚胎发育,同时在种子和芽休眠到萌发过程中起着重要作用[41],推测ABA可能通过调控Dl4CL家族基因的表达进而影响龙眼体胚的生长发育和组织器官的形态建成。另外还有79%的Dl4CL家族成员具有茉莉酸甲酯应答元件,茉莉酸甲酯是常用的植物激素之一,具有促进合成酚类物质的作用,提高植物的抗氧化活性,从而延长果实保质期,降低果实贮藏期间的腐烂率[42]。而4CL作为苯丙烷类代谢途径中的关键酶,4CL酶活性的高低直接影响到酚酸物质的合成[43]。因此,茉莉酸甲酯可能通过调控Dl4CL家族成员的表达,促使龙眼中酚酸的积累,提高果实的抗氧化活性的同时进一步提升果实品质。Dl4CL家族大多数成员响应多种植物激素调控,说明Dl4CL基因家族在龙眼生长发育过程中发挥重要作用。
据报道,4CL基因家族不仅在植物的生长发育过程中发挥重要作用,同时能够响应非生物胁迫[44]。细胞中活性氧(ROS)产生与清除之间的平衡容易被非生物胁迫破坏,导致ROS浓度过高以及生物膜、蛋白质等的氧化性损伤,从而抑制植物的生长发育[45-46]。在Dl4CL基因家族中,约有60%的成员能够响应低温胁迫、热胁迫、干旱胁迫等非生物胁迫。有研究发现,棉花在干旱条件下,Gh4CL7能够通过增加木质素含量,促进根系伸长,关闭气孔,从而增强对干旱胁迫的耐受性[47],而ABA在干旱胁迫下根的发育中起着至关重要的作用[48],推测Dl4CL通过响应ABA激素应答,促进龙眼根系伸长,增加根部对水分的吸收,从而抵抗干旱胁迫。通过对植物激素的响应影响植物的生长发育,从而提高植物的抵抗非生物胁迫能力,推测Dl4CL家族成员中响应激素应答的顺式作用元件与植物抵抗非生物胁迫能力必然有着直接或间接的关系。但Dl4CL家族成员在龙眼体胚发生阶段如何响应激素应答和抵抗非生物胁迫的具体机制还需要进一步深入研究。
参考文献
[1]田晓明, 颜立红, 向光锋, 等. 植物4香豆酸: 辅酶A连接酶研究进展[J]. 生物技术通报, 2017, 33(4): 19-26.
[2]赵淑娟, 刘 涤, 胡之璧. 植物4-香豆酸: 辅酶A连接酶[J]. 植物生理学通讯, 2006, 42(3): 529-538.
[3]Zhao Y, Kung S D, Dube S K. Nucleotide sequence of rice 4-coumarate: CoA ligase gene, 4-CL.1[J]. Nucleic Acids Research, 1990, 18(20): 6144-6144.
[4]Hamberger B, Hahlbrock K. The 4-coumarate: CoA ligase gene family in Arabidopsis thaliana comprises one rare, sinapate-activating and three commonly occurring isoenzymes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(7): 2209-2214.
[5]Lozoya E, Hoffmann H, Douglas C, et al. Primary structures and catalytic properties of isoenzymes encoded by the two 4-coumarate: CoA ligase genes in parsley[J]. European Journal of Biochemistry, 1988, 176(3): 661-667.
[6]范丙友, 陆 海, 蒋湘宁. 维管植物4-香豆酸: 辅酶A连接酶(4CL)研究进展[J]. 林业科学, 2007, 43(2): 96-103.
[7]Lu H, Zeng Q Y, Zhao Y L, et al. Xylem-specific expression of a GRP1.8 promoter::4CL gene construct in transgenic tobacco[J]. Plant Growth Regulation, 2003, 41(3): 279-286.
[8]韩 欣. 马尾松木质素合成途径中4CL基因克隆及RNA干扰载体构建研究[D]. 长沙: 中南林业科技大学, 2012.
[9]侯思宇, 赵盖超, 刘荣华, 等. 苦荞Ft4CL基因克隆、生物信息学及分子进化分析[J]. 山西农业大学学报(自然科学版), 2015, 35(1): 411-415.
[10]胡尚连, 曹 颖, 黄胜雄, 等. 慈竹4CL基因的克隆及其生物信息学分析[J]. 西北农林科技大学学报(自然科学版), 2009, 37(8): 204-210.
[11]霍 松, 陈 慧, 朱琼华, 等. 象草4CL基因片段的克隆及RNAi表达载体构建[J]. 草业学报, 2012, 21(1): 296-301.
[12]李珊珊. 香鳞毛蕨4CL基因家族的克隆及功能验证[D]. 哈尔滨: 东北农业大学, 2015.
[13]刘文哲. 紫穗槐UGPase和4CL基因的克隆及在植物中的转化与表达[D]. 大连: 大连理工大学, 2002.
[14]龙松华, 李 翔, 陈 信, 等. 亚麻4CL基因克隆及RNAi遗传转化[J]. 西北植物学报, 2014, 34(12): 2405-2411.
[15]母洪娜, 孙陶泽, 徐 晨, 等. 桂花(Osmanthus fragrans Lour.)4-香豆酸辅酶A連接酶(4CL)基因克隆与表达分析[J]. 分子植物育种, 2016, 14(3): 536-541.
[16]倪志勇, 王 娟, 吕 萌, 等. 棉花4-香豆酸辅酶A连接酶基因克隆及原核表达[J]. 西北植物学报, 2010, 30(3): 429-436.
[17]杨冬梅, 王学敏, 高洪文, 等. 东方山羊豆4香豆酸: 辅酶A连接酶(4CL)基因的克隆和荧光定量表达分析[J]. 草地学报, 2010, 18(4): 533-538.
[18]Hu W J, Kawaoka A, Tsai C J, et al. Compartmentalized expression of two structurally and functionally distinct 4-coumarate: CoA ligase genes in Aspen (Populus tremuloides)[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95 (9): 5407-5412.
[19]Ehlting J, Buéttner D, Wang Q, et al. Three 4-coumarate: Coenzyme A ligases in Arabidopsis thaliana represent two evolutionary classes in angiosperms[J]. Plant Journal, 1999, 19(1): 9-20.
[20]黄胜雄, 胡尚连, 孙 霞, 等. 木质素生物合成酶4CL基因的遗传进化分析[J]. 西北农林科技大学学报(自然科学版), 2008, 36(10): 199-206.
[21]Stuible H P, Buttner D, Ehlting J. Mutational analysis of 4-coumarate: CoA ligase identifies functionally important amino acids and verifies its close relationship to other adenylate forming enzymes[J]. FEBS Letters, 2000, 467(1): 117-122.
[22]Lai Z X, Lin Y L. Analysis of the global transcriptome of longan (Dimocarpus longan Lour.) embryogenic callus using illumina paired-end sequencing[J]. BMC Genomics, 2013, 14(1): 561.
[23]Zimmerman J L. Somatic embryogenesis: A model for early development in higher plants[J]. Plant Cell, 1993, 5(10): 1411-1423.
[24]Lin Y L, Min J M, Lai R L, et al. Genome-wide sequencing of longan (Dimocarpus longan Lour.) provides insights into molecular basis of its polyphenol-rich characteristics[J]. Gigascience, 2017, 6(5): 1-14.
[25]Chen Y K, Xu X P, Liu Z X, et al. Global scale transcriptome analysis reveals differentially expressed genes involve in early somatic embryogenesis in Dimocarpus longan Lour.[J]. BMC genomics, 2020, 21(1): 4.
[26]Lin Y L, Lai Z X. Comparative analysis reveals dynamic changes in miRNAs and their targets and expression during somatic embryogenesis in Longan (Dimocarpus longan Lour.)[J]. PLoS One, 2013, 8(4): e60337..
[27]杨 婧, 黄 原, 汪晓阳. 直系同源基因的识别方法与数据库[J]. 生命科学研究, 2013, 17(3): 274-277.
[28]Gui J S, Shen J H, Li L G. Functional characterization of evolutionarily divergent 4-coumarate: Coenzyme A ligases in rice[J]. Plant Physiology, 2011, 157(2): 574-586.
[29]Zhang C H, Ma T, Luo W C, et al. Identification of 4CL genes in desert poplars and their changes in expression in response to salt stress [J]. Genes, 2015, 6(3): 901-917.
[30]Naik P, Wang J P, Sederof R. Assessing the impact of the 4CL enzyme complex on the robustness of monolignol biosynthesis using metabolic pathway analysis[J]. PLoS One, 2018, 13(3): 0193896.
[31]Li J L, Han G L, Sun C F, et al. Research advances of MYB transcription factors in plant stress resistance and breeding[J]. Plant Signaling & Behavior, 2019, 14 (8): 16131131.
[32]張婧娴, 赵淑娟. 转录因子MYB在光诱导的苯丙烷次生代谢中的作用[J]. 药物生物技术, 2015, 22(5): 461-464.
[33]杨 雪, 雒 军, 王引权. 调控植物黄酮类化合物生物合成的MYB转录因子研究进展[J]. 甘肃中医药大学学报, 2018, 35(6): 77-81.
[34]王军妮, 黄艳红, 牟志美, 等. 植物次生代谢物黄酮类化合物的研究进展[J]. 蚕业科学, 2007, 33(3): 499-505.
[35]王岸娜, 向 琳, 吴 立. 果蔬中黄酮类物质的研究进展[J]. 河南工业大学学报(自然科学版), 2019, 40(3): 118-125.
[36]李春香, 周 燮. MeJA对大蒜鳞茎膨大及内源激素含量的影响[J]. 生命科学研究, 2002, 6(2): 183-185.
[37]Zhang J, Xue B Y, Gai M Z, et al. Small RNA and transcriptome sequencing reveal a potential miRNA-mediated interaction network that functions during somatic embryogenesis in Lilium pumilum DC. Fisch.[J]. Frontiers in Plant Science, 2017, 8: 566.
[38]Kumar V, Van Staden J. New insights into plant somatic embryogenesis: an epigenetic view [J]. Acta Physiologiae Plantarum, 2017, 39(9): 194.
[39]Li Y, Kim J I, Pysh L, et al. Four isoforms of Arabidopsis thaliana 4-coumarate: CoA ligase (4CL) have overlapping yet distinctroles in phenylpropanoid metabolism[J]. Plant Physiology, 2015, 169(4): 2409-2421.
[40]康国章, 孙谷畴, 王正询. 水杨酸在植物抗环境胁迫中的作用[J]. 广西植物, 2004, 24(2): 178-183.
[41]傅梅萍. 植物激素ABA/GA代谢与响应通路基因表达在秋茄(Kandelia obovata)显胎生过程中的调控作用[D]. 厦门: 厦门大学, 2018.
[42]李 丽, 董银卯, 姚 霞, 等. 茉莉酸甲酯对植物酚类成分代谢影响研究进展[J]. 中药材, 2014, 37(11): 2109-2112.
[43]焦蒙丽. 水杨酸和茉莉酸甲酯对丹参培养细胞迷迭香酸生物合成的诱导作用[D]. 杨凌: 西北农林科技大学, 2012.
[44]Sun H Y, Li Y, Feng S Q, et al. Analysis of five rice 4-coumarate: Coenzyme A ligase enzyme activity and stress response for potential roles in lignin and favonoid biosynthesis in rice[J]. Biochemical Biophysical Research Communications, 2013, 430 (3): 1151-11156.
[45]Hossain M A, Bhattacharjee S, Armin S M, et al. Hydrogen peroxide priming modulates abiotic oxidative stress tolerance: insights from ROS detoxification and scavenging[J]. Frontiers in Plant Science, 2015, 6: 420.
[46]Jain G, Gould K S. Are betalain pigments the functional homologues of anthocyanins in plants?[J]. Environmental and Experimental Botany, 2015, 119: 48-53.
[47]Sun S C, Xiong X P, Zhang X L, et al. Characterization of the Gh4CL gene family reveals a role of Gh4CL7 in drought tolerance[J]. BMC Plant Biology, 2020, 20, DOI: 10.21203/rs.2.17480/v3.
[48]Rowe J H, Topping J F, Liu J, et al. Abscisic acid regulates root growth under osmotic stress conditions via an interacting hormonal network with cytokinin, ethylene and auxin [J]. New Phytologist, 2016, 211(1): 225-239.
責任编辑:谢龙莲
