帕金森病患者睡眠障碍与精神症状相关性研究☆
2021-06-15王治东孙文华马建军石小雪栗铭检黄珅胡世玉郑晋华
王治东 孙文华 马建军※ 石小雪 栗铭检 黄珅 胡世玉 郑晋华※
帕金森病(Parkinson disease,PD)是一种常见的神经系统慢性退行性疾病,临床上除表现为运动缓慢、肌张力增高和静止性震颤等运动症状之外,常伴有感觉障碍、自主神经功能障碍、睡眠障碍、精神障碍等非运动症状[1]。一项PD患者队列研究中,64%PD患者出现睡眠障碍,并早于运动症状出现[2]。近年国外研究显示,焦虑、抑郁等精神症状可影响PD患者运动及非运动症状,且睡眠障碍与精神症状密切相关[3-4]。而国内关于PD睡眠障碍与精神症状相关的研究较少。因此本研究通过评估PD住院患者睡眠障碍特点及睡眠障碍与精神症状的相关性,进一步了解疾病发展规律,为PD患者睡眠障碍的防治提供依据。
1 对象与方法
1.1 研究对象 选取2017年9月至2019年12月在河南省人民医院神经内科住院的PD患者。纳入标准:①符合中国帕金森病诊断标准(2016版)[5];②简易精神状态检查量表(mini-mental state examination,MMSE)评分>24分。排除标准:①文盲、色盲、语言障碍,或其他原因无法沟通者;②存在脑血管疾病、脑炎、颅脑外伤及相关脑血管病手术者;③服用利血平、氟桂利嗪、桂利嗪等药物及其他代谢原因所致的继发性帕金森综合征、帕金森叠加综合征;④正在服用镇静催眠类等影响睡眠药物;⑤患有其他精神疾病;⑥患恶性肿瘤及其他严重疾病。共纳入359例原发性PD患者,均为汉族。本研究得到河南省人民医院伦理委员会批准,所有研究对象均签署知情同意书。
1.2 研究方法 在患者入组时进行资料采集和量表评估。所有量表由神经内科医师评定,评定者均经过相关量表专业培训。
1.2.1 一般资料采集 记录患者的一般资料,包括性别、年龄、文化程度、病程等。
1.2.2 睡眠状况评估 采用匹茨堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)量 表 评 价 睡眠质量,PSQI量表分为睡眠质量、入睡时间、睡眠时间、睡眠效率、夜间睡眠障碍、服用催眠药物、日间功能障碍等7个因子,总分≥7分为存在睡眠障碍[6]。采用日间过度嗜睡评定量表(Epworth sleepiness scale,ESS)评估患者日间过度嗜睡(excessive daytime sleepiness,EDS)的发生情况。
1.2.3 运动及非运动症状评估 采用PD统一评定量表第三部分(the third part of the unified Parkinson disease rating scale,UPDRS-Ⅲ) 对主要运动症状进行评估。采用Hoehn-Yahr(H-Y)分级量表对病情严重程度进行评估,分为1~5级,其中1~2级为轻度,2.5~3级为中度,4~5级为重度[7]。非运动症状评价量表(non-motor symptoms scale,NMSS)评价非运动症状程度及频率。采用帕金森生活质量问卷(39-item Parkinson's disease questionnaire,PDQ-39)对患者日常生活质量进行评价。
1.2.4 神经精神症状评估 分别采用汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)和24项汉密尔顿抑郁量表(24-item Hamilton depression scale,HAMD-24)评定患者焦虑和抑郁情绪。采用修订的情感淡漠评定量表(modified apathy evaluation scale,MAES)评定淡漠症状,该量表共14个条目,分值>14分为情感淡漠[8]。采用PD冲动控制障碍行为评分量表(questionnaire for impulsive-compulsive disorders in Parkinson's disease-rating scale,QUIP-RS)[9]对冲动控制障碍(impulsive-compulsive disorders,ICDs) 进行评估,QUIP-RS 是用于评估PD患者ICDs严重程度的量表,涉及1个月内病理性赌博、冲动性购物、强迫性进食、强迫性性行为、刻板动作、特殊嗜好等28个条目,总分越高代表疾病越严重。
1.3 统计学方法 应用SPSS 22.0进行统计分析。年龄及各量表评分等正态分布,以±s描述,两组间比较采用独立样本t检验;HAMA评分非正态分布,以 M(QL,QU)描述,两组间比较采用Mann-Whitney U检验;性别、H-Y分级中重度患者数以构成比(%)描述,组间比较采用检验。采用Spearman相关分析PQSI、ESS与神经精神症状各量表评分相关性。检验水准α=0.05,双侧检验。
2 结果
2.1 一般资料及运动、非运动症状 359例PD患者中PSQI≥7分者209例,睡眠障碍发生率58.22%。PD-SD组与PD-NSD组性别、受教育时间差异无统计学意义(P>0.05),PD-SD组较PDNSD 组年龄更大(t=3.442,P=0.001),病程更长(t=3.863,P=0.001),H-Y 分级中重度者更多(=22.515,P<0.001),UPDRS- Ⅲ 评 分 (t=3.714,P=0.001)、NMSS 评分(t=9.981,P<0.001)、PDQ-39 评分(t=8.303,P<0.001)均更高。 见表 1。

表1 两组一般资料及运动、非运动症状
2.2 神经精神症状 PD-SD组HAMA评分 (Z=8.055,P<0.001)、HAMD 评分(t=11.075,P<0.001)、MAES 评分(t=7.445,P<0.001)较 PD-NSD 组高,QUIP-RS评分两组差异无统计学意义(t=1.127,P=0.063)。见表 2。

表2 两组神经精神症状
2.3 睡眠障碍与精神症状相关性 PD患者PSQI总分与 HAMA(r=0.445,P=0.011)、HAMD-24(r=0.559,P=0.006)、MAES(r=0.504,P=0.007)正相关,且 PSQI因子分多数与 HAMA、HAMD-24、MAES具有相关性(P<0.05)。患者ESS评分与HAMD-24(r=0.471,P=0.009)、MAES(r=0.522,P=0.006)呈正相关。见表3。
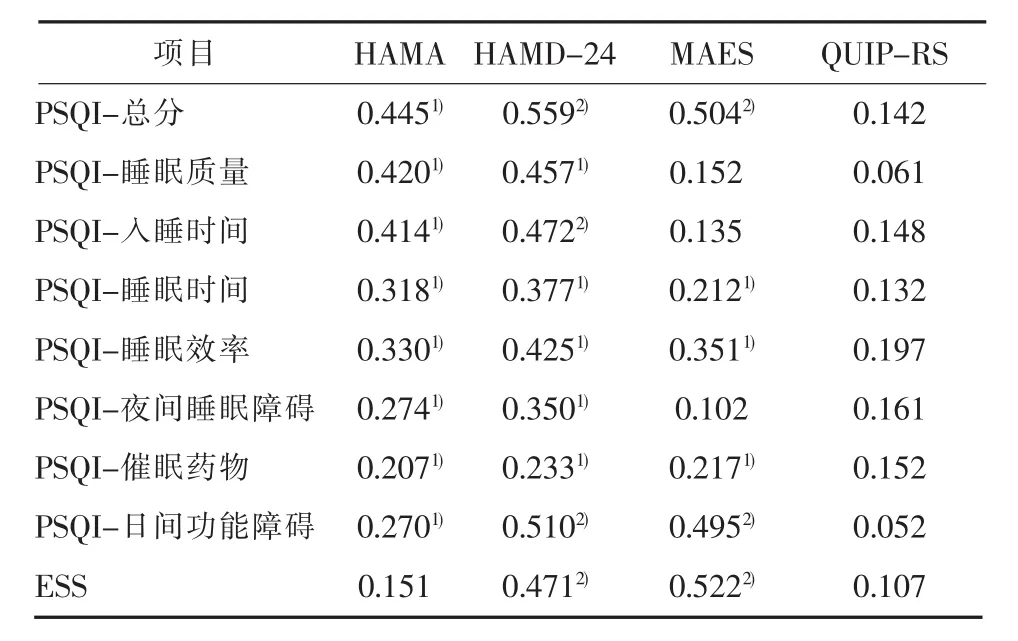
表3 睡眠障碍与精神症状相关性(r)
3 讨论
睡眠障碍是PD患者常见的非运动症状之一,PD的睡眠障碍包括失眠、EDS和快速眼动期睡眠行为障碍(rapid eyes movement sleep behavior disorder,RBD)等[10]。睡眠障碍的发生率随PD病程延长而增加[11]。既往研究提示,年龄是PD睡眠障碍的相关因素之一[12-13]。本研究结果提示,PD患者睡眠障碍发生率为58.22%,且PD-SD组年龄及病程均高于PD-NSD组,与以往研究结果相似[14-15]。同时,PD-SD组H-Y分级中重度比例显著高于PD-NSD组,提示睡眠障碍不是单独发生,而与PD疾病进展也相关。本研究还显示,PD-SD组运动症状、非运动症状均较严重,日常生活能力明显下降,提示睡眠障碍对运动症状、非运动症状均可能产生不利影响,并显著降低患者生活质量。
PD患者常出现焦虑、抑郁等精神症状,其中情感淡漠、ICDs在PD临床症状中越来越受到重视[16]。本研究结果显示PD-SD组焦虑、抑郁、情感淡漠症状严重程度较PD-NSD组升高,提示睡眠障碍出现与精神症状的发生可能存在潜在联系。而PD睡眠障碍对精神症状的影响机制尚不明确,有研究认为睡眠障碍可引起多巴胺、乙酰胆碱等神经递质的改变[17],一方面促进多巴胺能神经元变性并累及不同脑功能区,另一方面这些神经递质的改变可导致患者情绪调控网络变化,继而产生不同类型的精神症状。
焦虑、抑郁症状在PD患者中发生率高且常合并存在。本研究结果提示,焦虑与睡眠障碍有关,且与入睡困难关联最强。既往研究显示,PD伴焦虑症状的发生机制与患者边缘系统多巴胺能和去甲肾上腺素能神经元减少、脑内神经递质改变有关[18],而神经递质紊乱常引起夜间皮层兴奋性改变而导致失眠等睡眠障碍。此外,本研究结果提示PD伴抑郁症状与入睡困难、EDS均有关。但KAY等[19]研究表明抑郁仅与PD患者入睡困难严重程度有关,与EDS无关联。上述结果不一致的原因可能为KAY等[19]研究排除了晚期PD患者,伴有EDS的患者比例下降。PD患者夜间、日间睡眠障碍均在病程晚期对生活质量产生严重影响,本研究同时采用PSQI量表与ESS量表评估,结果表明抑郁症状与二者均具有相关性,提示在PD非运动症状诊疗中应注重抑郁症状与睡眠障碍的伴随发生情况及先后关系。另有脑功能研究也提示,PD伴抑郁患者双侧楔前叶功能连接增高[20],而该功能区域参与监测内外环境及维持意识知觉,进一步说明了PD伴抑郁症状患者引发EDS可能的机制。当晚期患者同时出现EDS、夜间睡眠障碍且治疗效果不佳,对抑郁情绪进行治疗可能会改善患者睡眠质量。
本研究结果提示,MAES与PSQI中夜间睡眠因子评分及EDS评分均有关,这与既往研究结果一致[21]。PD淡漠的发生与脑内多巴胺能水平降低有关,且研究提示PD伴淡漠患者右侧额下回、额中回、下丘脑葡萄糖代谢降低[22],其中下丘脑视交叉上核控制睡眠节律,推测淡漠与EDS的关联可能与视交叉上核功能下降有关。此外,研究还显示PD伴淡漠患者易合并ICDs、焦虑症状[3],可增加睡眠障碍的严重程度。在PD非运动症状进程中,淡漠症状过早出现对睡眠障碍的发生可能具有提示意义,临床诊疗中应注意PD患者情感淡漠的发生情况,及时进行干预。
ICDs为PD患者另一伴发精神症状。研究表明ICDs可降低生活质量并增加疾病负担,且睡眠片段化可能诱导冲动行为的发生[23]。本研究采用QUIP-RS评估ICDs症状,可准确评定其严重程度[24]。结果提示ICDs与睡眠障碍无关,与既往研究结果一致[25]。但 FIGORILLI等[26-27]研究表明,ICDs与睡眠质量相关,且RBD可能是ICDs的危险因素之一。本研究采用PSQI量表对睡眠障碍严重程度进行评定,但缺乏对RBD的定性诊断,而RBD在ICDs发生中可能充当重要角色,从而导致上述结果差异。因此睡眠障碍与ICDs的关联及病理生理机制需要进一步研究来证实。
总之,睡眠障碍与精神症状是PD发展过程中的常见非运动症状,不同类型精神症状与睡眠障碍相关。推测PD睡眠障碍可能为精神症状发生的潜在影响因素,同时精神症状的出现可加重EDS与入睡困难。故应对PD患者睡眠障碍及精神症状进行综合干预。本研究对象主要来自住院患者,未纳入就医心理不同的门诊患者,该部分PD患者精神症状发生情况有其特殊性,存在一定的选择偏倚,今后需扩大样本量进一步深入研究。
