ELOVL6基因基于Nod样受体蛋白3通路与大动脉粥样硬化性脑梗死风险的研究☆
2021-06-15柳华刘信东罗丹阳聂毅季一飞刘伟
柳华 刘信东 罗丹阳 聂毅 季一飞 刘伟
缺血性脑卒中(ischemic stroke,IS)约占所有卒中80%[1-2]。大动脉粥样硬化是IS常见病因[3],发病具有一定的遗传背景[4],因此,动脉粥样硬化相关易感基因研究成为IS发病机制研究热点。已有文献报告,超长链脂肪酸延伸酶家族成员6(elongase of very long chain fatty acids family mem ber 6,ELOVL6)基因参与了动脉粥样硬化的形成[5]。我们前期研究发现,ELOVL6基因可能与大动脉粥样硬化脑梗死(large-artery atherosclerosis stroke,LAA)发病相关[6],然而,这种相关性的内在机制仍不清楚。研究发现,炎症是动脉粥样硬化重要的病理生理机制,参与动脉壁病变发生发展的各个环节[7-8]。而ELOVL6基因可以促使由Nod样受体蛋白 3(nod-like receptor protein 3,NLRP3)炎性体的激活[9],从而促发炎症反应。因此,推断ELOVL6基因可能通过ELOVL6-NLRP3-炎症因子通路机制参与了大动脉粥样硬化性IS的发病。
1 资料与方法
1.1 研究对象 以2015年1月至2017年12月在本院神经内科住院IS患者为研究对象。纳入标准:①年龄19~70岁;②患者符合世界卫生组织IS诊断标准[10];③TOAST分型为LAA;④患者彼此间无血缘关系。排除标准:①有明确原因的继发性脑梗死患者;②合并严重肝肾功能不全、感染性疾病、恶性肿瘤及其他严重疾病患者。选择同期体检的年龄、性别匹配健康人群作为对照组。研究对象具体情况及一般资料见前期研究[6]。本研究经川北医学院医学伦理委员会批准[批号:NSMC(2017)015]。
1.2 研究方法
1.2.1 血液样本准备 随机选取上述研究样本病例组和对照组各10例,病例组年龄(59.72±8.17)岁;对照组年龄(59.30±8.32)岁,抽取人群外周静脉血,每例10 mL,肝素抗凝,每一个样本分装为2份,分别进行ELOVL6 siRNA干扰和非干扰,用于4 个炎症指标(IL-1β、IL-6、IL-8、TNF-α)的蛋白定量及2个基因(ELOVL6、NLRP3)的mRNA和蛋白表达量分析。
1.2.2 ELOVL6、NLRP3基因mRNA表达分析 采用实时荧光定量PCR的方法检测mRNA表达。使用SYBRPremix Ex TaqTM试剂盒(RR820A, 日本Takara公司)进行3重复的定量PCR检测,ELOVL6引物:正向5'-TCAACGAGAATGAAGCCATCCA-3',反向 5'-TTAGGTGCCGACCACCGAATA-3';NLRP3引物:正向 5'-GATCTTCGCTGCGATCAACAG-3',反向 5'-CGTGCATTATCTGAACCCCAC-3'。反应条件为 95℃ 1 min;随后40 个循环(95℃ 5 s,60℃30 s),在7300实时PCR系统上进行扩增并实时收集数据。 用 2-ΔΔCT计算 ELOVL6、NLRP3 mRNA 相对表达量。
1.2.3 蛋白质印迹法(western blotting,WB)检测蛋白表达量 采用WB检测样本人群外周血中4种炎症细胞因子:白细胞介素(interleukin,IL)-1β、IL-6、IL-8 和肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)以及 2 种基因(ELOVL6、NLRP3)的蛋白定量。具体步骤简述如下:①总蛋白提取(凯基全蛋白提取试剂盒)(KGP2100,江苏凯基生物技术股份有限公司);②蛋白定量(凯基BCA蛋白定量试剂盒)(E162-01,江苏凯基生物技术股份有限公司);③蛋白变性:将已测浓度的蛋白溶液按照3:1上样缓冲液,混匀,煮沸10 min,冷却至室温,-20℃保存;④电泳;⑤转膜;⑥封闭:将转膜完成的聚偏二氟乙烯膜放入事先配制好的封闭液(5%脱脂奶粉)中,封闭1 h。一抗兔抗人抗体(抗IL-1β、IL-6、IL-8、TNF-α、ELOVL6 和 NLRP3)(英国 Abcam 公司)浓度为 1:1000,内参GAPDH(ab181602,英国 Abcam 公司)为 1:4000,二抗羊抗兔 (ab205718,英国Abcam公司),浓度为1:6000,其余无特殊要求;⑦ 增强型化学发光反应显色;⑧UVP软件统计具体灰度值。
1.2.4 siRNA干扰ELOVL6基因 外周血单核细胞分离培养:①4 mL血液+4 mL PBS,加入到4 mL淋巴细胞分离液表面(DKW-KLSH-0400,深圳市达科为生物);②离心;③吸取淋巴细胞层,加入PBS至6 mL,离心,去上清,清除淋巴分离液;④2 mL含血清的培养基 (含10%胎牛血清,1640完全培养基)重悬,加入到6孔板中;⑤6 h后去上清液;⑥保留贴壁即为单核细胞。
实时观察后,18 h后开始转染实验(阴性对照:6-羧基荧光素),步骤如下:①粉剂(siRNA)(ELOVL6基因转染正向引物:5'-CUGGUGCUUAUAUGGUGUATT-3', 反 向 引 物 :5'-UACACCAUAUAAGCACCAGTT-3')1 管(吸光度值 0.5)用焦碳酸二乙酯配成浓度2.2 μmol/L的工作液;②1 μL工作液+200 μL无血清 1640培养基,混匀;③加入 5 μL 转染试剂(polyplus),混匀,室温孵育10 min;④加入到2 mL含10%血清1640培养基中,混匀;⑤6 h后,观察转染效果(图 1、2),更换含10%血清1640培养基,24 h收细胞。

图1 siRNA转染ELOVL6基因Image Pro Plus摄像 (蓝光激发400×) A:5 μL 转染试剂;B:10 μL 转染试剂。 箭头示 siRNA 转染进入细胞。
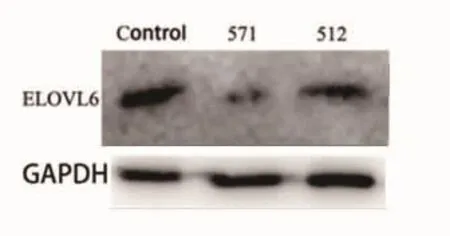
图2 ELOVL6基因siRNA转染后蛋白表达 571和512分别代表ELOVL6基因siRNA干扰不同的引物序列。571及512 siRNA效果显著(571转染效率为90.48%;512为65.41%),基本达到沉默效果。
1.3 统计学方法 采用SPSS 21.0进行统计分析。计量数据符合正态分布,采用±s表示,组间比较使用独立样本t检验或多因素方差分析;计数数据采用χ2检验;相关性比较使用Pearson相关分析检测。检验水准为α=0.05,双侧检验。
2 结果
2.1 ELOVL6 mRNA和蛋白表达分析 病例和对照样本ELOVL6基因在外周血的mRNA表达水平分别为 0.0011±0.0003、0.0005±0.0003,蛋白定量分别为 0.801±0.347、0.451±0.193, 病例样本ELOVL6 mRNA(t=-3.919,P=0.001)和蛋白表达水平(t=2.250,P=0.041)更高,差异具有统计学意义(图3)。
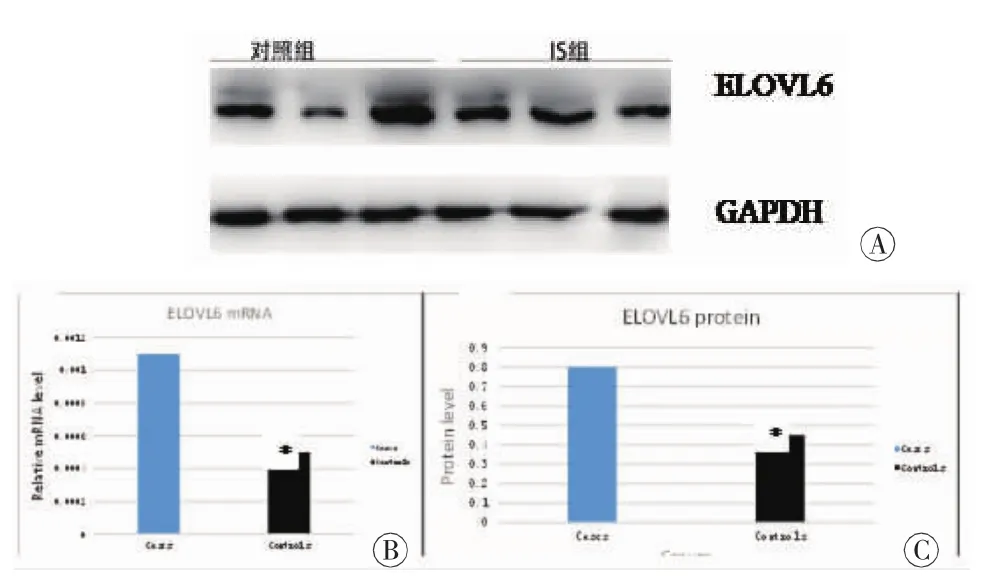
图3 ELOVL6基因在病例样本和对照样本中的蛋白表达示意图A:两组WB结果;B:两组之间ELOVL6基因mRNA表达量;C:两组之间ELOVL6基因蛋白定量;*:比较具有统计学意义 (P<0.05)。IS为LAA样本。
2.2 NLRP3基因的mRNA及蛋白表达分析 分析了病例和对照样本外周血中NLRP3基因mRNA表达水平和蛋白定量,发现在病例样本,NLRP3基因mRNA水平和蛋白定量都较对照组增加,差异有统计学意义(mRNA:0.049±0.015 vs.0.003±0.002,t=3.096,P=0.011; 蛋白定量:0.897±0.346 vs.0.406±0.339,t=2.768,P=0.015)(图 4)。
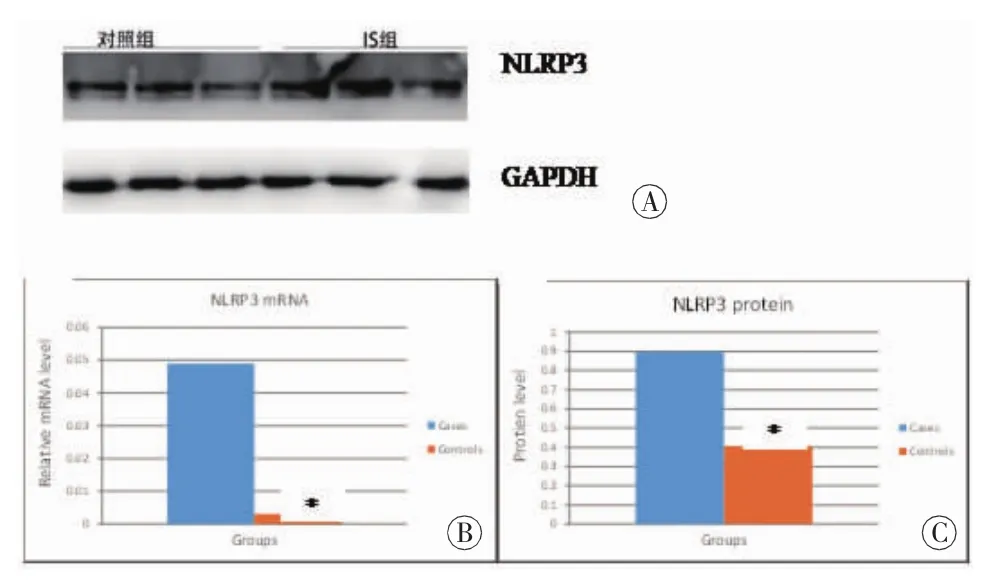
图4 WB检测NLRP3基因在病例样本和对照样本中的蛋白表达示意图 A:两组WB结果;B:两组之间NLRP3基因mRNA表达量;C:两组之间NLRP3基因蛋白定量;*:比较具有统计学意义(P<0.05)。IS为 LAA样本。
2.3 炎症指标蛋白定量表达分析
2.3.1 炎症因子表达情况 在病例样本,IL-6和TNF-α表达量高于对照样本 (IL-6:1.087±0.178 vs.0.507±0.094;t=2.385,P=0.032;TNF-α:0.600±0.092 vs.0.196±0.044; t=3.252,P=0.006); 然而,IL-8和 IL-1β表达无统计学差异(IL-8:0.696±0.158 vs.0.357±0.085;t=1.566,P=0.140;IL-1β:0.814±0.122 vs.0.744±0.100;t=0.398,P=0.696)。
2.3.2 ELOVL6基因与炎症因子的关系分析 单独在病例或对照样本中进行ELOVL6基因干扰前后炎症因子表达水平分析,并分析病例组和对照人群进行了ELOVL6基因siRNA干扰后,两组之间的炎症因子表达水平,都没有发现炎症因子的表达有统计学差异(表1)。

表1 ELOVL6基因与炎症因子表达分析
2.3.3 NLRP3基因与炎症因子的关系分析 在病例组,IL-1β(r=0.937,P<0.001)、IL-6(r=0.723,P=0.018)和 TNF-α(r=0.672,P=0.033)与 NLRP3 基因蛋白表达具有正相关性,但没有发现IL-8与NLRP3具有相关性相关系数 (r=0.587,P=0.075)(图5)。在对照样本中没有发现NLRP3基因与炎症因子表达之间具有统计学相关关系(P>0.05)。

图5 NLRP3基因与炎症因子蛋白定量的相关性分析散点图 A~C:IL-1β、IL-6和TNF-α与NLRP3具有正相关性 (P<0.05);D:IL-8与NLRP3没有统计学相关性(P=0.075)。
2.4 ELOVL6基因与NLRP3基因表达的相关分析 本研究发现,在病例样本中,无论是否存在ELOVL6基因siRNA干扰,ELOVL6基因都与NLRP3基因蛋白表达具有正相关性(无siRNA干扰:r=0.785,P=0.007; 采用 siRNA 干扰:r=0.677,P=0.031)。
在病例样本中,在ELOVL6基因干扰的情况下,NLRP3基因无论是 mRNA(干扰前/干扰后:0.049±0.015 vs.0.002±0.001;t=-3.147,P=0.010)或蛋白表达水平(干扰前/干扰后:0.897±0.346 vs.0.399±0.081;t=-3.663,P=0.002)都减低。
3 讨论
本研究发现,LAA患者外周血ELOVL6基因、NLRP3基因mRNA及蛋白水平表达更高,IL-6和TNF-α炎症因子表达更多,NLRP3基因与IL-1β、IL-6和TNF-α炎症因子表达具有正相关性,而ELOVL6基因与NLRP3基因表达具有密切正相关性。目前尚未见类似研究。
神经炎症一直以来都被认为是脑缺血发病和死亡的主要原因,是脑缺血主要的病理生理学机制[11-12]。脑缺血后,TNF-α、IL-1和 IL-6等炎性细胞因子很快就从受损组织产生和分泌,并调节炎症反应,导致缺血脑组织的损伤[13-14]。在脑梗死早期,病灶周围小胶质细胞TNF-α和IL-1上调参与了脑炎症的进程[15]。通过研究人们进一步认识到,在脑细胞损伤过程,NLRP3炎性体被确认为是一种关键成分[16],在缺血后炎症因子的介入中起着重要作用。NLRP3的下游炎症因子,包括胱天蛋白酶-1、IL-6和IL-1β,是大鼠大脑原代皮质神经元缺血状态下产生的主要因子[17-18]。NLRP3炎性体结构和表达的异常会影响脑梗死的进展。在糖氧剥夺离体脑缺血模型、大脑中动脉缺血(或全脑缺血性损伤中,研究发现NLRP3炎性体和其他的前炎性细胞因子被激活[19]。在糖氧剥夺处理的细胞中,NLRP3、IL-1和 TNF-α表达增加[20]。在大脑中动脉缺血模型24 h后,NLRP3炎性体的表达导致产生更多活化胱天蛋白酶-1和IL-1β,TNF-α蛋白定量在大脑中动脉缺血组表达比假手术组高10倍[21],TNF-α mRNA表达水平增加了190%,NLRP3 mRNA增加了130%,IL-6 mRNA增加了160%[22]。
NLRP3、IL-1β、TNF-α 和 IL-6 之间具有复杂的相互关系。IL-1β是一个重要的前炎症细胞因子,它能增强TNF-α和IL-6的产生[23]。NLRP3炎性体激活是重要的固有免疫通路,它对IL-1β的激活起着关键作用,被认为是神经系统炎症发展的关键参与者[24]。另外,病灶局部TNF-α和IL-6的释放能引起粒细胞穿过血脑屏障聚集和放大炎症反应,结果促进神经炎症进程[25],TNF受体家族的下游事件是细胞程序性坏死,TNF也能和程序性坏死交互作用而诱使炎症体激活[26]。近期在研究NLRP驱动肝脏炎症和纤维化的相关机制中发现,TNF是NLRP3的关键效应分子,并且对于IL-1β具有正反馈作用[27]。
动脉粥样硬化是LAA的主要病理生理机制,而动脉粥样硬化本质上是脂质驱动的慢性炎症性疾病,基本机制是炎症因子和炎症消除机制的不平衡[28-29],NLRP3炎性体激活及NLRP3-炎症因子信号通路在动脉粥样硬化的发生和进展过程中起了重要作用[29]。
本研究发现ELOVL6基因与NLRP3基因表达具有密切正相关性。既往研究也表明,ELOVL6基因能影响 NLRP3炎性体的激活[9,30]和IL-1β的释放[9]。我们有理由推测,ELOVL6基因可能通过NLRP3炎性体信号通路参与了LAA发病和继之的缺血脑损伤。
综上所述,我们认为,ELOVL6-NLRP3-炎症因子通路可能参与了LAA发病,抑制这种通路或许是一种有希望的治疗策略。
