Co3O4/γ-Al2O3催化剂的制备、表征及其在乙醇还原胺化合成乙胺反应中的性能
2021-06-15刘峻豪许立信
刘峻豪,徐 蒙,万 超,许立信
(1. 安徽工业大学 化学与化工学院,安徽 马鞍山 243000;2. 安徽工业大学 工程研究院,安徽 马鞍山 243000)
脂肪胺是重要的化工中间体,广泛应用在医药、农药、染料、萃取剂等化学品的合成和生产中[1-2]。脂肪胺的生产方法主要包括脂肪醇还原胺化法[3]、脂肪腈加氢法[4]、烯烃直接胺化法[5]、脂肪酸胺化法[6]和卤代烃胺化法[7]等。由于脂肪醇价格低廉,脂肪醇还原胺化反应的副产物主要为水[8],因此该方法成为合成脂肪胺的主要方法之一。
催化剂是脂肪醇还原胺化的关键,目前已报道的催化剂主要有固体酸催化剂(Al2O3,SiO2,ZSM-5)、贵金属催化剂(主要为负载型Au,Pt,Pd,Ru,Ir催化剂)和非贵金属催化剂(主要为负载型Ni,Co催化剂)三大类[9-17]。固体酸催化剂所需反应条件严格,副反应较多,已较少使用;贵金属催化剂虽然反应性能良好,但价格高昂,因此非贵金属催化剂越来越受关注。Cuypers等[18]采用负载型Ni/Al2O3催化剂将苯酚还原胺化,环已胺的选择性较高。Wang等[19]制备了Ni/USY催化剂,用于1-辛醇还原胺化,1-辛醇的转化率为76%、1-辛胺的选择性接近90%。Yue等[20]制备了Co/La3O4催化剂,用于1,2-丙二醇还原胺化反应,1,2-丙二醇的转化率为68.6%、丙二胺选择性为97.8%。Zhang等[21]通过浸渍法制备了Co/H-ZSM-5催化剂,在乙醇还原胺化反应中表现出良好的活性。Cho等[22-23]制备了Ni/γ-Al2O3和Co/γ-Al2O3催化剂,在2-丙醇合成异丙胺反应中,2-丙醇的转化率分别为62.1%和80.3%、异丙胺的选择性分别为78.2%和71.7%。由于Co基催化剂的催化效果优于Ni基催化剂,且负载型Co基催化剂催化胺化乙醇的报道较少,因此选择Co/γ-Al2O3催化剂,考察它催化乙醇还原胺化合成乙胺的性能。
本工作采用过量浸渍法制备了Co3O4/γ-Al2O3催化剂,采用XRD、H2-TPD、H2-TPR、N2吸附-脱附等方法对催化剂进行表征,考察了催化剂催化乙醇还原胺化合成乙胺的性能。
1 实验部分
1.1 实验原料
Co(NO3)2·6H2O、乙醇:分析纯,国药集团化学试剂有限公司;拟薄水铝石:工业级,中国石化催化剂有限公司长岭分公司;氨气:分析纯,南京特种气体厂有限公司。
1.2 催化剂的制备
以5 ℃/min的升温速率升温至500 ℃,恒温4 h,焙烧拟薄水铝石,制得γ-Al2O3载体。配制4 mol/L的硝酸钴水溶液,将γ-Al2O3载体放置在硝酸钴水溶液中搅拌浸渍2 h,浸渍温度为65 ℃。将浸渍后的γ-Al2O3载体在100 ℃下干燥4 h,然后在400℃下焙烧4 h,制得Co3O4/γ-Al2O3催化剂。
根据所制备催化剂使用的拟薄水铝石批次和干燥时间的不同,将催化剂试样记为Cat(n,th),n表示拟薄水铝石批号,t表示干燥时间,h。
1.3 催化剂的评价
催化剂的评价在固定床反应器中进行。催化剂的装填量为2 g,反应前先用N2吹扫整个反应器,排尽反应器中的空气,再用N2检漏。用70 mL/min H2在500 ℃下还原催化剂4 h,然后降至反应温度,在氨与乙醇摩尔比为3∶1的条件下进行反应。
采用杭州浩海科学仪器有限公司的GC99型气相色谱仪分析反应产物。采用上海星铱色谱仪器科技有限公司的HT-1型毛细管色谱柱(30 m×0.32 mm×0.5 μm);FID检测;初始柱温为40 ℃,升温速率为2 ℃/min;进样器和检测器的温度均为130 ℃;进样量为0.5 μL。
1.4 催化剂的表征
采用德国布鲁克公司D8 Advance型X射线衍射仪进行XRD表征,CuKα射线,功率3 kW,管电压40 kV,管电流40 mA,扫描范围2θ=10°~90°,扫描速率8 (°)/min。采用美国麦克仪器公司ASAP 2460型物理吸附仪进行N2吸附-脱附表征,测试前试样在300 ℃下真空处理3 h。
采用美国麦克仪器公司AutoCheml Ⅱ 2920型化学吸附仪进行H2-TPD和H2-TPR测试。H2-TPD测试条件:试样从室温升至300 ℃,干燥预处理1 h,再通入10%(φ)H2/90%(φ)Ar混合气在300 ℃下还原2 h,冷却至50 ℃,用He(50 mL/min)吹扫,除去表面H2至基线稳定,然后进行H2脉冲滴定,直至饱和。H2-TPR测试条件:试样从室温程序升温至300 ℃,进行干燥预处理,用He(50 mL/min)吹扫2 h,然后冷却至50 ℃,通 入10%(φ)H2/90%(φ)Ar混 合 气(50 mL/min)0.5 h,待基线稳定后在10%(φ)H2/90%(φ)Ar气流中以10 ℃/min的升温速率升至800 ℃脱附,用质谱检测脱出气体。
2 结果与讨论
2.1 催化剂的表征结果
2.1.1 XRD表征结果
Co3O4/γ-Al2O3催化剂的XRD谱图见图1,其中Co3O4的特征衍射峰位于2θ=31.3°,37.1°,59.4°,65.3°处(标准PDF卡片76-1802)。由图1可见,催化剂的XRD谱图中均出现了Co3O4衍射峰,说明催化剂的前体Co(NO3)2·6H2O在高温焙烧过程中已经完全分解,并以Co3O4的形式存在于载体的表面。γ-Al2O3的特征衍射峰位于2θ=37.5°,45.7°,60.6°,66.6°处(标准PDF卡片75-1862),催化剂的XRD谱图中均没有明显的γ-Al2O3衍射峰,证明γ-Al2O3被Co3O4覆盖难以检测。根据Scherrer公式进行计算,催化剂试样Cat(1,4 h),Cat(2,4 h),Cat(3,4 h)的Co3O4粒径分别为25, 23,20 nm。XRD表征结果显示,不同批次拟薄水铝石制备的催化剂的晶相结构相差不大。

图1 催化剂的XRD谱图Fig.1 XRD patterns of the catalysts.Cat(n,t h):Co3O4/γ-Al2O3 catalyst,dried with t h and used n batch alumina.
2.1.2 N2吸附-脱附表征结果
醇的胺化催化剂应有适中的比表面积、孔体积、孔径和较高的机械强度。催化剂的比表面积、孔体积、平均孔径见表1。由表1可见,γ-Al2O3,Cat(3,4 h),Cat(3,24 h)的比表面积分别为132,93,88 m2/g,孔体积分别为0.63,0.37,0.38 cm3/g。相对于载体,Co/γ-Al2O3催化剂的比表面积和孔体积有不同程度的降低,且平均孔径增大。这是由于Co3O4堵塞了载体中具有微孔结构的孔道,导致催化剂的比表面积和孔体积减小,平均孔径反而增大[24]。
催化剂的N2吸附-脱附等温曲线如图2所示。由图2可见,根据IUPAC分类,γ-Al2O3载体、Cat(3,4 h)和Cat(3,24 h)催化剂的N2吸附-脱附等温线均为典型的具有H2型回滞环的Ⅳ型等温线。当相对压力在0.75~1.00范围内时,出现明显的毛细管凝结现象,表明试样中有介孔存在,这有利于Co颗粒在载体上的分散。与载体相比,催化剂的回滞环面积减小,但也有明显的介孔结构,说明活性组分Co进入了载体的孔道并负载在孔道内表面。

表1 催化剂的比表面积、孔体积、平均孔径Table 1 Specific surface area,pore volume and average pore diameter of the catalysts

图2 催化剂的N2吸附-脱附等温线Fig.2 N2 adsorption-desorption isotherms of the catalysts.
催化剂的孔径分布如图3所示。由图3可见,Cat(3,4 h),Cat(3,24 h)催化剂的孔径分布和γ-Al2O3载体相比基本没有变化,说明γ-Al2O3载体的大部分孔道没有被Co3O4堵塞。γ-Al2O3载体和催化剂的孔径分布不均匀,集中在10~25 nm之间,进一步说明催化剂试样的孔道主要为介孔。

图3 催化剂的孔径分布Fig.3 Pore size distribution of the catalysts.
2.1.3 H2-TPD表征结果
对Co3O4/γ-Al2O3催化剂进行H2-TPD表征,结果见表2。由表2可知,Co3O4/γ-Al2O3催化剂的金属分散度有所差异。催化剂Cat(1,4 h),Cat(2,4 h),Cat(3,4 h),Cat(3,24 h)的金属分散度分别为4.11%,4.58%,4.99%,5.15%,有效粒子直径分别为24.2,21.8,19.9,19.0 nm。表明不同批次拟薄水铝石制备的γ-Al2O3载体对Co3O4的分散度影响较大。将催化剂在100 ℃干燥,并适当延长干燥时间,孔道中残留的物理吸附水会进一步减少,有助于提高活性组分的分散度。
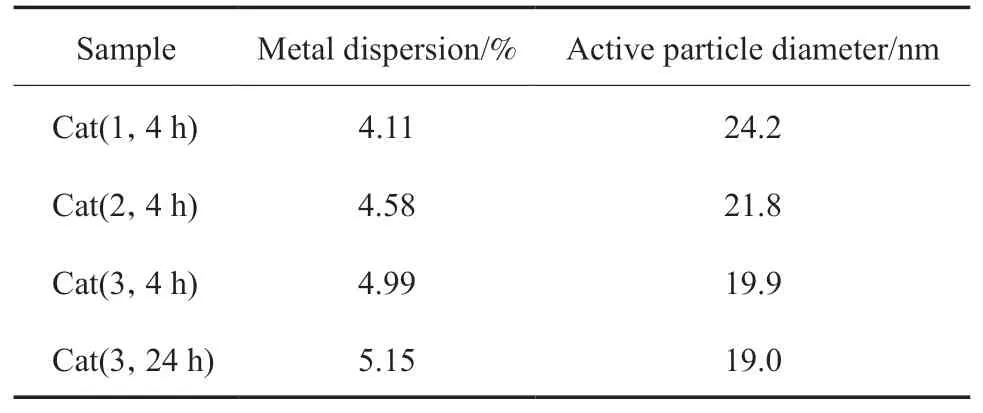
表2 催化剂金属分散度表征参数Table 2 Metal dispersion parameters of different catalysts
2.1.4 H2-TPR表征结果
催化剂的H2-TPR曲线见图4。由图4可见,γ-Al2O3载体没有明显的耗氢峰,说明800 ℃以下载体不会被还原。催化剂均出现两个耗氢峰:在300~400 ℃有一个强耗氢峰,对应催化剂中游离的氧化钴物种的还原,为Co3O4的分步还原Co3+→Co2+→Co0;另一个550 ℃左右的还原峰属于氧化钴和氧化铝相互作用形成的铝酸钴的耗氢峰,此物种为难还原的非化学计量钴铝复合氧化物[25]。根据XRD和H2-TPR表征结果,可以认为催化剂中氧化铝和氧化钴强相互作用形成的物种不是钴铝尖晶石。

图4 催化剂H2-TPR曲线Fig.4 H2-TPR profiles of the catalysts.
2.2 催化剂的性能
2.2.1 载体对催化剂性能的影响
不同载体制备的催化剂的转化率和选择性见图5。从图5可看出,催化剂载体不同,对乙醇的转化率和乙胺的选择性影响较大,Cat(3,4 h)的活性最高,Cat(1,4 h)的活性最低。结合H2-TPD表征结果,Cat(3,4 h)的金属粒子分散度为4.99%,Co粒子直径为19.9 nm,乙醇转化率为72.9%,乙胺选择性为88.7%;Cat(1,4 h)的金属粒子分散度为4.11%,Co粒子直径为24.2 nm,乙醇转化率为63.4%,乙胺选择性为85.2%。说明催化剂的反应性能与催化剂表面活性金属Co的分散度相关,选择合适的催化剂载体,可提高催化剂活性金属的分散度,提高催化剂的催化性能。

图5 不同载体制备的催化剂的转化率和选择性Fig.5 Conversion and selectivity of the catalysts prepared with different carriers.Reaction conditions:WHSV= 0.9 h-1,n(NH3)∶n(C2H5OH)=3∶1,H2 0.4 MPa,190 ℃.
2.2.2 干燥时间对催化剂性能的影响
干燥时间对催化剂性能的影响见图6。从图6可看出,催化剂干燥时间为4 h时,乙醇转化率为72.9%,乙胺选择性为88.7%;催化剂干燥时间为24 h时,乙醇转化率为76.6%,乙胺选择性为90.4%。由此可见,适当延长催化剂的干燥时间,能够提高乙醇转化率和乙胺选择性。
2.2.3 反应温度对催化剂性能的影响
采用Cat(3,24 h)催化剂,考察了反应温度对催化剂性能的影响,结果见表3。由表3可知,在反应温度为150 ℃时,乙醇转化率只有54.4%,随着反应温度的升高,乙醇转化率逐步提高。反应温度在150~190 ℃时,选择性基本不变;当反应温度达到190 ℃时,随着反应温度的持续升高,副反应增加,选择性开始下降。因此,选择合适的反应温度可使乙醇转化率和乙胺选择性均达到较高的数值。

图6 不同干燥时间制备的催化剂的转化率和选择性Fig.6 Conversion and selectivity of the catalysts prepared with different drying time.Reaction conditions referred to Fig.5.

表3 反应温度对催化剂性能的影响Table 3 Effect of reaction temperature on catalytic performance
2.2.4 氢气压力对催化剂性能的影响
采用Cat(3,24 h)催化剂,考察了氢气压力对催化剂性能的影响,结果见表4。

表4 氢气压力对催化活性的影响Table 4 Effect of hydrogen pressure on catalytic activity
从表4可看出,当氢气压力为0时,转化率为71.9%,选择性仅为16.0%;氢气压力上升到0.4 MPa时,转化率为76.6%,选择性可达90.4%。氢气压力对反应的转化率影响较小,对反应的选择性影响较大。当氢气压力为0.3~0.5 MPa时,转化率和选择性变化不大。因此,选择合适的氢气压力,催化剂可具有较好的催化性能。
3 结论
1)不同批次拟薄水铝石制备的γ-Al2O3载体对活性组分Co3O4在载体上的分散度影响较大。
2)Co3O4/γ-Al2O3催化剂对乙醇还原胺化合成乙胺具有良好的催化活性,活性与金属颗粒的分散度密切相关,金属颗粒的分散度越高,反应效果越好。
3)在重时空速0.9 h-1、氨气与乙醇摩尔比3∶1、反应温度190 ℃、氢气压力0.4 MPa的反应条件下,乙醇转化率为76.6%、乙胺选择性达到90.4%。
