基于网络药理学和分子对接的文殊兰抗肿瘤作用机制研究
2021-06-11李佳鑫辛国松薛沁冰王楠楠
于 淼 ,李佳鑫,辛国松 ,綦 峥 ,薛沁冰 ,王 娟,王楠楠
1.哈尔滨商业大学 药物工程技术研究中心,黑龙江 哈尔滨 150076
2.国家教育部抗肿瘤天然药物工程研究中心,黑龙江 哈尔滨 150076
3.黑龙江省肿瘤预防与抗肿瘤药物研究重点实验室,黑龙江 哈尔滨 150076
文殊兰Crinum asia ticumL.为石蒜科文殊兰属植物,全植株含有生物碱、黄酮、氨基酸类等多种化学成分[1]。《本草纲目拾遗》中记载文殊兰:“叶似带,治折伤损手足者,取叶火煨热,贴之即愈。”其民间以叶和根状茎入药,能够祛火解毒、消肿散结[2]。文殊兰有抗肿瘤、抗炎、抗病毒、镇痛、抗过敏、保护心血管系统、抗拟胆碱样等药理作用[3-4]。文殊兰鳞茎中含有石蒜碱、恩其明、力克拉敏等多种生物碱[5],是其主要的抗肿瘤活性成分。
肿瘤是危害当今人类健康的重要杀手,近年来,随着肿瘤研究的发展,临床抗肿瘤药物的耐药性和化疗后副作用等一系列问题的出现,抗癌中药的筛选始终是研究热点[6]。大量研究表明,文殊兰中的石蒜碱可通过抑制肿瘤细胞的增殖,诱导肿瘤细胞凋亡发挥抗肿瘤作用[7-9],但对文殊兰中其他成分的相关报道很少,因此,本研究应用网络药理学研究文殊兰抗肿瘤的活性成分,以期为该药的深入研究提供理论基础。
网络药理学可以准确展示潜在的药物-靶点之间的相互作用[10]。本研究采用网络药理学策略(图1),系统地研究了文殊兰抗肿瘤的潜在靶点和分子机制,通过化学相似性分析、药效团模型筛选和反向对接等方法对其分子靶点进行预测。利用各种生物信息学平台识别病理靶点。然后根据基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库进行富集分析,构建药物靶向途径网络。最后,利用分子对接技术验证文殊兰与其靶分子之间的相互作用。

图1 文殊兰网络药理学分析流程Fig.1 Network pharmacology workflow of C.asiaticum
1 材料与实验
1.1 靶点筛选
通过TCMID 数据库(http://119.3.41.228:8000/ tcmid/herb/6636/)检索文殊兰的化学成分,将所有的化学成分通过 Swisstargets 数据库(http://www.swisstargetprediction.ch/)进行吸收、分布代谢、排泄(absorption,distribution,metabolism,excretion,
ADME)参数的检索和筛选,将符合要求的化合物纳 入,并通过Swisstargets 数据库和Batman 数据库(http://bionet.ncpsb.org/batman-tcm/)检索其作用靶点。以肿瘤“tumor”为关键词,在GeneCards( https://www.genecards.org/ ) 和OMIM数据库(https://www.omim.org/)进行检索。将得到的疾病靶点和药物靶点导入Venny 2.1 软件找出交集靶点,并绘制韦恩图,作为药物作用于疾病的预测靶点。
1.2 蛋白质相互作用网络(protein-protein interaction,PPI)构建
将药物疾病交集靶点输入 String 数据库(https://string-db.org/cgi/input.pl)构建PPI 网络进行初步筛选,再将PPI 网络导入Cytoscape 3.6.3 中,通过Network Analyzer 工具进行拓扑分析,以度(degree)、中心度(betweenness centrality)、平均最短路径变化量(average shortest path length)和接近中心性(closeness centrality)4 个参数为参考标准,通过degree 排序,选取分值大于平均分的基因作为关键靶点。以关键靶点作为节点构建相互作用网络,并对前20 个靶点进行拓扑分析。
1.3 GO 通路富集
将药物疾病关键靶点进行GO 的生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cell component,CC)富集,引用String 数据库,将校正P≤0.05 的项目进行筛选,并使用R3.6.3,安装并引用clusterProfiler、enrichplot、ggplot2 包后,绘制柱状图。
1.4 KEGG 通路富集及分析
将药物疾病共有靶点进行KEGG 通路富集分析,引用String 数据库,将校正P≤0.05 的项目进行筛选,并使用 R3.6.3 软件,安装并引用clusterProfiler 包后,绘制与癌症相关的相关通路气泡图。将文殊兰预测得到的化合物与癌症相关的关键靶点和与KEGG 通路富集的癌症相关的通路作为节点构建“靶点-通路”网络,并利用软件Cytoscape 3.6.3 对网络进行可视化处理并分析主要作用通路。
1.5 分子对接
将筛选出的主要活性成分通过PubChem 下载SDF 格式;将关键蛋白靶点通过PDB 数据库,尽量选择分辨率Resolution(A)高,有配体、结构相对完整的晶体结构,并下载PDB 格式文件。
将配体分子导入PyRx 软件[11]进行能量最小化处理。蛋白导入Auto Dock Tools,进行除水、加氢、计算电荷,原子类型设为Assign AD4 type。将处理好的配体分子导入PyRx 软件的Ligands 选项;蛋白导入Macromolecules选项,进行Run Vina计算分数。
2 结果
2.1 化学成分及其对应靶点的采集
通过TCMID 数据库检索文殊兰的化学成分,将所有的化学成分通过Swisstargets 数据库ADME参数的检索和筛选,得到15 个符合要求的化合物,见表1。
2.2 癌症靶点基因与文殊兰治疗靶点的关联分析
通过Swisstargets 和Batman 数据库预测得到文殊兰主要成分的相关靶点,去重,共得到585 个基因靶点。依据GeneCards、NCBI 数据库挖掘得到癌症相关基因,去重后得到6538 个靶点,将筛选出的药物靶点与疾病靶点输入Venny 2.1,得到339 个共有靶点(图2),作为药物作用于疾病的预测靶点。

表1 筛选出的化学成分信息Table 1 Information of selected chemical composition

图2 文殊兰抗肿瘤韦恩图Fig.2 Antitumor Venny diagram in C.asiaticum
2.3 蛋白相互作用网络关系的建立和分析
将得到的文殊兰靶点数据导入Cystoscape 3.6.3 中,通过度排序,选取分值大于平均分的基因作为关键靶点,共筛选出118 个关键靶点(图3),节点颜色和大小根据度值调整,越大、颜色越深,度值越大。将排名前15 个靶点作为核心靶点并使用R3.6.3 进行拓扑分析(图4)。

图3 文殊兰蛋白相互作用网络Fig.3 Protein interaction network of C.asiaticum
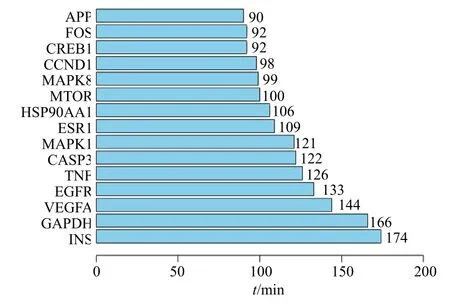
图4 核心癌症靶点的拓扑分析Fig.4 Topological analysis of core cancer targets
2.4 “成分-靶点-疾病”网络的构建
用Cytoscape 3.6.3 软件处理得到文殊兰“成分- 靶点-疾病”相互作用关系网络(图5)。网络中黄色为药物作用于疾病的靶点,蓝色为文殊兰活性成分。表明文殊兰的抗肿瘤作用是基于多成分、多基因、多靶点的协同复杂作用。
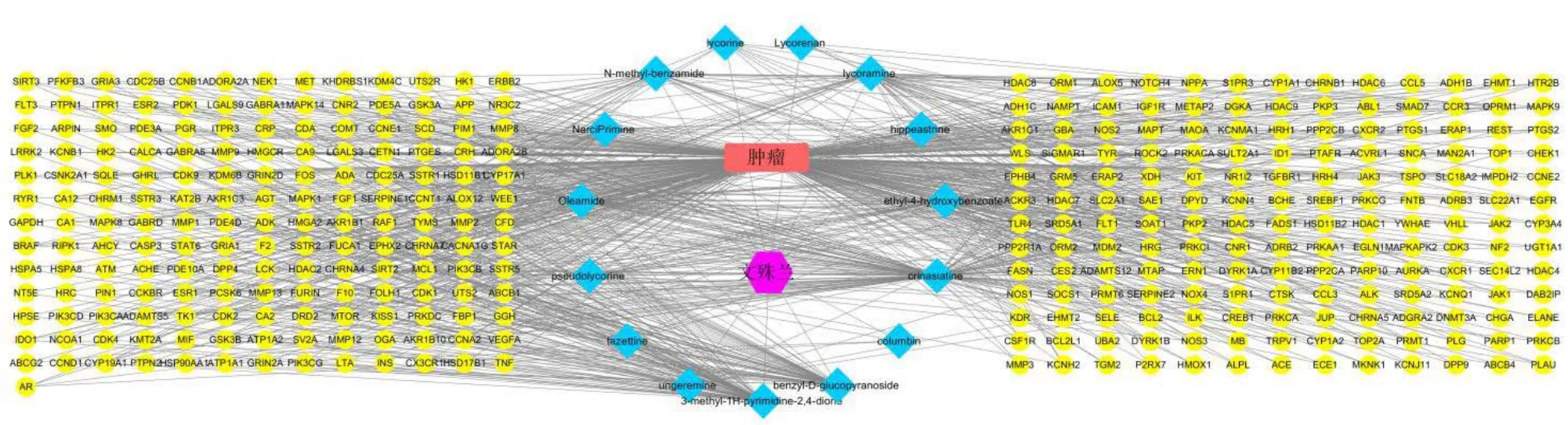
图5 成分-靶点-疾病相互作用关系网络Fig.5 Composition-target-disease interaction network
2.5 GO 富集分析
GO 富集分析结果显示,根据错误发生率(false discovery rate,FDR)<0.05,筛选出BP(如黏附、迁移、凋亡、周期等)2691 个,CC(如细胞膜、细胞质等)225 个,MF 164 个,根据Count 值排序,取前10,结果如图6 所示,细胞生物过程富集的基因数较多,FDR 值较低,说明文殊兰主要通过调节细胞生物过程发挥抗肿瘤作用。
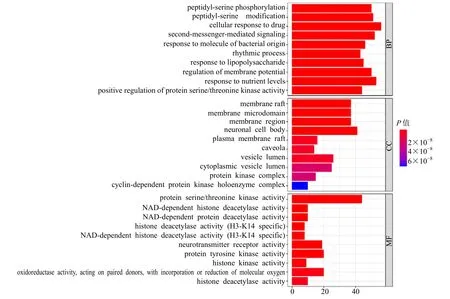
图6 GO 富集分析结果Fig.6 Analysis results of GO enrichment
2.6 KEGG 通路富集分析
KEGG 分析共富集到168 条信号通路,其中25条癌症相关通路,并对25 条通路进行可视化处理(图7)。根据KEGG 通路分析,文殊兰可能对前列 腺癌(prostate cancer)、胰腺癌(pancreatic cancer)、非小细胞肺癌(non-small cell lung cancer)等多种癌症有治疗作用,文殊兰靶点-通路相互作用网络关系见图8,其与prostate cancer 信号通路的靶点作用关系见图9。

图7 KEGG 富集分析气泡图Fig.7 Bubble diagram of KEGG enrichment analysis

图8 文殊兰“通路-靶点”相互作用网络Fig.8 “Pathway-target” network of C.asiaticum

图9 文殊兰与prostate cancer 信号通路的相关靶点作用关系Fig.9 Related target action relationship between C.asiaticum and prostate cancer signaling pathway
2.7 分子对接
对筛选出核心化合物和前15 个潜在核心靶点进行分子对接,对接结果的标准误差(root mean square deviation,RMSD)与原配体的RMSD 分别进行模型表征对比,以最低值为筛选条件。通常认为,配体和受体的构象越稳定,能量越低,结合的可能性越大[12]。经PyRx 对接,得到的数据进行热图分析(图10,红色越深,结合自由能越高)。本研究结合自由能小于-5 kJ/mol 的活性成分有202 个,占90%;小于-9 kJ/mol 的活性成分有12 个,占5.3%,可见这些核心化合物与受体结合活性较高,结构相对稳定。本研究以结合能≤-9.0 kJ/mol 作为筛选标准,用Pymol 2.3 软件进行可视化(图11)。
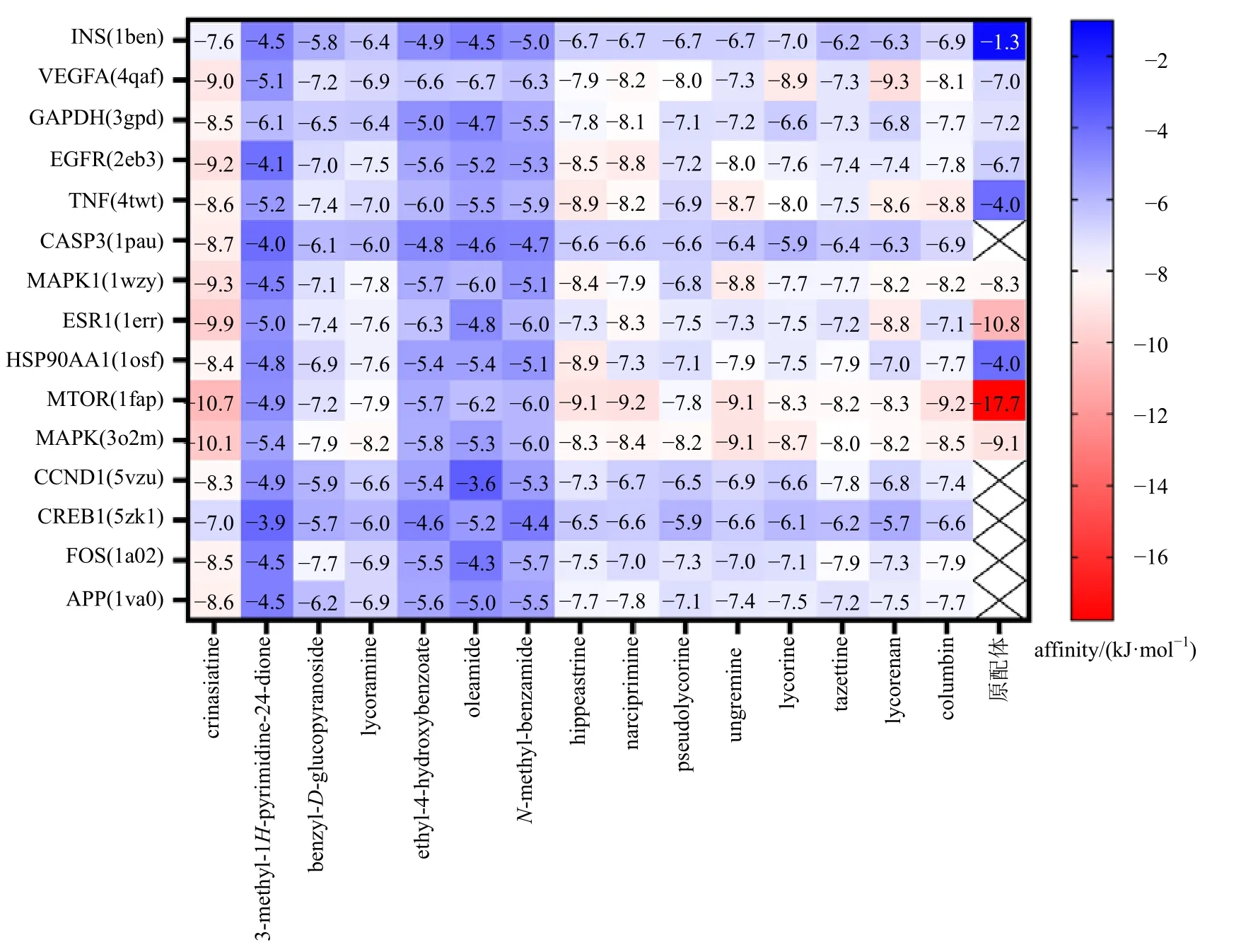
图10 分子对接分数的热图分析Fig.10 Thermal diagram analysis of molecular docking fraction

图11 文殊兰活性成分与核心靶点分子对接可视化 (结合能≤-9 kJ/mol)Fig.11 Visualization of docking between active components and core target molecules of C.asiaticum (affinity ≤ -9 kJ/mol)
3 讨论
本研究采用网络药理学[13]的方法,探索多组分、多靶点、多通路的复杂中药网络关系。基于网络药理学,发现文殊兰抗肿瘤的主要活性成分为生 物碱类,确认文殊兰亭碱、石蒜胺和小星蒜碱等15个抗肿瘤活性成分,以及15 个关键靶点,包括胰岛素(insulin,INS)、甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase ,GAPDH)、血管内皮生长因子(vascular endothelial growth factor,VEGFA)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、肿瘤坏死因子(tumor necrosis factor,TNF)等。KEGG 富集出的通路与癌症相关的有25 条,并通过分子对接技术进行半柔性对接,结果显示化合物与关键靶点均有结合活性,结构相对稳定。KEGG 富集分析结果显示,前列腺癌、多聚糖肿瘤信号通路等与文殊兰抗肿瘤作用密切相关。因此,推断出文殊兰对前列腺癌、胰腺癌、结肠癌、非小细胞肺癌等多种癌症有治疗作用。
对接过程中,活性中心Gridbox 的大小设置合理与否会直接影响到分子对接的准确性,故本研究以原配体抑制剂为活性口区域,合理设置分子对接的Gridbox 大小。本研究通过TCMID、PubChem数据库从文殊兰中筛选出15 个化合物,分别与15个关键靶点进行了分子对接。文殊兰中结合能小于-5 kJ/mol 的活性成分有202 个,占90%;小于-9 kJ/mol 的活性成分有12 个,占5.3%。已有研究表明,文殊兰中的菲啶型生物碱(水仙明、恩其明、石蒜宁碱等)、石蒜型生物碱(石蒜碱)、lycorenine型生物碱(石蒜宁碱)是其主要的抗肿瘤活性成分[6],且Lycorenine 型生物碱活性大于石蒜型生物碱。结合分子对接结果,推测菲啶型生物碱、石蒜型生物碱、lycorenine 型生物碱可能在文殊兰发挥潜在抗肿瘤作用中具有较大贡献。
分子对接结果显示,文殊兰亭碱与VEGFA、EGFR、丝裂原活化蛋白激酶(1mitogen-activated protein kinase 1,MAPK1)、MAPK8、雌激素受体α(estrogen receptor alpha,ESR1)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等关键靶点结合能均≤-9 kJ/mol,说明文殊兰亭碱与以上靶点能很好的结合,同时KEGG 富集分析到得的与癌症相关的通路大多涉及到以上基因。已研究表明,文殊兰亭碱对胰腺癌PNAC-1-LUC 细胞、恶性黑色素瘤细胞SK-MEL-2、乳腺癌ZR-75-1 细胞等一系列肿瘤细胞均有细胞毒作用[14]。小星蒜碱与mTOR 结合能力较好,mTOR 相关信号通路磷脂酰肌醇-3- 羟激酶( phosphatidylinositol-3- hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/mTOR 的激活与列腺癌的发生密切相关,在临床上常用PI3k/Akt/mTOR 通路抑制剂治疗前列腺癌[15-16]。因此,推测文殊兰中的核心化合物通过作用关键靶点VEGFA、EGFR、MAPK1、MAPK8、ESR1、mTOR 等调控前列腺通路、胰腺癌通路、非小细胞肺癌通路、黑色素瘤通路、乳腺癌通路等信号通路起到抗肿瘤作用。
在这些关键基因中,Caspase-3 是半胱氨酸天冬氨酸特异性蛋白酶,研究发现Caspase-3 的过度表达可促进树突状细胞细胞的成熟并提高其抗肿瘤能力[17]。Caspase-3 是一种常被激活的死亡蛋白酶,催化其特异性裂解许多关键的细胞蛋白[18]。体外实验表明,小星蒜碱能降低Caspase-3 的表达,诱导小鼠肉瘤S180细胞凋亡[19]。同时,小星蒜碱能显著抑制人结肠癌Ht-29细胞和肝癌Hepg2细胞的增殖[20]。甜菜碱型生物碱氧化石蒜碱对9 种肿瘤细胞株具有细胞毒作用,其机制可能为促进肿瘤细胞坏死、自噬以及Caspases 激活介导的细胞凋亡、激活基质金属蛋白酶(matrix metalloproteinase,MMP)通路和活性氧簇(reactive oxygen species,ROS)生成[21]。非洲防已苦素是一类二萜类呋喃化合物,具有多种药理活性,包括抗炎、抗肿瘤、体内抑制酶活性等[22]。非洲防已苦素通过抑制结肠癌细胞的增殖,显著抑制偶氮甲烷诱导大鼠结肠发育的进展[23]。水仙明被发现是一种新的抗肿瘤细胞增殖药物,对人急性淋巴细胞白血病CEM 细胞具有明显的抑制细胞周期紊乱和凋亡诱导作用,其机制可能是由Caspase 级联激活介导的凋亡作用[24]。这与KEGG 分析结果相符合,Caspase 可能是结肠癌信号通路、白血病信号通路等通路的关键靶点,由此可以推断,诱导肿瘤细胞凋亡是文殊兰成分抗肿瘤作用的重要机制。
本研究通过网络药理学和分子对接相结合的方法,确认文殊兰抗肿瘤活性成分、关键靶点和信号通路,并基于分子对接初步模拟其可能分子作用机制。本研究结果为后续文殊兰的研究提供了理论基础和重要依据,这些信息可能有助于阐明文殊兰抗肿瘤的基本机制和识别潜在靶点,但未来需要对靶点和特定相互作用进行实验验证。
利益冲突所有作者均声明不存在利益冲突
