千年健萜类化学成分及其细胞毒活性研究
2021-06-11杨仁勇王云涛王梦然刘晓菡杜玉庆王春华
杨仁勇,王云涛,王梦然,田 露,刘晓菡,杜玉庆,姜 艳,王春华,马 丽,赵 峰*
1.滨州医学院药学院,国家中医药管理局方剂效应与临床评价重点研究室,山东 烟台 264003
2.烟台市口腔医院,山东 烟台 264001
千年健Homalomena occulta(Lour.) Schott.为天南星科千年健属植物,本属植物约140 种,分布于热带亚洲和美洲,我国有3 种,主要分布于广东、广西、云南和海南。千年健的干燥根茎入药,为瑶族群众所习用,治疗风湿腰腿痛、类风湿关节炎、胃痛、肠胃炎、骨折、外伤出血等症[1]。自2000年收载入《中国药典》,用于祛风湿、壮筋骨,治疗风寒湿痹、腰膝冷痛、拘挛麻木、筋骨痿软[2]。研究报道,该植物的主要次级代谢产物为挥发油和倍半萜,以及少量的生物碱、酚酸和三萜类成分。挥发油主要含芳樟醇、松油烯-4-醇、α-松油醇等单萜类,显示出抗氧化和杀线虫活性[3-4]。近年来从千年健中发现了10 余种骨架类型的倍半萜,包括杜松烷型、桉烷型、愈创木烷型、isodaucane 型,以及天然来源较为少见的oplopanane、oppositane 和axane 等结构类型的倍半萜,它们显示出细胞毒和抑菌活性,尤其是能促进成骨细胞的增殖和分化,抑制脂多糖诱导巨噬细胞释放炎症因子一氧化氮(NO)、环氧化酶2 (cyclooxygenase,COX-2)和前列腺素E2(prostaglandin E2,PGE2),具有潜在的抗骨质疏松和抗炎活性,是千年健的主要有效成分[5-12]。为了继续研究千年健的活性成分,本实验应用多种色谱学方法,从千年健乙醇提取物的醋酸乙酯萃取部位得到11 个萜类化合物(图1),包括2 个单萜:千年健烯A(homalomene A,1)、3,7-二甲基-1-辛烯- 3,6-二醇(3,7-dimethyl-1-octene-3,6-tetraol,2);5个桉烷型倍半萜:4(15)-eudesmene-1β,6α-diol(3)、菠萝香藤素(ananosmin,4)、1β,4α-dihydroxy-11,12, 13-trinor-8,9-eudesmen-7-one ( 5 )、 1β,4β,7α- trihydroxyeudesmane(6)、mucrolidin(7);1 个oppositane 型倍半萜:bullatantriol(8);1 个杜松烷型倍半萜:cadinane-4β,5α,10α-triol(9);和2 个isodaucane 型倍半萜:4α-hydroxy-homalomenol C(10)、(1R,4S,5S,6S,7S,10R)-isodauc-6,7,10-triol(11)。其中,化合物1 为新化合物,化合物2 为新天然产物,化合物3~5 为首次该属植物分离得到,化合物10 为首次从该植物分离得到。通过单晶X-射线衍射技术进一步确定了化合物11 的立体构型。化合物5~7 和9~11 显示出中等强度或弱细胞毒活性,其中化合物10 的活性最好,对测试的3 种人肝癌肿瘤细胞株HepG2、SMMC-7721 和QGY-7703 的半数抑制浓度(IC50)值分别为(37.56±6.73)、(33.39±2.75)和(44.24±5.15)μmol/L。
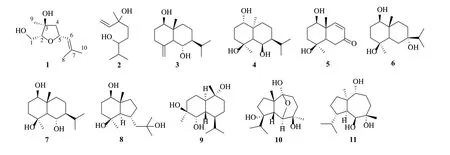
图1 千年健中萜类化合物的结构Fig.1 Structures of terpenoids from H.occulta
1 仪器与材料
Avance III 500 MHz 或Avance III HD 600 MHz核磁共振仪(德国Bruker 公司);iS50 红外光谱仪、Q Exactive Focus 高分辨质谱仪(美国赛默飞世尔公司);安捷伦1100 Series LC-MSD-Trap-SL 或Agilent 6520 Accurate-Mass Q-TOF LC/MS 型质谱仪(美国安捷伦公司);Autopol III 型旋光仪(美国Rudolph 公司);Synergy H1 酶标仪(美国Bio Tek 公司);Waters 600 型高效液相色谱仪(美国Waters 公司);柱色谱硅胶(青岛海洋化工厂);制备及分析薄层色谱板(烟台江友硅胶发展有限公司);凝胶Sephadex LH-20(GE Pharmacia 公司,美国);Rp C18色谱柱(250 mm×10 mm,5 μm,北京慧德易科技有限责任公司);盐酸阿霉素(大连美仑生物技术有限公司,批号S0702A);所用试剂均为分析纯或色谱纯(广东汕头西陇科学股份有限公司)。
千年健药材购自河北省安国中药市场,经滨州医学院中西医结合学院王樱霖教授鉴定为千年健H.occulta(Lour.) Schott,标本(S-QNJ-2010)保存于滨州医学院药学院。
2 方法
2.1 提取与分离
取干燥的千年健根9 kg,粉碎,用95%乙醇室温超声波辅助提取3 次,提取液减压蒸干得浸膏400 g。浸膏加适量蒸馏水,充分分散后,用醋酸乙酯萃取3 次,减压蒸干得到醋酸乙酯萃取部分198 g。
醋酸乙酯萃取部分用硅胶(100~200 目)柱色谱分离,石油醚-丙酮(10∶0、10∶0.5、10∶1、2∶1、1∶1)梯度洗脱,得到6 个部分(Fr.1~6)。Fr.3(45.5 g)用硅胶柱色谱分离,石油醚-醋酸乙酯(10∶1、10∶2、2∶1、1∶1、0∶1)洗脱,得到4个部分Fr.3-1~3-4。Fr.3-3 用丙酮重结晶得到化合物8(2.1 g)。Fr.4(23 g)用硅胶柱色谱进一步纯化,石油醚-丙酮(100∶0→0∶100)梯度洗脱,得到20 个部分Fr.4-1~Fr.4-20。Fr.4-3(0.15 g)用Sephadex LH-20 凝胶柱色谱分离,石油醚-氯仿-甲醇(5∶5∶1)洗脱,得到10 个部分。Fr.4-3-7 用制备薄层色谱纯化,氯仿-丙酮(3∶1)作展开剂,得到化合物4(20 mg)。Fr.4-4(0.2 g)用Sephadex LH-20 凝胶柱色谱分离,石油醚-氯仿-甲醇(5∶5∶1)洗脱,得到10 个部分。Fr.4-4-5 用丙酮重结晶得到化合物7(9.1 mg)。Fr.4-4-6 用制备薄层色谱纯化,氯仿-丙酮(4∶1)作展开剂,得到化合物1(3 mg)。Fr.4-4-10 用Sephadex LH-20 凝胶柱色谱纯化,石油醚-氯仿-甲醇(5∶5∶1)洗脱,得到化合物11(18 mg)。Fr.4-6(1.2 g)用Sephadex LH-20凝胶柱色谱分离,石油醚-氯仿-甲醇(5∶5∶1)洗脱,得到5 个部分。Fr.4-6-2 用液相色谱纯化,甲醇-水(70∶30,2 mL/min)洗脱得到化合物10(9.7 mg)。Fr.4-6-5 用制备薄层色谱纯化,氯仿-丙酮(3∶1)作展开剂,得到化合物3(2 mg)。Fr.4-9(2 g)用Sephadex LH-20 凝胶柱色谱分离,石油醚-氯仿-甲醇(5∶5∶1)洗脱,得到9 个部分。Fr.4-9-5 用半制备型液相色谱纯化,甲醇-水(70∶30,2 mL/min)洗脱得到化合物9(8 mg)。Fr.4-9-6 用半制备型液相色谱纯化,甲醇-水(65∶35,2 mL/min)洗脱得到化合物2(5 mg)和5(8 mg)。Fr.4-9-8经丙酮重结晶得到化合物6(1.1 g)。
2.2 抗肿瘤活性评价
参照文献报道方法[13],应用MTT 法测试了化合物对 3 株人肝癌 HepG2、SMMC-7721 和QGY-7703 细胞的细胞毒活性。肿瘤细胞复苏后,用含10%胎牛血清、1%双抗的DMEM 培养基传代,取对数生长期的细胞用于实验。用无血清培养基稀释药物浓度为100、50、25、12.5、6.25、3.13 μmol/L。取生长状态良好的细胞,按照2×104个/孔、每孔100 μL 种板;培养12 h 后,弃上清,将各浓度药物按每孔100 μL 体积加入细胞中,每浓度设置3 个复孔;对照组加含1% DMSO 的培养基。加药培养24 h 后,弃上清,每孔加100 μL 无血清培养基配制的MTT 溶液,继续培养4 h 后,弃上清,每孔加DMSO 150 μL,于微孔板振荡器上震荡10 min 后,用酶标仪测得570 nm 处的吸光度(A)值并按照公式计算细胞存活率。实验重复3 次,菜用GraphPad Prism 5软件计算IC50值。
细胞存活率=A实验/A对照
3 结果
3.1 结构鉴定
化合物1:无色胶状物,[α]20D+33.0 (c0.15, MeOH)。HR-ESI-MS 给出准分子离子峰m/z209.114 9 [M+Na]+(计算值209.114 8,C10H18O3Na),提示其分子式为C10H18O3,不饱和度为2。红外光谱显示有羟基(3396 cm-1)和双键(1681 cm-1)的特征吸收峰。1H-NMR 谱(表1)显示1 个烯氢信号δH5.20 (1H, dq,J= 8.4, 1.2 Hz, H-6),结合13C-NMR 给出的10 个碳信号以及不饱和度,提示化合物1 可能是单环单萜。1H-NMR 谱还给出2 个与烯键相连的甲基双峰信号δH1.70 (3H, d,J= 1.2 Hz, CH3-8), 1.73 (3H, d,J= 1.2 Hz, 7-CH3),1 个甲基单峰信号δH1.30 (3H, s, 3-CH3),以及4 个与氧原子相连的碳上的质子信号δH3.46 (1H, dd,J= 12.0, 5.0 Hz, H-1a), 3.57 (1H, dd,J= 12.0, 4.2 Hz, H-1b), 3.70 (1H, dd,J= 6.0, 4.2 Hz, H-2), 4.88 (1H, m, H-5)。其中,甲基与烯氢质子间较小的偶合常数(J= 1.2 Hz),提示为烯丙位4J远程偶合,是连在双键上的偕二甲基,结构中存在 (CH3)2C=CH-片段。13C-NMR 谱共显示10 个碳信号,结合HSQC 谱,确定为3 个甲基、2 个亚甲基(1 个连氧)、2 个连氧次甲基、1 个连氧季碳和2 个烯碳,并对直接相连的1H 和13C 信号进行了准确归属。化合物1 的1H-1H COSY 谱显示2 个偶合系统,分别是 H2-1/H-2 和 H2-4/H-5/H-6/H-8 (H-10),二者通过连氧季碳(C-3,δC78.8)相连,该连接方式经HMBC 谱给出的远程相关信息进一步确证。HMBC 谱中(图2),H-1 与C-2 (δC88.0)、C-3 (δC78.8) 相关,H-9 与C-2、C-3、C-4 (δC47.0) 相关,H-4 与C-2、C-3、C-5 (δC74.3)、C-9 (δC21.5) 相关,H-6 与C-4、C-8 (δC24.5)、C-10 (δC16.8) 相关,H-8 和H-10 与C-6 (δC125.5)、C-7 (δC135.5) 相关。H-2 与C-5 间的HMBC 远程相关表明C-2 与C-5 通过氧原子相连形成四氢呋喃环结构,可能是由月桂烷型无环单萜的2-OH 与5-OH 脱水缩合形成。化合物1 的相对构型经NOESY 谱确证,NOESY谱中(图3),H-1 与H-9 相关,H-9 与H-4a 相关, H-4a 与H-6 相关,说明它们在四氢呋喃环平面的同侧,推测为α 构型。H-2 与H-5 相关,H-5 与H-4b相关,提示他们为β 构型。因此,鉴定化合物1 的结构如图1 所示,命名为千年健烯A。

表1 化合物1 的氢谱和碳谱数据 (600/150 MHz, CD3OD)Table 1 1H-NMR a nd 13C-NMR data of c ompound 1 (600/150 MHz, CD3OD)
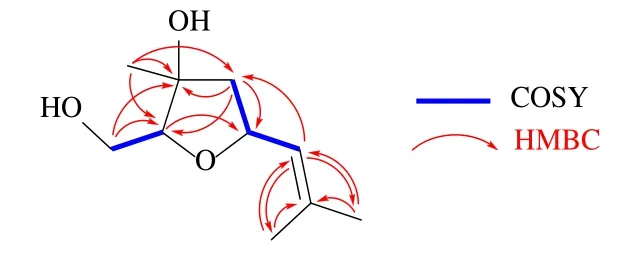
图2 化合物1 的主要1H-1H COSY 和HMBC 相关Fig.2 K ey 1H-1H C OSY an d HMBC c orrelations of compound 1

图3 化合物1 的主要NOESY 相关Fig.3 Key NOESY correlations of compound 1
化合物3:白色无定形粉末,10%硫酸-乙醇溶液显紫色。ESI-MSm/z: 239.1 [M+H]+。1H-NMR (500 MHz, acetone-d6)δ: 0.66 (3H, s, H-14), 0.88 (3H, d,J= 6.8 Hz, H-12), 0.95 (3H, d,J= 6.8 Hz, H-13), 1.72 (1H, d,J= 10.8 Hz, H-5), 3.49 (1H, dd,J= 11.5, 3.9 Hz, H-1), 3.81 (1H, dd,J= 10.8, 9.5 Hz, H-6), 4.77 (1H, d,J= 1.5 Hz, H-15a), 4.94 (1H, d,J= 1.5 Hz, H-15b);13C-NMR (125 MHz, CDCl3)δ: 79.5 (C-1), 32.4 (C-2), 35.5 (C-3), 146.8 (C-4), 56.3 (C-5), 67.5 (C-6), 49.8 (C-7), 18.7 (C-8), 36.7 (C-9), 42.2 (C-10), 26.4 (C-11), 16.6 (C-12), 21.7 (C-13), 12.1 (C-14), 108.4 (C-15)。以上数据与文献报道一致[15],故鉴定化合物3 为4(15)-eudesmene-1β,6α-diol。
化合物4:白色无定形粉末,10%硫酸-乙醇溶液显紫色。ESI-MSm/z: 257.1 [M+H]+。1H-NMR (500 MHz, acetone-d6)δ: 4.35 (1H, dd,J= 11.4, 4.5 Hz, H-6), 3.27 (1H, dd,J= 9.8, 4.6 Hz, H-1), 1.71 (1H, d,J= 11.4 Hz, H-5), 1.30 (3H, s, H-15), 1.11 (3H, d,J= 6.7 Hz, H-12), 0.93 (3H, d,J= 6.7 Hz, H-13);13C-NMR (125 MHz, acetone-d6)δ: 78.7 (C-1), 28.3 (C-2), 35.9 (C-3), 72.1 (C-4), 50.3 (C-5), 72.6 (C-6), 47.2 (C-7), 22.6 (C-8), 35.9 (C-9), 40.7 (C-10), 25.2 (C-11), 21.8 (C-12), 24.0 (C-13), 13.6 (C-14), 23.2 (C-15)。以上数据经DEPT 谱和HMBC 谱进行了准确归属,与文献报道一致[16],故鉴定化合物4为菠萝香藤素。
化合物5:白色无定形粉末,10%硫酸-乙醇溶液显灰黄色。ESI-MSm/z: 211.1 [M+H]+。1H-NMR (500 MHz, acetone-d6)δ: 7.34 (1H, d,J= 10.0 Hz, H-9), 5.84 (1H, d,J= 10.0 Hz, H-8), 3.44 (1H, dd,J= 11.7, 4.2 Hz, H-1), 2.69 (1H, dd,J= 17.8, 14.2 Hz, H-6a), 2.49 (1H, ddd,J= 17.8, 3.8, 0.7 Hz, H-6b), 1.82 (1H, dd,J= 14.2, 3.8 Hz, H-5), 1.24 (3H, s, H-14), 1.17 (3H, s, H-15);13C-NMR (125 MHz, acetone-d6)δ: 75.1 (C-1), 27.7 (C-2), 40.1 (C-3), 71.3 (C-4), 49.5 (C-5), 35.8 (C-6), 203.6 (C-7), 126.7 (C-8), 161.5 (C-9), 43.6 (C-10), 13.8 (C-14), 29.2 (C-15)。以上数据与文献报道一致[17],故鉴定化合物5 为1β,4α-dihydroxy-11,12,13-trinor-8,9-eudesmen- 7-one。
化合物6:白色无定形粉末,10%硫酸-乙醇溶液显紫色。ESI-MSm/z: 257.1 [M+H]+。1H-NMR (500 MHz, acetone-d6)δ: 3.20 (1H, dd,J= 12.3, 4.5 Hz, H-1), 1.08 (3H, s, H-15), 1.00 (3H, s, H-14), 0.94 (3H, d,J= 6.8 Hz, H-12), 0.93 (3H, d,J= 6.8 Hz, H-13);13C-NMR (125 MHz, acetone-d6)δ: 78.9 (C-1), 27.2 (C-2), 40.0 (C-3), 70.3 (C-4), 44.8 (C-5), 28.8 (C-6), 72.3 (C-7), 29.4 (C-8), 34.6 (C-9), 38.9 (C-10), 39.3 (C-11), 16.5 (C-12), 16.6 (C-13), 11.1 (C-14), 29.4 (C-15)。以上数据与文献报道一致[8,18],故鉴定化合物6 为1β,4β,7α-trihydroxyeudesmane。
化合物7:白色无定形粉末,10%硫酸-乙醇溶液显紫色。ESI-MSm/z: 257.1 [M+H]+。1H-NMR (500 MHz, acetone-d6)δ: 3.88 (1H, dd,J= 12.8, 9.6 Hz, H-6), 3.13 (1H, dd,J= 11.4, 4.5 Hz, H-1), 1.02 (1H, d,J= 9.3 Hz, H-5), 1.45 (3H, s, H-15), 1.01 (3H, s, H-14), 0.90 (3H, d,J= 6.8 Hz, H-12), 0.84 (3H, d,J= 6.8 Hz, H-13);13C-NMR (125 MHz, acetone-d6)δ: 78.4 (C-1), 27.2 (C-2), 41.5 (C-3), 71.1 (C-4), 56.9 (C-5), 68.5 (C-6), 51.9 (C-7), 18.4 (C-8), 37.9 (C-9), 40.8 (C-10), 25.7 (C-11), 20.7 (C-12), 15.3 (C-13), 12.7 (C-14), 34.1 (C-15)。以上数据与文献报道一致[19],故鉴定化合物7 为mucrolidin。
化合物8:无色方晶,mp 179.1~181 ℃,10%硫酸-乙醇溶液显灰黄色。ESI-MSm/z: 257.2 [M+H]+。1H-NMR (500 MHz, DMSO-d6)δ: 4.19 (1H, d,J= 4.4 Hz, 1-OH), 3.97 (1H, s, OH), 3.66 (1H, s, OH), 3.11 (1H, ddd,J= 11.4, 4.4, 4.4 Hz, H-1), 1.91 (1H, d,J= 13.5 Hz, H-5), 1.15 (3H, s, H-15), 1.10 (3H, s, H-12), 1.09 (3H, s, H-13), 0.89 (3H, s, H-14);13C-NMR (125 MHz, DMSO-d6)δ: 78.7 (C-1), 40.5 (C-2), 41.5 (C-3), 70.3 (C-4), 59.2 (C-5), 32.1 (C-6), 51.8 (C-7), 32.5 (C-8), 28.5 (C-9), 47.1 (C-10), 70.6 (C-11), 31.8 (C-12), 30.6 (C-13), 15.2 (C-14), 30.5 (C-15)。以上数据与文献报道一致[20],故鉴定化合物8 为bullatantriol。
化合物9:白色无定形粉末,10%硫酸-乙醇溶液显紫色。ESI-MSm/z: 257.2 [M+H]+。1H-NMR (500 MHz, CD3OD)δ: 3.49 (1H, brs, H-5), 2.07 (1H, m, H-11), 1.22 (3H, s, H-15), 1.09 (3H, s, H-14), 0.95 (3H, d,J= 6.9 Hz, H-12), 0.81 (3H, d,J= 6.9 Hz, H-13);13C-NMR (125 MHz, CD3OD)δ: 43.5 (C-1), 19.79 (C-2), 32.2 (C-3), 71.1 (C-4), 72.2 (C-5), 39.2 (C-6), 41.6 (C-7), 20.7 (C-8), 41.6 (C-9), 71.9 (C-10), 25.0 (C-11), 14.2 (C-12), 20.7 (C-13), 20.2 (C-14), 27.0 (C-15)。以上数据与文献报道一致[8],故鉴定化合物9 为cadinane-4β,5α,10α-triol。
化合物10:白色无定形粉末,10%硫酸-乙醇溶液显紫色。ESI-MSm/z: 271.2 [M+H]+。1H-NMR (500 MHz, acetone-d6)δ: 3.39 (1H, brs, H-6), 2.32 (1H, t,J= 1.6 Hz, H-5), 1.34 (3H, d,J= 0.5 Hz, H-15), 1.24 (3H, s, H-14), 0.98 (3H, d,J= 6.9 Hz, H-12), 0.92 (3H, d,J= 6.9 Hz, H-13);13C-NMR (125 MHz, acetone-d6)δ: 53.1 (C-1), 33.4 (C-2), 37.7 (C-3), 87.1 (C-4), 58.5 (C-5), 81.0 (C-6), 68.4 (C-7), 33.4 (C-8), 32.8 (C-9), 105.4 (C-10), 33.1 (C-11), 17.3 (C-12), 16.3 (C-13), 22.6 (C-14), 26.1 (C-15)。以上数据与文献报道一致[17],故鉴定化合物10 为4α- hydroxy-homalomenol C。
化合物11:白色无定形粉末,10%硫酸-乙醇溶液显紫色。ESI-MSm/z: 257.1 [M+H]+。前期已报道该化合物的HRESIMS、1H-NMR、13C-NMR、HMBC 和NOESY 数据,通过与同时得到的化合物的旋光值和核磁数据比对,鉴定化合物 11 为 (1R,4S,5S,6S,7S,10R)-isodauc-6,7,10-triol[9,21]。化合物11 与其对映异构体的碳谱仅C-5、C-6、C-7、C-10和C-15 的化学位移稍有不同,为了排除二者仅部分手性碳构型不同的可能性,应用氯仿-甲醇(1∶1)反复重结晶得到了化合物11 的无色块状晶体,以Cu Kα 辐射为光源,经单晶X-射线衍射法确证其立体构型与前期鉴定的一致(图4)。化合物11 的单晶数据已上传至CCDC,CCDC 号为1051601。
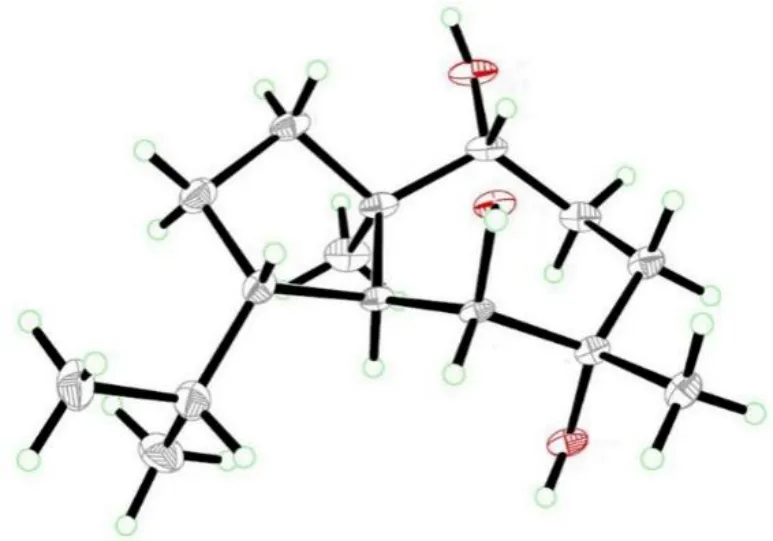
图4 化合物11 的单晶ORTEP 图Fig.4 X -ray ORTEP drawing of compound 11
化合物11 的单晶结构:分子式2C15H28O3·CH3OH,含2 分子化合物11 和1 分子甲醇;相对分子质量MR=544.79,单斜晶系,P21空间群;晶胞参数a= 0.715 55(3) nm,b=2.042 45(15) nm,c=1.159 28(6) nm, α=γ=90°, β=97.164(2)°;V=1 681.3(7) nm3,T=293(2) K, 晶胞内分子数Z=2,Dc=1.076 mg/cm3,F(000)=604。晶胞的衍射点数 5907 (3.84≤θ≤66.12),可观测的衍射点数4470 [I>2σ(I)].可观测衍射点的R为0.053 5,可观测衍射点的RW为0.148 7,S 为1.052,Flack 因子是0.0(3)。
3.2 细胞毒活性结果
在浓度为100 µmol/L 时,化合物1~4、8 对3株人肝癌HepG2、SMMC-7721 和QGY-7703 细胞的抑制率均小于20%,无明显的细胞毒作用。其他化合物表现出中等强度或弱细胞毒活性(表2),且有一定的选择性,仅isodaucane 型倍半萜10、11对 QGY-7703 显示出抑制作用。对 HepG2 和SMMC-7721 显示抑制活性的化合物中,化合物10和11的活性最好,其IC50值为29.38~37.56 μmol/L。
表2 化合物5~7 和9~11 的细胞毒活性 ( ± s , n=3)Table 2 Cytotoxic activities of compounds 5—7 and 9—11 ( ± s , n=3)
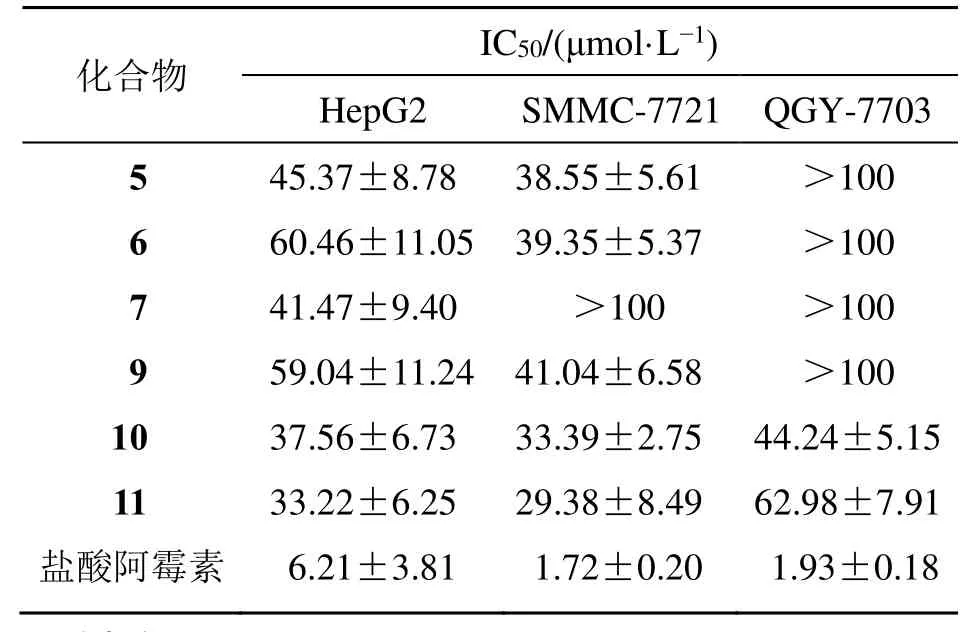
表2 化合物5~7 和9~11 的细胞毒活性 ( ± s , n=3)Table 2 Cytotoxic activities of compounds 5—7 and 9—11 ( ± s , n=3)
化合物 HepG2 IC5 S 0/M(μ Mm Co l-·7L 7-21 1) QGY-7703 5 45.37±8.78 38.60.46±11.05 39.41.47±9.40 55±5.61 >100 6 35±5.37 >100 7 >100 >100 9 59.04±11.24 41.04±6.58 >100 10 37.56±6.73 33.39±2.75 44.24±5.15 11 33.22±6.25 29.38±8.49 62.98±7.91 盐酸阿霉素 6.21±3.81 1.72±0.20 1.93±0.18
4 讨论
千年健富含萜类成分,主要为低沸点的单萜挥发油和氧化度较高的倍半萜。倍半萜类成分显示出更为多样的骨架类型和能代表千年健传统药效的生物学活性,目前已报道10 余种骨架类型的倍半萜,它们对NO、COX-2 和PGE2等炎性因子的分泌具有显著的抑制作用,能够促进成骨细胞的增殖和分化,可能是千年健的药效物质基础。本研究从千年健根茎分离得到2 个单萜和9 个倍半萜类化合物,其中化合物1 为新化合物,结构中有1 个四氢呋喃环,可能是由月桂烷型无环单萜的2-OH 与5-OH脱水缩合形成,该类氧化环合形式的天然单萜报道较少。化合物2 为月桂烷型新天然单萜。化合物3~5 为首次从该属植物分离得到的桉烷型倍半萜,其中化合物5 是降三碳倍半萜。通过单晶-X 射线衍射技术进一步确证了化合物11 的立体结构。初步的体外抗肿瘤活性评价中,桉烷型倍半萜(5~7)、杜松烷型倍半萜(9)和isodaucane 型倍半萜(10、11)显示出一定的细胞毒活性。研究结果进一步丰富了千年健的化学物质组成和生物学活性,为千年健的开发应用提供研究基础和依据。
利益冲突所有作者均声明不存在利益冲突
