健脾渗湿方对尿酸酶基因缺失高尿酸血症模式动物肾损伤及肠道微生态干预的研究*
2021-06-11李小丝刘维超李兆福段为钢彭江云万春平
殷 娜,李小丝,刘维超,祁 燕,李兆福,段为钢,彭江云,万春平
(云南中医药大学,云南 昆明 650500)
痛风(Gout)是一种嘌呤代谢紊乱所致的疾病。临床流行病学提示,我国高尿酸血症的患病率急剧攀升,成为仅次于糖尿病的第2大代谢性疾病[1]。痛风危害最大的是肾脏损害和骨质破坏。慢性尿酸性肾病,即痛风性肾病,是指在长期高尿酸血症状态下,尿酸盐晶体沉积于肾组织导致肾脏病变[2]。痛风患者大多都有不同程度的肾功能受损。痛风性肾病,多隐匿发病,早期症状不典型,进展缓慢,不易引起重视,一旦出现明显症状已到肾损害期,甚至发展到肾衰竭期导致死亡[3]。因此,治疗和控制高尿酸血症及痛风性肾病已经成为一个亟待解决的公共卫生问题。
中医学认为“先天不足,正气亏虚,经脉失养;湿浊排泄减少,留滞经脉;脾胃失司,痰浊凝滞关节;感受外邪,邪痹经脉,气血运行不畅”是痛风发病的基本病机。云南吴氏学派吴生元教授提出“三期六型辨证论治”理论,针对间歇期(脾虚湿阻证)痛风患者,运用“健脾化痰,渗湿通络”治法[4],提出健脾渗湿方,该方由党参、白术、茯苓、猫须草等十余味药组成,具有脾渗湿、化痰逐瘀、通络除痹之功,临床主要用于高尿酸血症的治疗,适用于痛风的间歇期、慢性痛风石病变期及肾脏病变。前期临床及基础研究显示,健脾渗湿方降尿酸疗效显著,明显改善痛风及高尿酸血症的临床症状,显著降低高尿酸血症大鼠模型血尿酸水平,其作用机制可能主要与调节尿酸盐转运蛋白有关。前期课题组团队采用 CRISPR/Cas9技术敲除Uox基因,获得遗传性状稳定的尿酸酶基因缺失大鼠,该模式动物表型明显,体内尿酸水平明显高于野生型,肾功能异常且肾脏存在损伤,为高尿酸血症和痛风的研究提供与人类尿酸代谢规律最接近的模型大鼠。研究已证实,人体内超过一半的血尿酸经肾脏排出体外,1/3的血尿酸从消化道排出[5]。目前有关健脾渗湿方治疗痛风的研究主要聚焦酵母喂养型高尿酸血症模型肾脏尿酸代谢,而对尿酸酶缺失高尿酸血症模式动物消化道尿酸代谢及肠道菌群尚未明确,有必要进一步深入研究。
本研究在尿酸酶基因缺失高尿酸血症大鼠模式动物上,从肾脏和肠道尿酸代谢、肠道菌群变化3个维度,明确健脾渗湿方干预尿酸代谢的效应途径,解析中医浊毒“脾肾亏虚,痰湿瘀阻”基本病机现代生物学内涵,为健脾渗湿方临床应用治疗痛风及相关并发症提供科学基础,传承创新云南吴氏学术思想。
1 材料与方法
1.1 实验动物 尿酸酶基因缺失高尿酸血症大鼠(Uox-/-)16只,野生型SD大鼠(WT)8只,体质量180~200 g,雄性。由云南中医药大学段为钢教授课题组提供。动物饲养在云南中医药大学第一附属医院中心实验室屏障系统,饲料和水消毒后,给予实验动物自由摄取。实验方案通过云南中医药大学第一附属医院医学伦理委员会审查。
1.2 主要药物与试剂 健脾渗湿方主要由党参、白术、法半夏、三七粉、土茯苓等十余味中药组成,煎煮2次,浓缩成浸膏,4℃备用;尿酸检测试剂盒、尿素氮检测试剂盒、肌酐检测试剂盒(罗氏诊断公司,货号:03183807190;04460715190;03263991190);尿酸测试盒(南京建成生物工程公司,货号:C012-1-1);蛋白染色试剂(伯乐生命医学产品(上海)有限公司,货号:#500-0006);BSA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,货号:P0012S);Zymo Research BIOMICS DNA Microprep Kit(北京天漠科技有限公司,货号:D4301);KOD-Plus-Neo DNA Polymerase(东洋纺(上海)生物科技有限公司,货号:KOD-401B);NEBNext Ultra II DNA Library Prep Kit for Illumina(NEB(北京)有限公司,货号:E7645L);Hiseq Rapid SBS Kit v2(因美纳(中国)科学器材有限公司)。
1.3 主要仪器 罗氏cobas c311全自动生化分析仪(罗氏诊断产品(上海)有限公司),SpectraMax i3x型多功能酶标仪(美谷分子仪器(上海)有限公司),Heidolph旋转蒸发仪(德祥科技有限公司),ASP 300S全自动脱水机、EG 1150H组织包埋机、CM 1950冷冻台、RM2235切片机、HI1210烘片机、、DM2500正置显微镜和图文系统(均为德国莱卡仪器有限公司),Qubit@2.0 Fluorometer DNA定量仪(赛默飞世尔科技有限公司),9700 PCR仪(美国应用生物系统公司),Hiseq 2500测序仪(因美纳(中国)科学器材有限公司)。
2 方法
2.1 分组与给药 测定Uox-/-大鼠血清尿酸,按尿酸平均值相近随机分为高尿酸组(Uox-/-)、健脾渗湿方组(JPSSF),野生型 SD 大鼠为对照组(WT),每组 8只。动物自由饮水、进食1周后开始实验。JPSSF组给予健脾渗湿方中药液12.50 g/(kg·d)灌胃,高尿酸组和对照组给予相同体积的生理盐水灌胃,连续给药60 d。
2.2 肾功能检测 末次给药后,10%水合氯醛腹腔注射麻醉大鼠,眼眶静脉丛取血,3 000 r/min离心10 min分离血清,采用全自动生化分析仪测定血清尿酸(UA)、尿素氮(BUN)、肌酐(Cr)水平。
2.3 尿蛋白的测定 给药结束后,大鼠禁食、不禁水,收集24 h尿量并记录。取1 mL收集的尿液,离心去除沉淀,参照考马斯亮蓝G-250法测定尿蛋白。简言之,将标准品和离心后尿液加入96孔板中,各孔再加入200 μL稀释后的染色液,室温放置5 min,酶标仪595 nm测定OD值,计算各组大鼠1 d尿蛋白含量。
2.4 HE检测高尿酸血症模式动物肾脏病理损伤程度水合氯醛麻醉大鼠,取肾脏固定于10%福尔马林中,75%、85%、95%、100%浓度梯度乙醇依次对标本进行脱水,二甲苯透明,石蜡包埋,切成4 μm薄片,二甲苯、浓度梯度乙醇脱蜡到水,苏木素-伊红(HE)染色,中性树胶封片,光镜下观察肾脏组织病理损伤程度。
2.5 磷钨酸法测定肠组织尿酸含量 精密称取适量肠组织,加入9倍体积的PBS缓冲液冰上匀浆,4 000 r/min室温离心10 min,取上清转移至新的离心管,采用BSA蛋白测定试剂盒将肠组织蛋白含量调一致,接着按照尿酸测试盒说明书测定肠组织尿酸含量,酶标仪690 nm测定OD值,计算各组大鼠肠组织尿酸含量。
2.6 荧光定量PCR(q-PCR)检测肾脏组织尿酸盐转运蛋白相关基因的表达 精密称取肾组织,加入RZ裂解液,冰上匀浆,15~30℃放置5 min,使核酸蛋白复合物完全分离,应用Trizol试剂盒提取总RNA。取总RNA含量4 μg按Takara逆转录试剂盒合成cDNA。以合成的cDNA第1链为模板,按SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒说明书进行q-PCR扩增,检测尿酸盐转运蛋白基因:URAT1,UAT,OAT1的表达。设置GAPDH为内参对照,目的基因表达的相对差异量用2-△△Ct法进行统计分析。特异基因引物序列如下。

2.7 16S rRNA V4区检测肠道菌群微生态结构多样性健脾渗湿方干预治疗结束后,将大鼠置代谢笼内,采集大鼠自然排出的新鲜粪便。每组随机选出5只大鼠粪便,采用Zymo Research BIOMICS DNA Microprep Kit试剂盒纯化粪便样本gDNA。以每个样品提取的DNA 为模板,引物序列:Primer 5’-3’:515F(5’-GTGYCAGCMGCCGCGGTAA-3’)和 806R(5’-GGACTACHVGGGTWTCTAAT-3’)扩增16S rDNA基因V4区,琼脂糖凝胶进行目的片段电泳检测、纯化,按照每个样本的测序量要求,进行相应比例的混合。NEBNext Ultra II DNA Library Prep Kit for Illumina试剂盒建库,Hiseq Rapid SBS Kit v2试剂盒上机高通量测序,测序方式为PE250。在数据分析上:QIIME进行质控过滤掉不符合要求的序列,应用UPARSE算法在97%一致性水平上进行OTU聚类,用UCLUST分类法与SILVA数据库注释分析,R语言分析群落组成分。
2.8 统计学分析 采用SPSS 18.0软件进行数据分析,所有实验数据均以均数±标准差(±s)表示,正态分布采用单因素方差分析,非正态分布资料采用非参数检验,P<0.05表示差异具有统计学意义。
3 结果
3.1 健脾渗湿方对高尿酸血症大鼠肾功能的影响
肾功能检测结果显示,与WT组相比,Uox-/-组血清尿酸含量显著升高,差异具有统计学意义(P<0.01);与Uox-/-组相比,健脾渗湿方干预后能有效降低血清尿酸水平(P<0.05),结果见图1A。Uox-/-组血清尿素氮和肌酐水平显著高于WT组,其中血清尿素氮差异具有显著性意义(P<0.01);JPSSF组尿素氮、肌酐水均低于 Uox-/-组,差异均具有统计学意义(P<0.05),结果见图1B-C。这些结果提示,健脾渗湿方对高尿酸血症肾功能损伤具有显著的保护作用。检测肠组织尿酸含量,发现Uox-/-组尿酸水平显著高于WT组,差异具有统计学意义(P<0.01),健脾渗湿方干预后,对肠组织尿酸水平无显著性影响(P>0.05),结果见图1D。

图1 各组大鼠肾功能及肠组织尿酸的变化
3.2 健脾渗湿方对高尿酸血症大鼠肾脏病理损伤及蛋白尿的影响 肾脏是尿酸排泄的主要器官,也是最主要的受累器官。HE染色结果如图2A-C所示,WT组大鼠肾脏组织结构正常,肾小球及周围肾小管、肾皮质、髓质结构清晰。与WT组相比,Uox-/-组大鼠肾小球结构紊乱甚至萎缩,出现大面积的炎细胞浸润,有尿酸钠结晶析出;健脾渗湿方组大鼠肾小球结构相对较完整,尿酸钠结晶、炎症反应均显著减轻。尿蛋白常作为预测肾病的指标之一,检测结果如图2D所示,与WT组相比,Uox-/-组日尿蛋白量显著增加,差异具有统计学意义(P<0.05);健脾渗湿方干预后,JPSSF组日尿蛋白量低于Uox-/-组,但差异无统计学意义(P>0.05)。

图2 各组大鼠肾脏形态学改变(HE染色,×20)及日尿蛋白量
3.3 健脾渗湿方对高尿酸血症大鼠肾脏组织尿酸盐转运蛋白的影响 位于肾小管顶膜、基底膜的4种尿酸盐转运蛋白(UAT、URAT1、OAT1、OAT3)参与了人近曲肾小管对尿酸盐的转运,进而促进尿酸的代谢。结果显示:Uox-/-组 URAT1、UAT、OAT1 基因转录表达水平高于 WT组(P<0.05),JPSSF组 URAT1转录水平低于Uox-/-高尿酸血症组,差异有统计学意义(P<0.05),UAT、OAT1转录水平没有变化。提示健脾渗湿方干预能抑制肾近曲小管对尿酸盐的重吸收,结果见图3A-C。

图3 各组大鼠肾脏组织在转录组水平尿酸盐转运蛋白相关基因mRNA表达
3.4 健脾渗湿方对高尿酸血症大鼠肠道菌群多样性的影响 采用主坐标分析(PCoA)和非度量多维尺度分析(NMDS)法考察大鼠肠道菌群样本间的差异程度以及差异变化规律。PCoA结果显示,WT组菌群组成比较相似,Uox-/-组点间距离比较远,表明高尿酸血症引起肠道菌群紊乱,而JPSSF组组内点间距离和Uox-/-组相近,提示健脾渗湿方药物干预后对高尿酸血症大鼠肠道菌群无明显的影响,结果见图4A。NMDS分析结果显示,Uox-/-组菌群间波动较大,而健脾渗湿方干预后,高尿酸血症大鼠肠道菌群波动变小,菌群稳态,结果见图4B。采用Alpha多样性指数评价组内菌群的多样性。Shannon指数和Simpson指数结果显示,WT组、Uox-/-组之间菌群多样性无明显变化,JPSSF组菌群多样性较Uox-/-组有下降趋势(P>0.05),结果见图 4C-D。
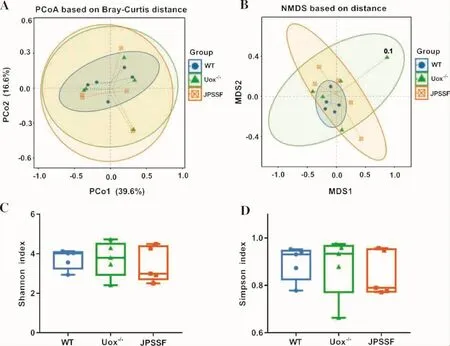
图4 各组大鼠Beta多样性和Alpha多样性分析
3.5 健脾渗湿方对高尿酸血症大鼠肠道菌群门水平的影响 物种相对丰度结果显示,在门水平上厚壁菌门(Firmicutes)、变形菌门(proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、螺旋菌(Spirochaetes)为优势物种,结果见图5A。与WT组大鼠相比,Uox-/-模型组大鼠肠道微生物Firmicutes明显 减 少 ,Bacteroidetes、Actinobacteria、Spirochaetes、Patescibacteria大量增加;与Uox-/-组相比,健脾渗湿方干预后 Firmicutes、Proteobacteria、Bacteroidetes 持续增加,而 Actinobacteria、Spirochaetes、Patescibacteria占比下降且具有一定向WT组恢复趋势,但差异均无统计学意义(P>0.05),结果见表1。聚类热图结果显示,WT组和JPSSF组的物种组成相似性大于WT组和Uox-/-组,结果见图5B。这些结果提示,高尿酸血症改变了大鼠肠道菌群的组成,而健脾渗湿方药物干预后,在门水平上改善肠道菌群变化的作用有限。

图5 各组大鼠门水平上物种的相对丰度(A)和聚类热图(B)
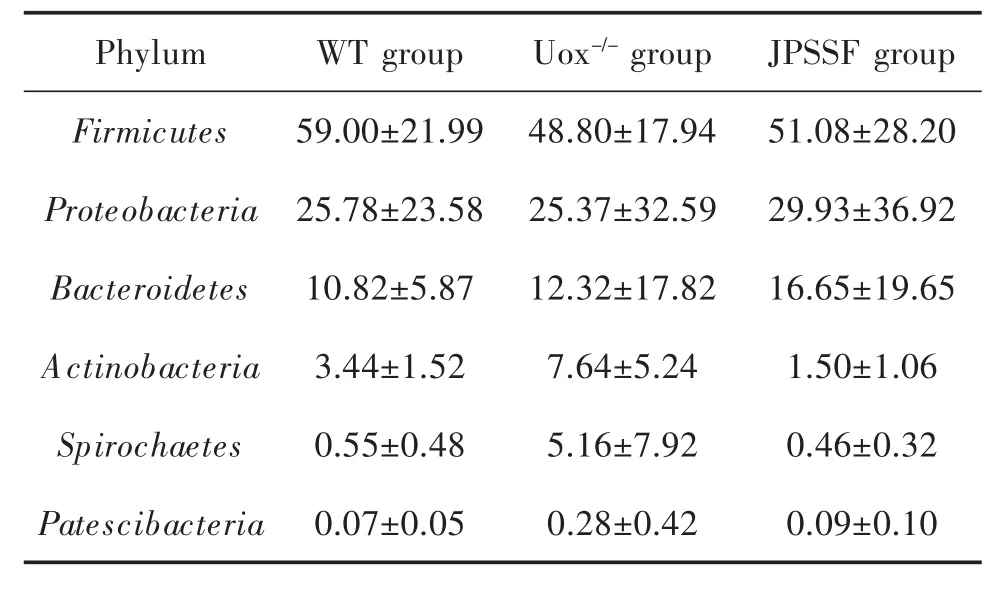
表1 健脾渗湿方对门水平占比较高物种的影响(x± s,n=5,%)
3.6 健脾渗湿方对高尿酸血症大鼠肠道菌群属水平的影响 统计丰度排名前10的物种,在属水平上埃希氏菌-志贺氏菌属(Escherichia-Shigella)、乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)、梭菌属(Clostridium sensu stricto 1)为优势物种,结果见图6A。Uox-/-组丰度前10的物种总量占比明显低于WT组 , 其 中 Escherichia-Shigella,Clostridium sensu stricto 1,Prevotellaceae NK3B31 group,Aerococcus占比大量减少,Proteus,Bifidobacterium占比明显增加,Lactobacillus,Enterococcus无明显变化,差异均无显著性意义(P>0.05);与 Uox-/-组相比,JPSSF 组大鼠肠道菌群 Lactobacillus,Proteus,Prevotellaceae NK3B31 group大量增加且Prevotellaceae NK3B31 group占比接近 WT 组,Clostridium sensu stricto 1,Bifidobacterium占比减少且Bifidobacterium有向WT组恢复趋势,而 Escherichia-Shigella,Aerococcus,Bacteroides无明显变化,差异均无显著性意义(P>0.05),结果与属水平聚类热图一致,见表2和图6B。这些结果表明,健脾渗湿方对高尿酸血症诱导的肠道菌群失调有一定恢复的趋势,但作用并不显著。

表2 健脾渗湿方对属水平占比较高物种的影响(x± s,n=5,%)

图6 各组大鼠属水平上物种的相对丰度(图A)和聚类热图(图B)
4 讨论
动物体内的外源性或内源性嘌呤物质会代谢成黄嘌呤,黄嘌呤在黄嘌呤脱氢酶(Xdh)的催化下生成溶解度较低的尿酸,尿酸在尿酸酶(Uox)的催化下可以进一步转化成溶解度较高的尿囊素[6]。课题组采用CRISPR/Cas9技术敲除Uox基因,获得遗传性状稳定的尿酸酶基因缺失大鼠,该模式动物表型明显,体内尿酸水平明显高于野生型,肾功能异常且肾脏存在损伤[7],为高尿酸血症和痛风的研究提供与人类尿酸代谢规律最接近的模型大鼠。
肾脏是尿酸排泄的主要器官,也是尿酸损伤的重要靶器官,尿酸盐结晶沉积肾脏引起的直接、间接损伤,使肾脏的结构与功能发生病变,导致终末期肾脏疾病的发生[8]。痛风性肾病常以尿酸性肾结石、慢性间质性肾炎和纤维化为特征[9]。在尿酸酶基因缺失高尿酸血症模式动物上,发现肾功能指标包括尿酸及尿素氮显著高于野生对照组,肾小球及肾小管具有显著的病理损伤,而健脾渗湿方药物干预后显著降低尿酸酶基因缺失大鼠血清尿酸和尿素氮水平,减少尿酸钠结晶沉积于肾脏及诱导炎症反应,对尿酸酶基因缺失高尿酸血症模式动物肾损伤具有较好的保护作用。课题组前期在酵母喂养型高尿酸血症模型中,发现健脾渗湿方上调肾小管尿酸盐转运蛋白UAT、OAT3,下调URAT1,从而促进尿酸排泄[10];同时显著改善模型大鼠肾间质纤维化程度,下调大鼠肾脏内 COX-2、TNF-α、TGF-β1表达,从而发挥对肾脏的保护作用[11],上述研究结果与前期的文献报道一致,进一步证明健脾渗湿方对尿酸晶体沉积于肾组织引起肾脏损害及纤维化具有较好的保护效应。
大多数哺乳动物体内的尿酸被尿酸酶催化为更易排出体外的尿囊素,而人类在进化过程中尿酸酶基因发生突变失去功能性,尿酸不能进一步分解[5],使得尿酸的代谢与排泄只能依靠尿液、粪便排出或肠道微生物进一步分解代谢。对于人体来说,体内的尿酸约2/3经肾脏排泄,不到1/3经肠道排泄。尽管院内制剂健脾渗湿方疗效显著,然而课题组前期研究主要聚焦肾脏尿酸代谢途径及相关的损伤,而对于尿酸肠道分解代谢途径,特别是肠道微生物研究较少,因此值得进一步深入研究。
肠道菌群及其构成的微生态环境对机体维持健康有重大意义,充分参与人体的生理、生化、病理和药理的整个过程[12]。有研究报道,机体1/4到1/3的尿酸可以在粪便中恢复,这表明胆道或(和)肠道的分泌是尿酸排泄的一个重要的替代途径,可能潜在地调节血清尿酸水平[13]。大多数健康人肠道菌群由厚壁菌门、拟杆菌门2个优势类群组成[14],本研究体系中各组大鼠的优势类群是厚壁菌门、变形菌门、拟杆菌门。与野生对照组相比,尿酸酶缺失高尿酸血症模型大鼠Firmicutes丰度减少,Bacteroidetes丰度增加,这一结果与高脂饲料诱导高尿酸血症模型肠道菌群分布一致[15]。厚壁菌门的代表性有益作用是产生丁酸盐,缓解肠道炎症反应[16]。健脾渗湿方组大鼠肠道Lactobacillus,Proteus,Prevotellaceae NK3B31 group 有 一定增加,而 Clostridium sensu stricto 1,Bifidobacterium具有减少趋势,但差异均无统计学意义(P>0.05),提示健脾渗湿方对肠道微生物紊乱无明显的影响,其主要通过影响肾脏尿酸排泄途径,减少尿酸晶体沉积于肾组织,从而减轻痛风性肾损害。该方临床更适合具有肾功能损伤的痛风患者,该研究为健脾渗湿方临床应用治疗痛风及相关并发症提供科学依据。
