丹参多酚酸与三七总皂苷合用保护OGD/R损伤胶质细胞线粒体、促进神经因子表达作用研究*
2021-06-11曹玉爽姚荣妹柴丽娟胡利民
曹玉爽,徐 耀,杨 娟,袁 庆,姚荣妹,柴丽娟,胡利民
(天津中医药大学组分中药国家重点实验室,天津 301600)
中风是全球第二大死亡原因,多为缺血性中风[1]。生理状态下的大脑活动高度依赖能量,线粒体作为能量供应的介导者,将能量需求与ATP供应相匹配,调节Ca2+信号,协调局部代谢[2]。但缺血性中风发生过程中,脑内环境稳态遭到破坏,线粒体代谢障碍、信号转导改变等的相应发生最终导致细胞的凋亡和坏死,造成人体出现某些难以恢复的机能障碍[3-4]。在此过程中,星形胶质细胞激活可上调神经生长因子的分泌以及多种蛋白质的合成,增加谷氨酸摄取能力,有助于脑缺血后受损神经元的修复和再生;但脑缺血再灌注损伤也会导致星形胶质细胞功能受损,继而加重神经元的死亡[5-8]。因此保护脑缺血/再灌注后星形胶质细胞结构与功能的完整性是研究的热点之一。
注射用丹参多酚酸和血栓通注射液在临床上常用于治疗缺血性中风,研究证明,前者对缺血性脑中风恢复期有很好的治疗效果[9],后者可改善脑梗死患者的炎症损伤和神经受损[10],疗效显著,但研究对其作用的机制了解较少[11-12]。本研究以中风后星形胶质氧化为关注点,探讨上述二药的组分丹参多酚酸和三七总皂苷合用对胶质细胞线粒体的保护作用及机制,并进一步研究胶质细胞受到保护后神经营养因子的表达情况,以更好地阐释丹参多酚酸和三七总皂苷在脑缺血再灌注损伤中的保护机制。
1 材料
1.1 材料与试剂 注射用丹参多酚酸(天津天士力之骄药业有限公司),注射用血栓通(冻干)(广西梧州制药(集团)股份有限公司),DMEM/F12、特级胎牛血清(fetal bovine serum,FBS),Hanks、D-Hanks、0.25%胰蛋白酶、L-谷氨酰胺(L-glutamine,L-Glu)、青霉素-链霉素(Penicillin-Streptomycin Solution,PS)均购自美国Gibco公司,多聚甲醛、牛血清白蛋白(albumin from bovine serum,BSA)、山羊血清、EBSS、TBST、电转液、bicinchoninic acid(BCA)试剂盒(北京索莱宝科技有限公司),CCK-8试剂盒(日本同任化学研究所),Trizol试剂、Tetramethylrhodamine(TMRM)、CM-H2DCFDA(美国 Invitrogen公司),Servicebio®RT First Strand cDNA Synthesis Kit(武汉塞维尔生物科技有限公司),SYBR GREEN PCR master Mix(美国Applied Biosystem公司),鞘液(美国BD公司),RIPA裂解液(上海碧云天生物技术有限公司),Anti-GFAP(英国 Abcam 公司),Anti-HIF-1α(美国 Abcam公司),Anti-β-actin、Anti-Akt/p-Akt、Anti-mTOR/pmTOR、Anti-PI3K/p-PI3K、Anti-p44/42/p-p44/42(美国CST公司),羊抗鼠IgG抗体-HRP、羊抗兔IgG抗体-HRP(北京中杉金生物科技有限公司),Fluo-3,AM(凯基生物)。
1.2 主要仪器 CO2培养箱(美国Thermo公司),离心机(德国Eppendorf公司),倒置荧光显微镜(日本尼康公司),倒置相差显微镜(美国Zeiss公司),缺氧小室(加拿大STEMCELL Technologies),多功能酶标仪(瑞士TECAN公司),实时荧光定量PCR仪、C1000PCR扩增仪(美国BIO-RAD),超微量核酸分析仪(日本马康Malcom),Western Blot电泳槽、转膜仪(上海天能),Western Blot凝胶成像系统(美国GE公司),流式细胞仪FACS Calibur(美国BD),恒温摇床(中国巴玖公司)。
2 方法
2.1 大鼠原代星形胶质细胞的培养与鉴定
2.1.1 大鼠原代星形胶质细胞的培养 培养方法参照相关文献[13-15],将大鼠酒精浸泡处死后,断头,将脑组织取出放入预冷的PBS中,取出脑膜及大血管,分离两侧皮质,用灭菌液(含5%PS的PBS)清洗两次并剪碎至呈乳糜状,加入0.25%EDTA消化10 min再以全培(1%PS+1%L-Glu+15%FBS+83%DMEM/F12)终止消化。离心后重悬,过200目细胞筛,将所得滤液再次离心、全培养基重悬后,接种于培养瓶中,CO2恒温培养箱中培养1 h后,收集上层培养液。转移至新的培养瓶继续培养,每3 d换液1次。8~9 d后置于气浴摇床中260 r/min震摇20 h弃去培养液即可传代备用。本实验选用二代及以上细胞。
2.1.2 大鼠原代星形胶质细胞的鉴定 倒置显微镜下细胞生长状态,待生长至约70%~80%时,用预冷PBS清洗细胞,4%多聚甲醛固定15 min,PBS洗去多聚甲醛后加入封闭液(5%山羊血清+0.3% Triton X-100+PBS)于室温封闭60 min,随后加入anti-GFAP抗体(1∶250稀释),4℃过夜孵育。次日吸弃一抗,PBS洗涤2次,加入辣根过氧化物酶标记的羊抗兔二抗,室温避光孵育30 min,再以PBS清洗后加入DAPI核染液室温放置2 min,即可置于荧光显微镜下观察拍照。
2.2 OGD/R模型的建立与药物有效浓度的筛选
2.2.1 OGD/R模型的建立 将细胞接均匀种于96孔板中,接种密度1×105个/cm2,待生长至80%将其分为Con组和OGD/R组并进行以下处理。
Con组:将细胞培养液更换为新鲜的DMEM/F12全培基,置于CO2培养箱中培养相应时间后更换为含7.5%血清全培基。
OGD/R组:将培养液更换为EBSS平衡盐溶液,放入缺氧小室并通入95% N2、5% CO2气体5 min,而后将缺氧小室置于37℃恒温箱中培养。在氧糖剥夺2、3、4 h后,打开缺氧小室,将细胞上层EBSS更换含7.5%血清全培基做复氧处理 2、3、4、24、48、72 h。弃去培养液,在96孔板中加入CCK-8工作液37℃孵育60 min,450 nm波长检测吸光度。
2.2.2 药物对正常培养和OGD/R处理胶质细胞活力的影响 细胞接种情况同上,待生长至80%,将培养液更换为含不同浓度丹参多酚酸组分(1.625、3.125、6.25、12.5、25、50、100、200、400 μg·mL-1)或三七总皂苷 组 分(3.125、6.25、12.5、25、50、100、200、400、800 μg·mL-1)的含药培养基正常培养 24h,CCK-8法检测细胞活力,筛选药物的无毒性剂量。
药物对OGD/R处理胶质细胞活力的影响:根据“2.2.1”所确定的OGD/R模型条件,给予不同浓度含药培养基干预24 h后CCK-8法检测细胞活力,筛选药物的有效剂量。
2.3 药物对OGD/R损伤星形胶质细胞的保护作用与机制
2.3.1 流式细胞术检测星形胶质细胞线粒体膜电位将细胞均匀接种于6孔板中,种植密度为1×105个/cm2,待细胞生长至80%时,根据“2.2.1”所确定的模型条件,将细胞为Con组、OGD/R组和给药组。OGD/R组和给药组做氧糖剥夺处理,复氧复糖时给药组另加入“2.2.2”所确定的剂量的药物。复氧复糖处理后加入TMRM工作液1 mL/孔,37℃避光孵育,30 min后对细胞进行消化处理,离心后以PBS重悬细胞,流式分析。
2.3.2 流式检测星形胶质细胞包内钙离子浓度 细胞处理同“2.3.1”,复氧复糖处理后加入含Fluo-3,AM的培养液避光孵育30 min,再加入HBSS避光孵育20 min,胰酶消化制成单细胞悬液,离心后以HBSS重悬细胞,流式检测。
2.3.3 流式检测星形胶质细胞ROS释放量 细胞处理同“2.3.1”,复氧复糖处理后加入CM-H2DCFDA工作液,避光孵育30 min,清洗细胞后可直接用于荧光拍照(488/525)或同制成单细胞悬液进行流式分析。
2.3.4 RT-PCR法检测HIF-1α mRNA的表达 细胞处理同“2.3.1”,复氧复糖后Trizol试剂提取总RNA,超微量核酸分析仪560 nm/580nm定量分析。按照 Servicebio®RT First Strand cDNA Synthesis Kit试剂盒说明书和SYBR GREEN PCR Master Mix试剂盒说明书进行逆转录和扩增(HIF-1α引物序列为F:CCGATGGAAGCACTAGACA;R:CAAAGCGACAGATAACACG),检测HIF-1α的mRNA表达情况。
2.3.5 Western Blot法检测 HIF-1α、PI3k信号通路蛋白的表达 细胞处理同“2.3.1”,复氧复糖处理后加入蛋白酶裂解液提取总蛋白,利用BCA试剂盒定量并加热100℃,10 min使其变性。12%SDS-PAGE胶进行电泳(170 V,45 min)、而后250 mA将蛋白转移到PVDF膜上,5%脱脂奶粉封闭2 h,加入1∶1 000稀释的一抗(HIF-1α、PI3k、Akt、mTOR 抗体)4℃孵育过夜,TBST,5 min每次清洗后3次后,加入二抗(1∶10 000)室温孵育1 h,ECL显影,GE凝胶成像系统成像。
2.4 药物对OGD/R损伤后星形胶质细胞神经营养因子表达的影响 RT-PCR法检测BDNF、NGF、IGF-1α mRNA的表达,实验方法同前。引物序列见表1。

表1 引物序列
2.5 统计方法 SPSS17.0统计软件分析数据,表示结果,one-way ANOVA(单因素方差分析)分析数据,P<0.05为具有统计学差异。
3 结果
3.1 大鼠原代星形胶质细胞的培养与鉴定 如图1所示,星形胶质细胞在培养瓶中培养7 d后,星形胶质细胞形状多为不规则多角形,可见粗短枝状胞突,胞体大而扁平,符合神经胶质细胞生长特性。神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)荧光染色阳性,表明研究培养星形胶质细胞成功,且纯度较高,可用于后续实验。
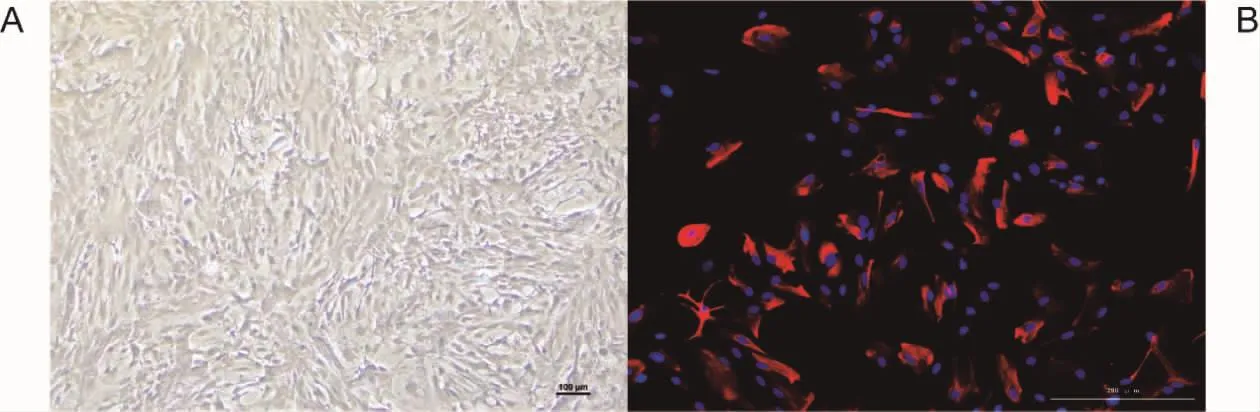
图1 原代星形胶质细胞的生长情况与鉴定
3.2 细胞OGD/R模型建立与药物有效浓度筛选
3.2.1 氧糖剥夺不同时间对星形胶质细胞活力的影响如图2A-C所示,与Con组相比,OGD 2 h/R 48、72 h,OGD 3 h/R 2、3、4、24、48、72 h,OGD 4 h/R 2、3、4、24、48 h细胞活力均显著下降(P<0.05)。故研究采用OGD 4 h/R 24 h作为星形胶质细胞缺氧复氧处理模型。
3.2.2 药物对正常星形胶质细胞活力的影响 如图2D-E所示,与Con组相比,丹参多酚酸组分在1.625~200 μg·mL-1范围内对细胞活力没有显著性差异(P>0.05),三七总皂苷组分在 3.125~800 μg·mL-1对细胞活力均没有显著性差异(P>0.05),提示本实验所选药物浓度对细胞没有毒性。
3.2.3 药物对OGD/R损伤星形胶质细胞活力的保护作用 如图 2F-H所示,与Con组相比,OGD/R组星形胶质细胞的活力显著降低(P<0.05);与OGD/R组比较,25 μg·mL-1丹参多酚酸组分显著提高星形胶质细胞活力(P<0.05);三七总皂苷组分所选取浓度均能显著提高受损细胞活力(P<0.05)。故选取丹参多酚酸组分 25 μg·mL-1和三七总皂苷组分 6.25 μg·mL-1进行后续实验。
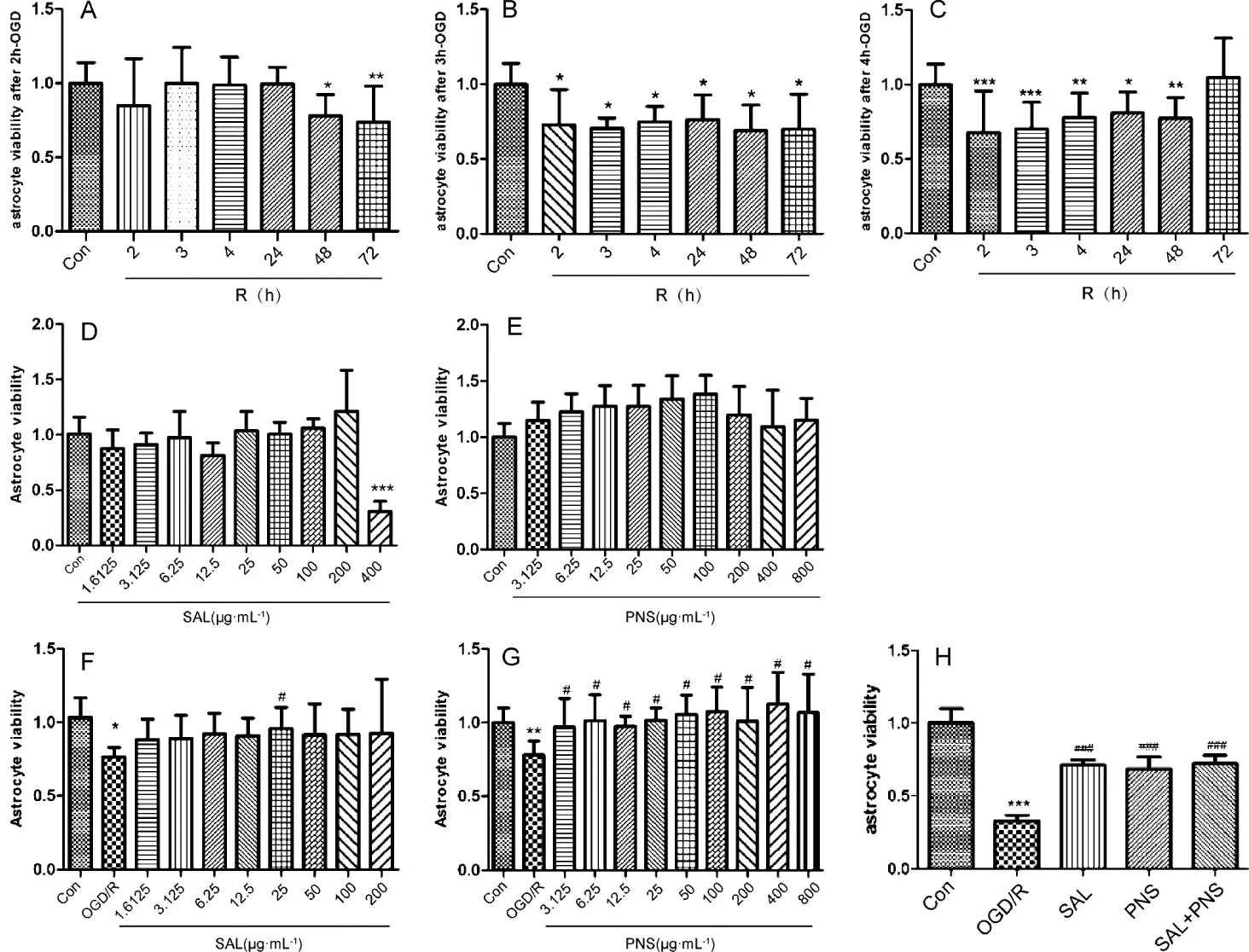
图2 药物及不同OGD/R时间对星形胶质细胞活力的影响(±s,n=18)
3.3 药物对OGD/R损伤星形胶质细胞的线粒体的保护作用
3.3.1 药物对OGD/R损伤星形胶质细胞线粒体膜电位、胞内钙离子浓度及ROS释放量的影响 结果如图3所示,A-C:与Con组相比,OGD/R组星形胶质细胞荧光强度降低,线粒体膜电位降低;与OGD/R组相比,丹参多酚酸组分(25 μg·mL-1)、三七总皂苷组分(6.25 μg·mL-1)、丹参多酚酸(25 μg·mL-1)与三七总皂苷(6.25 μg·mL-1)合用均可升高 OGD/R 损伤后星形胶质细胞的线粒体膜电位。流式细胞仪检测细胞内Ca2+浓度,与Con组相比,OGD/R组星形胶质细胞内荧光强度增强,Ca2+浓度升高(P<0.05);与OGD/R 组相比,丹参多酚酸组分(25 μg·mL-1)可显著降低胞内Ca2+浓度(P<0.05);三七总皂苷组分(6.25 μg·mL-1)、丹参多酚酸(25 μg·mL-1)与三七总皂苷(6.25 μg·mL-1)合用均可对 Ca2+浓度无影响(P>0.05)。F-H:与Con组相比,OGD/R组细胞ROS释放量显著增加(P<0.05);与OGD/R组相比,丹参多酚酸组分(25 μg·mL-1)、三七总皂苷组分(6.25 μg·mL-1)、丹参多酚酸(25 μg·mL-1) 与三七总皂苷(6.25 μg·mL-1)合用均可显著降低OGD/R损星形胶质细胞ROS的释放量(P<0.05)。可见,丹参多酚酸、三七总皂苷及其合用可显著降低OGD/R损伤后星形胶质细胞的ROS释放,提高线粒体膜电位。
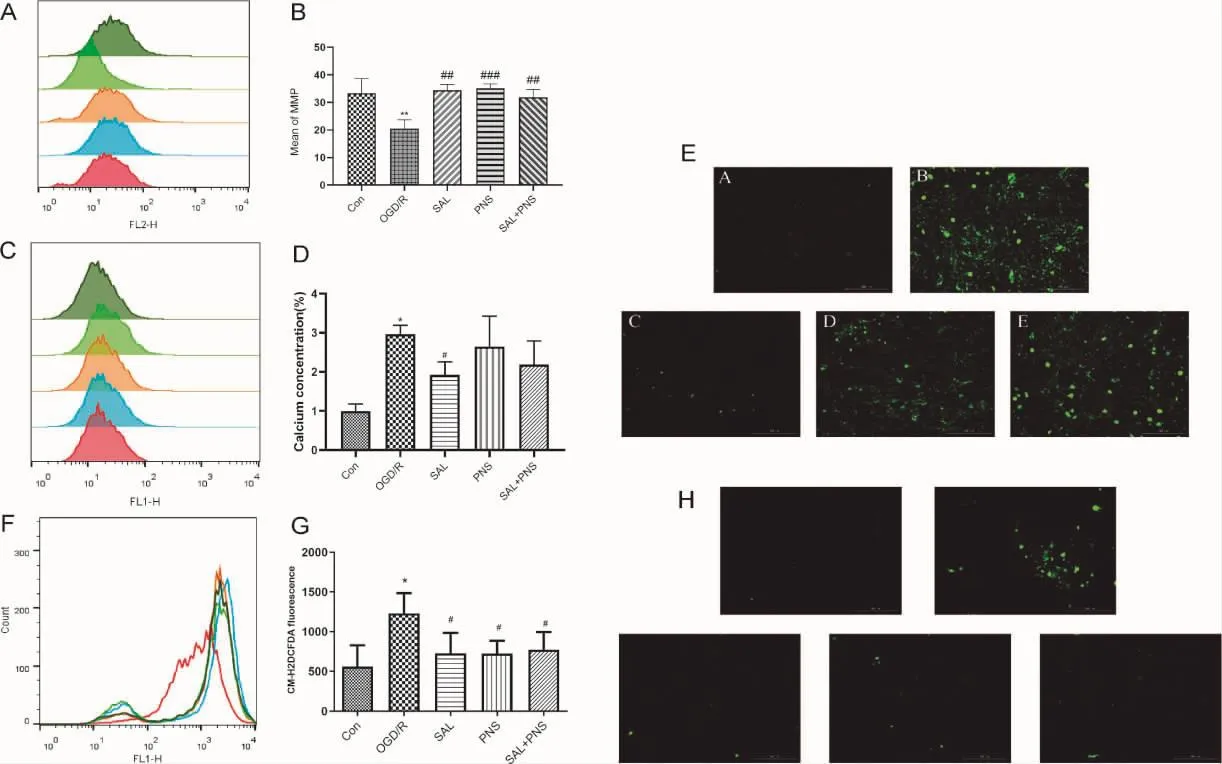
图3 药物对OGD/R损伤星形胶质细胞线粒体的影响
3.3.2 药物对OGD/R损伤星形胶质细胞HIF-1α、PI3K/Akt/mTOR通路的作用 RT-PCR与Western Blot结果如图4所示,A-B:与Con组相比较,OGD/R组细胞HIF1α mRNA表达显著升高(P<0.05);与OGD/R 组相比,丹参多酚酸组分(25 μg·mL-1)、三七总皂苷组分(6.25 μg·mL-1)、丹参多酚酸(25 μg·mL-1)与三七总皂苷(6.25 μg·mL-1)合用均可显著降低 OGD/R损伤星形胶质细胞HIF-1α蛋白的表达(P<0.05)。C-E:与Con组比较,OGD/R组能显著降低星形胶质细胞 PI3K/Akt蛋白磷酸化水平(P<0.05);与OGD/R组比较,丹参多酚酸组分(25 μg·mL-1)、三七总皂苷组分(6.25 μg·mL-1)、丹参多酚酸(25 μg·mL-1)与三七总皂苷(6.25 μg·mL-1)合用均能升高 PI3K 蛋白磷酸化水平(P<0.05);三七总皂苷组分(6.25 μg·mL-1)能显著升高Akt蛋白磷酸化水平(P<0.05),丹参多酚酸组分(25 μg·mL-1)、丹参多酚酸(25 μg·mL-1)与三七总皂苷(6.25 μg·mL-1)合用对 Akt蛋白磷酸化水平有升高作用,但不具有显著性差异(P>0.05);与Con比较,OGD/R组mTOR磷酸化水平略有升高但不具有显著性差异(P>0.05);与OGD/R组相比较,丹参多酚酸组分组(25 μg·mL-1)能显著升高 mTOR 磷酸化水平(P<0.05);而三七总皂苷组分(6.25 μg·mL-1)、丹参多酚酸(25μg·mL-1)与三七总皂苷(6.25 μg·mL-1)合用对mTOR蛋白磷酸化水平的改变无显著性差异(P>0.05)。可见,丹参多酚酸和三七总皂苷对损伤星形胶质细胞的作用途径可能与PI3K/Akt/mTOR信号通路相关。
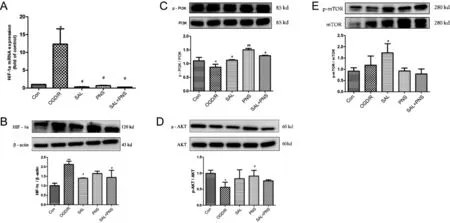
图4 药物对OGD/R损伤星形胶质细胞HIF-1α、PI3K/Akt/mTOR信号通路的影响
3.4 药物对OGD/R损伤后星形胶质细胞神经营养因子表达的影响 RT-PCR结果如图5所示,与Con组相比较,OGD/R组细胞BDNF、IGF-1α mRNA表达显著降低(P<0.05),IGF-1α mRNA 无显著差异(P>0.05);与 OGD/R 组相比,丹参多酚酸组分(25 μg·mL-1)单用和与三七总皂苷组分(6.25 μg·mL-1)合用均可显著提高OGD/R损伤后星形胶质细胞BDNF、NGF、IGF-1α mRNA 的表达(P<0.05);三七总皂苷组分(6.25 μg·mL-1)可显著升高 OGD/R 损伤星形胶质细胞 BDNF mRNA 表达(P<0.05),对 NGF、IGF-1α mRNA有上调趋势,但无统计学意义(P>0.05)。可见,丹参多酚酸、三七总皂苷及其合用可增加胶质细胞神经营养因子的表达。
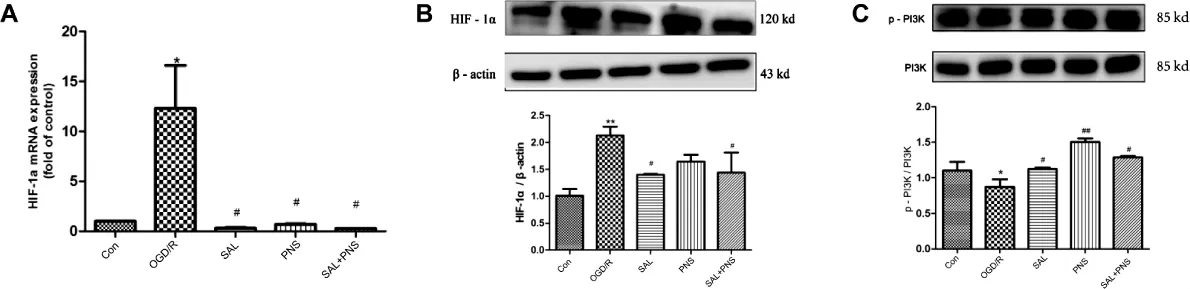
图5 药物对OGD/R损伤后胶质细胞神经营养表达的影响
4 讨论
中风是由脏腑失调,气血逆乱,直冲犯脑引起的脑脉痹阻或血溢脑脉之外,临床以半身不遂、口舌歪斜、言语謇涩或不语等为常见症状。因其高发病率、高致残率、高死亡率、高复发率和多并发症的“四高一多”的特点,一直为研究热点。近年来,中医药在中风方面研究较多,凸显了中医药独特、良好的发展前景。
注射用丹参多酚酸由丹参多酚酸组成,具有活血通络的功效,常用于中风病恢复期瘀血阻络证。研究发现,注射用丹参多酚酸可有效改善患者的早期临床症状、促进远期神经功能恢复,安全性高,值得临床推广使用[16-17]。血栓通注射液的主要成分是三七总皂苷,具有活血化瘀、扩张血管、改善血液循环的功效,常用于脑血管病后遗症。研究表明,血栓通注射液的辅助治疗可以促进患者神经功能恢复,改善血液流变学指标,提高患者的生活自理能力[18-19]。
尽管疗效显著,注射用丹参多酚酸和血栓通注射液的作用机制尚不十分明确。胶质细胞作为脑中最丰富的细胞[20],在维持大脑的正常生理状态中起重要作用[21-22]。然而,在缺血性损伤时,星形胶质细胞分泌炎性因子,例如血管内皮生长因子(VEGF),基质金属蛋白酶(MMPs),直接或间接地加剧脑损伤,破坏血脑屏障。此外还可通过释放营养因子维持BBB稳态,支持和保护神经元,还可通过调节离子平衡来维持内环境稳态[23],为葡萄糖和其它代谢物在血液和神经元之间的传播提供途径[24-25]。因此,本实验立足于药物对星形胶质细胞的保护作用,研究其发挥疗效的作用机制。
4.1 药物对损伤后胶质细胞线粒体的保护 线粒体是活性氧ROS的产生场所和靶点,也是ATP水平和钙稳态的调节剂,是细胞代谢的重要场所。线粒体膜电位(MMP)维持线粒体进行磷酸化、决定三磷酸腺苷产生,膜电位的稳定利于维持细胞的生理功能。研究近年来发现,伴随MMP的下降,细胞在不同因子作用下发生凋亡,该下降早于DNA片段化,在细胞凋亡早期病理变化以前就开始。中风发生时,氧和葡萄糖的缺乏会造成能量衰竭、线粒体功能障碍、ROS增加。研究利用流式细胞仪观察OGD/R后胶质细胞的线粒体膜电位、细胞内钙离子以及ROS的变化。结果显示,丹参多酚酸、三七总皂苷、丹参多酚酸与三七总皂苷合用可通过调节星形胶质细胞ROS释放量、胞内钙离子浓度、线粒体膜电位改善缺血再灌注造成的损伤。
PI3K/Akt途径是细胞相应胞外生存和生长的信号的转导途径。催化亚基p110和调节亚基p85构成二聚体磷脂酰肌醇激酶(PI3K),当PI3K与EGF生长因子等受体结合后,可活化Akt,Akt激活后促进或抑制下游蛋白如Caspase9、Bad等凋亡蛋白的表达,从而调节细胞的增殖、分化、凋亡和迁移。PI3K/Akt下游靶点为雷帕霉素靶蛋白(mTOR),mTOR的下游转录因子则包括了c-Myc、FoxO、HIF-1α等明星分子。研究结果显示丹参多酚酸组分、三七总皂苷组分、丹参多酚酸与三七总皂苷合用可通过抑制PI3K/Akt/mTOR通路发挥药效作用。
4.2 药物对损伤后胶质细胞分泌神经营养因子的影响BDNF和NGF属于神经营养因子家族,在神经元的生长和分化过程中至关重要。胰岛素样生长因子-1(IGF-1)是几乎所有组织中都存在的多能生物活性物质。这些活跃在大脑中的分子涉及能量和葡萄糖稳态等多种调节机制,影响机体不同的病理和生理过程,包括神经元的存活、学习、记忆和损伤修复等。本实验采用RT-PCR方法,以BDNF、NGF和IGF-1α的表达作为评价指标,发现丹参多酚酸和三七总皂苷组分及其合用对OGD/R损伤星形胶质细胞神经营养因子表达的促进作用。
关于中风病的治疗药物研究已展开多年,目前被FDA认证有效的治疗药物只有一个,即重组人纤溶酶原激活物[26],但因受时间窗限制,临床上真正得到治疗的患者相对较少。中药不乏活血化瘀、醒脑开窍的良药,但因作用机制研究相对较少,使其临床推广应用受到限制,因此中药的发病机制阐明是目前中药发展和推广中亟待解决的一大问题。本实验研究发现,丹参多酚酸、三七总皂苷、丹参多酚酸与三七总皂苷合用可通过保护OGD/R损伤后星形胶质细胞线粒体、促进神经营养因子的表达发挥治疗作用,为中药治疗中风的作用机制阐释提供了理论依据。
