电离辐射对大鼠下颌下腺旁细胞途径分泌的影响
2021-06-10吴言辉许辉姚清婷刘少华艾皮孜古丽亚库普路利丹石亮
吴言辉 许辉 姚清婷 刘少华 艾皮孜古丽·亚库普 路利丹 石亮
1.新疆医科大学,乌鲁木齐830054;2.新疆维吾尔自治区人民医院口腔颌面外科,乌鲁木齐830001;3.山东大学齐鲁医院口腔颌面外科,济南250012;4.山东大学口腔医学研究所,济南250012
放射损伤造成的口腔干燥症是头颈部鳞状细胞癌放疗后最常见的并发症之一[1]。电离辐射损伤涎腺导致分泌功能降低可伴发猖獗龋、吞咽及语言功能障碍等,严重影响生活质量。因此,对电离辐射涎腺损伤机制更好地了解可为防治唾液腺分泌功能异常提供新的思路。下颌下腺唾液分泌量占口腔静息分泌总量的60%~65%,对维持口腔湿润起重要作用。在生理状态下毒蕈碱型乙酰胆碱受体(muscarinic acetylcholine receptor,M 受体)亚型M3 调控水通道蛋白5(aquaporin 5,AQP5)介导的涎腺跨细胞分泌与claudin-4 介导的涎腺旁细胞分泌途径是下颌下腺水和电解质转运的两种重要方式[2]。通常紧密连接(tightjunction,TJ)为维持唾液腺上皮的极性、建立正常的跨上皮细胞离子梯度提供了重要保障,是水、离子和小分子物质经过旁细胞途径转运的结构基础和限制因素。电离辐射损伤后AQP5介导的涎腺跨细胞分泌途径损伤可能参与唾液腺分泌功能低下[3-4]。但是目前关于放射损伤对TJ 超微结构介导的旁细胞分泌途径影响如何,以及在旁细胞途径中对离子调控起主导作用的claudin-4 如何改变尚不清楚。本实验旨在建立大鼠下颌下腺放射损伤模型,探讨电离辐射对下颌下腺TJ 超微结构及claudin-4 的影响,为进一步阐述电离辐射后唾液腺的损伤机制,防治唾液腺分泌功能异常提供新的思路。
1 材料和方法
1.1 主要材料和仪器
8 周龄健康雄性Wistar 大鼠24 只,体重250 g,由新疆医科大学实验动物中心提供,研究经过新疆医科大学实验动物伦理委员会批准(批准号:IACUC20190704-01)。
医用直线加速器(Elekta公司,瑞典),ECLIPSE Ci-L951175 光学显微镜(Nikon 公司,日本),JEM-1230 透射电子显微镜(JEOL 公司,日本),IX71-12FL/PH 型荧光显微镜(OLYMPUS 公司,日本),M3 受体抗体(bs-1289R,1∶50)购于北京博奥森生物技术有限公司;AQP5抗体(178615,1∶50)购于美国Sigma公司;claudin-4抗体(BS-1068,1∶50)购于美国Bioworlde公司。
1.2 方法
1.2.1 大鼠下颌下腺放射损伤模型的建立 将Wi‐star大鼠随机分为对照组和照射组,照射组又分为照射后1、4、12 周组,每组6 只。研究证实15 Gy以上剂量照射可以造成涎腺组织不可逆性损伤,本实验参照文献[5]报道一次性给予下颌下腺20 Gy照射。具体操作如下。大鼠经腹腔注射10%水合氯醛麻醉,医用直线加速器一次性给予右侧下颌下腺区20 Gy 照射[6](射线类型:电子线;能量:6 MeV;剂量率:4 Gy·min-1;中心皮距:100 cm)。照射前标记照射区域(暴露区域:2.5 cm×2.0 cm),照射范围包括全部的右侧下颌下腺。其他部位由3 mm铅板遮挡,避免射线影响。
1.2.2 腺体分泌量检测 照射后1、4、12周,各组大鼠再次麻醉,于口底前部将直径0.5 mm 的聚乙烯塑胶管插入右侧下颌下腺导管内,右侧颊部制备隧道将聚乙烯塑胶管引出口外固定。待大鼠恢复意识2 h后,在插管当日上午9~12时测量腺体的分泌量,采用Schirmer 实验,以5 min 内滤纸条(35 mm×5 mm)湿润的长度来表示分泌多少。测量结果重复2次,间隔10 min,取平均值[4]。
1.2.3 腺体组织的病理学观察 游离摘除右侧腺体,取部分组织10%中性甲醛固定,脱水、包埋、切片,厚5 μm,苏木精-伊红(hematine-eosin,HE)染色,封固。每组在400倍光学显微镜下随机选取10 个镜下视野,观察腺体病理学变化,用图像测量软件Image J 1.46r计数腺泡细胞数目,取均值[4]。
1.2.4 透射电镜观察腺体TJ 超微结构 取1 mm3组织,2.5%戊二醛固定、冲洗、1%锇酸固定,脱水、包埋、切片,醋酸双氧铀及枸椽酸铅染色,50 000 倍透射电镜下观察TJ 超微结构变化,每组随机选取10个镜下视野测量宽度,取均值[7]。
1.2.5 免疫荧光检测M3、AQP5、claudin-4 的分布取部分组织10%中性甲醛固定,脱水、包埋、切片,微波修复15 min,室温30 min,M3、AQP5、claudin-4(1∶50) 4 ℃孵育过夜。Cy3-IgG (1∶100)37 ℃孵育1 h,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI) 孵 育 5 min,核染,封片,荧光显微镜下观察分布变化,M3、AQP5 每例随机选取10 个不同腺泡细胞,每组6例,定量计算荧光强度,取均值(claudin-4 选取导管细胞)[8]。
1.2.6 蛋白质印迹(Western blot)检测M3、AQP5、claudin-4的表达 取冰冻组织,裂解离心,BCA法测蛋白浓度。40 μg总蛋白12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate poly‐acrylamide gelelectrophoresis,SDS-PAGE),聚偏氟乙烯膜(polyvinylidene difuoride,PVDF)200 mA下M3 120 min,AQP5、claudin-4 70 min,β-actin 90 min。5%脱脂奶粉TBST(Tris-base,NaCl,冰醋酸,吐温20) 室温2 h,M3、AQP5(1∶1 000),claudin-4(1∶800),β-actin(1∶500)4 ℃孵育过夜。辣根过氧化物酶(horse radish peroxidase,HRP)二抗(1∶50 000)孵育2 h。化学发光剂发光并观察检测结果,采用BandScan分析胶片的灰度值。
1.3 统计学方法
采 用 GraphPad Prism 8.0 及 IBM SPSS 26.0 统计软件进行数据分析,采用K-S检验证实数据为正态分布,Levene 检验数据方差齐,实验结果以均数±标准差表示。整体比较采用单因素方差分析,组间两两多重比较采用LSD 法,各照射组与对照组进行比较后,照射组组间再进行两两比较。检验水准为双侧α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 分泌量变化
Schirmer 实验结果显示,对照组及照射后1、4、12 周唾液分泌量分别为 (2.09±0.05)、(1.51±0.05)、(1.46±0.04)、(1.19±0.05)mm,照射侧腺体分泌量在1、4、12 周较对照组明显降低(P<0.01);4周较1周降低,但差异无统计学意义(P>0.05);12周较1、4周时分泌量明显降低(P<0.01)。
2.2 病理学变化
对照组腺体组织光镜下可观察到清晰的腺泡和导管结构;照射后1周可见腺体间质淤血水肿,局灶腺上皮细胞胞浆空泡变,少数细胞核核固缩、深染,查见少量炎细胞浸润;照射后4周仍可见间质水肿、空泡变、核固缩、核深染,查见小灶腺体坏死伴少量中性粒细胞浸润;照射后12 周间质淤血水肿减轻,仍可见细胞胞浆空泡变,部分腺上皮细胞核核固缩、深染,查见多处小灶性腺体坏死伴中性粒细胞浸润(图1)。经腺泡细胞计数,对照组腺泡细胞为每视野(517.90±16.44)个,电离辐射后1、4、12 周照射组腺泡细胞数分别为(510.60±14.08)、(452.20±12.06)、(357.10±11.48) 个。经统计学分析,照射后1周腺泡细胞数与对照组的差异无统计学意义(P>0.05),4、12周明显小于对照组(P<0.01),12周较4周明显减少(P<0.01)。
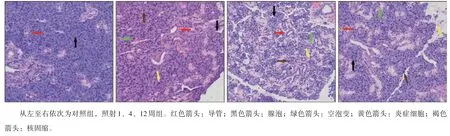
图 1 下颌下腺电离辐射后的组织形态学变化 HE × 400Fig 1 The histomorphological changes of the submandibular glands after irradiation HE × 400
2.3 TJ超微结构变化
对照组腺体相邻腺泡上皮细胞间靠近腺泡腔的位置可观察到基本完整、清晰的细胞间TJ 结构(图2)。与对照组相比:1 周TJ 结构模糊、崩塌;4 周电子密度降低;12 周模糊、崩塌明显(图2)。对照组的TJ 宽度为(17.46±0.07)nm,电离辐射1、 4、 12 周 照 射 组 的 TJ 宽 度 分 别 为 (12.67±0.11)、(12.60±0.09)、(9.67±0.10)nm。经统计学分析,照射后1、4、12 周的TJ 宽度明显小于对照组(P<0.01),照射后4周与1周的差异无统计学意义(P>0.05),照射后12 周显著少于1、4 周(P<0.01)。
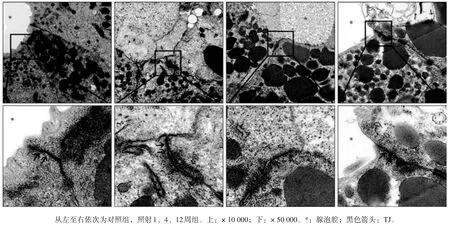
图 2 电离辐射对下颌下腺TJ超微结构的影响 透射电镜 × 50 000Fig 2 Effects of radiation on TJ ultrastructure in submandibular glands transmission electron microscopy × 50 000
2.4 M3、AQP5及claudin-4分布变化
各组M3、AQP5 及claudin-4 的分布变化见图3、4。对照组M3 弥散分布在腺泡细胞的胞浆和胞膜上,AQP5 主要分布在腺泡细胞和导管细胞的顶、侧膜上;照射后各时间点M3、AQP5 的荧光分布无明显改变。但其荧光强度逐渐减弱(P<0.01),照射后4、12周较1周明显降低,差异有统计学意义(P<0.01),12 周与4 周相比荧光强度减弱(P<0.05)。对照组claudin-4 主要分布在导管细胞的侧膜和基底膜上。照射后各时间点claudin-4的荧光分布特性没有明显改变。但其荧光强度持续增强(P<0.01),照射后4 周较1 周增加(P<0.05),12 周与1、4 周相比荧光强度明显增强,差异有统计学意义(P<0.01)。
2.5 M3、AQP5及claudin-4表达变化
Western blot 检测结果见图5。由图5 可见,与对照组相比,照射后1、4、12 周M3、AQP5 蛋白表达持续下调,差异有统计学意义(P<0.01),12周时蛋白表达量较1、4 周降低,差异有统计学意义 (P<0.05);而claudin-4 在照射后1、4、12 周蛋白水平显著高于对照组,呈时间依赖性高表达(P<0.01),12 周时蛋白表达量较1、4 周增加,差异有统计学意义(P<0.05)。
3 讨论
照射和炎症可能导致腺泡细胞凋亡和/或功能障碍,造成组织损伤,唾液分泌能力降低,这可能是头颈部癌症放疗患者以及自身免疫性疾病如干燥综合征患者唾液腺分泌功能低下的主要原因[9-10],其具体机制尚不清楚。TJ 广泛存在于所有上皮或内皮细胞间连接的最顶端,是物质经旁细胞途径转运的结构和功能基础。TJ 在涎腺上皮构成一个动态、可被调控的旁细胞屏障,其表达与分布的改变会引起通透性的变化,从而影响旁细胞途径的水分泌。许多内源或外源性刺激可通过激活某些信号转导通路作用于TJ,影响其结构和功能,旁细胞途径生理性屏障功能受损,通透性发生改变,诱发病理性损害。研究[8]证实激活M3受体介导TJ 的开放程度,可以调控唾液分泌。本实验通过建立下颌下腺放射损伤模型,观察腺体分泌功能、组织学变化、TJ超微结构变化、M3受体、AQP5 及TJ 蛋白claudin-4 的表达分布改变。显示电离辐射后早期TJ 宽度的减少,M3 受体与AQP5 蛋白下调,claudin-4 表达增多可能是下颌下腺放射损伤后唾液分泌功能减退的重要原因。
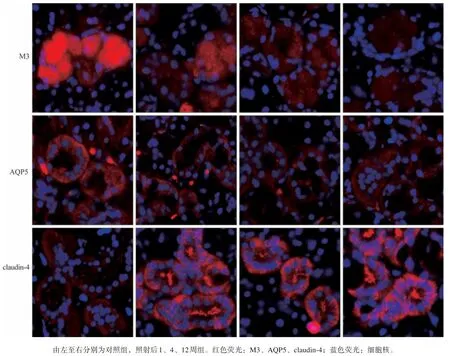
图 3 下颌下腺电离辐射后M3、AQP5、claudin-4的分布改变 免疫荧光染色 × 400Fig 3 The changes of M3,AQP5 and claudin-4 on the distributions in submandibular glands after irradiation immunofluorescence × 400
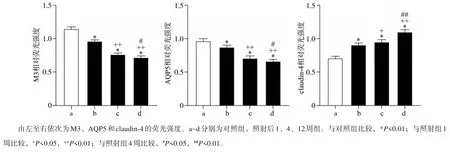
图 4 照射1、4、12周后,M3、AQP5和claudin-4的荧光强度变化Fig 4 The changes in the fluorescence intensity of M3,AQP5 and claudin-4 at 1,4 and 12 weeks after irradiation
啮齿类动物唾液腺经15 Gy以上电离辐射后在早期表现为分泌功能快速降低,在中后期腺泡细胞数目逐渐减少,在3月后进入比较稳定的缓慢恢复期。3 月内对辐射损伤的下颌下腺、腮腺等局部或全身用药干预均可显著改善腺体分泌功能[9]。在本实验中,电离辐射损伤后早期表现为组织水肿,而12 周进入损伤后期表现为核固缩、炎性细胞浸润、病理性小灶坏死、腺泡细胞数量明显降低[11]。通过下颌下腺插管,收集静息状态下单纯下颌下腺唾液分泌量,计量显示1、4 周唾液分泌量分别为(1.51±0.05)、(1.46±0.04)mm,较正常组显著降低了28%、30%,12周时分泌降低达到43%,功能损伤进一步加重,与组织学变化相一致。
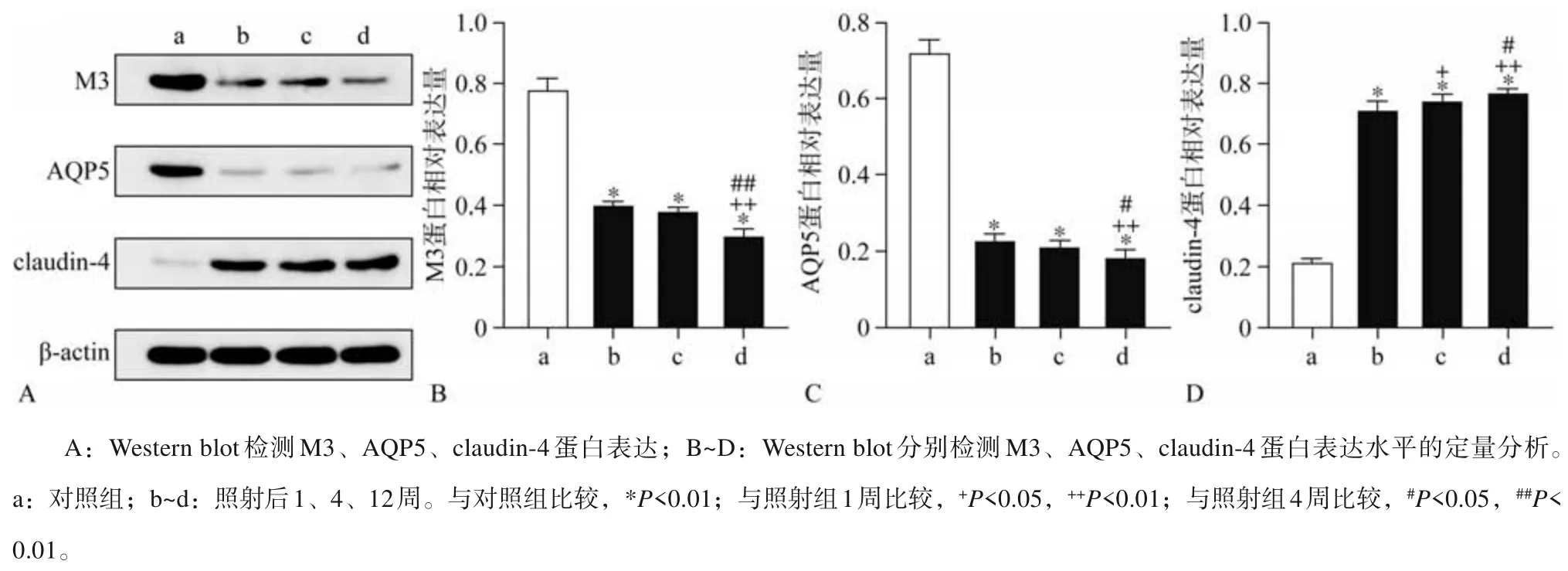
图 5 下颌下腺电离辐射后M3、AQP5、claudin-4的表达Fig 5 The expressions of M3,AQP5 and claudin-4 in submandibular glands after irradiation
唾液中水分约占99%,在正常腺体中主要由M3 受体参与调控完成。唾液腺水分泌有2 条主要的途径,即经水通道蛋白直接穿过基底膜和顶膜的跨细胞途径和经细胞间TJ调控的旁细胞途径[12]。下颌下腺中M 受体是介导跨细胞及旁细胞途径水分泌调控的重要信使,激活后可引起大鼠腮腺中AQP5 从细胞浆向顶膜的转位,同时增加唾液的分泌。在放射性损伤的唾液腺以及舍格伦综合征患者活检的唇腺标本中均可检测到AQP5的表达量降低和在腺泡顶侧膜的分布降低,提示AQP5的分布和含量是决定水的跨细胞转运的重要因素[3,13]。M3受体与AQP5 在对照腺体中含量更丰富,20 Gy 照射后随着时间的推移在7 d 观察到两者蛋白表达明显下降,第12 周时仍处于低水平。用免疫荧光显微镜观察,则表现为荧光强度减弱,AQP5 在顶膜和侧膜分布明显减少。因此,两者蛋白的表达减少以及组织结构损伤可能是照射后唾液流量减少的原因之一。此外,近年来的研究[14]提示促分泌药物如卡巴胆碱、肾上腺素等可以促进TJ 的通透性,增加水经旁细胞途径的转运,进而发挥促分泌的作用。如放射损伤前后给予M 受体激动剂匹鲁卡品可以一定程度抑制电离辐射损伤腺体的分泌低下,改善分泌功能[15]。这提示放疗可能会直接损伤TJ 结构,引起旁细胞分泌功能的降低。为此该实验通过透射电镜对放射后下颌下腺超微结构进一步观察,发现在对照组相邻腺泡上皮细胞间靠近腺泡腔的位置可观察到完整、清晰的细胞间TJ 结构,它是介导水和电解质经旁细胞途径转运的大分子蛋白复合物,主要行使“屏障”和“栅栏”功能[12,16]。电离辐射后1 周,TJ 结构表现为模糊、崩塌;4 周可见电子密度降低;12 周TJ结构破坏最明显,TJ 宽度较1、4 周均明显降低(P<0.01)。TJ 宽度是一项可以反映其“屏障”功能的重要指标,是指相邻细胞的TJ之间的距离[17]。该结果说明电离辐射造成TJ 结构损伤,导致开放程度改变引起旁细胞途径水转运能力改变。TJ 蛋白复合物主要由跨膜蛋白和胞浆蛋白构成,跨膜蛋白通过胞外环相互作用封闭细胞旁间隙,clau‐dins作为跨膜蛋白的主要封闭蛋白,在维持上皮细胞“屏障”、保持TJ 完整性上发挥重要作用[18]。claudin-4 作为claudins 家族成员之一,主要分布、表达于大鼠下颌下腺细胞膜上,经激活M3受体调控claudin-4 的表达可增加旁细胞途径的通透性[2]。在啮齿动物唾液腺中claudin-4 仅在导管细胞中表达[19],其表达量的变化会影响TJ 的屏障特性,当其表达增加会引起下颌下腺腺泡细胞的跨上皮电阻升高,降低细胞的通透性[20]。在本研究中,辐照后TJ 蛋白分子claudin-4 表达水平呈时间依赖性增加,引起了不可逆的分泌功能障碍。通常正常大鼠claudin-4 的表达水平很低,claudin-4 特异性定位于导管,腺泡几乎无表达,而导管组织占腺体体积的10%以下,其整个腺体表达水平在免疫印迹分析中显得微弱。该研究中claudin-4 在照射后1 周和4 周被清楚地检测到明显增加,12周时仍处于高表达水平。在电离辐射后claudin-4 无论是蛋白表达量还是在腺泡以及导管上皮分布的荧光强度,均表现为上升趋势,提示claudin-4 发生了重分布,会引起下颌下腺腺泡细胞的跨上皮电阻增加,降低细胞的通透性。电离辐射后TJ 结构损伤,可能是辐射损伤唾液分泌降低的重要机制,有待进一步研究。
综上所述,大鼠下颌下腺经电离辐射后腺泡细胞数目减少,AQP5跨膜转运通路受损,TJ宽度发生变化,而claudin-4表达增高,这提示M3受体介导的旁细胞水分泌途径改变也参与了电离辐射对下颌下腺分泌减少。这些发现丰富了对唾液腺放射损伤机制的认识,并可能为放疗损伤后下颌下腺分泌功能减退的治疗策略提供新的见解。
利益冲突声明:作者声明本文无利益冲突。
