低能量激光照射对脂多糖介导人牙周膜成纤维细胞炎性损伤的保护作用
2021-06-10靳晓兰张亚男孙成蕊邹朝晖
靳晓兰 张亚男 孙成蕊 邹朝晖
1.天津市津南医院口腔科,天津300350;2.天津中医药大学第一附属医院口腔科,天津300192;3.天津医科大学口腔医院牙体牙髓科三室,天津300070
牙周炎为慢性破坏性疾病,长期慢性炎性因子浸润导致牙周膜细胞的损伤和凋亡,使得牙周胶原纤维破坏,严重的炎症反应会造成不可逆的牙周损伤导致牙龈萎缩甚至是牙龈坏死。研究[1-2]显示人牙周膜成纤维细胞(human periodontal liga‐ment fibroblasts,hPDLFs)在牙周炎受损、牙周组织功能维持和修复中发挥着极其重要的作用,有效阻断牙周炎过程中hPDLFs 的损伤对促进牙周组织修复有着重要意义。低能量激光照射(low-lev‐el laser irradiation,LLLI)指的是输出功率在500 mW内,能量密度范围0.04~50 J·cm-2,波长范围600~1 100 nm的近红外或红色光激光[3]。LLLI是近年来临床上常用的理疗方法,其在治疗神经性和糖尿病溃疡疾病方面以及促进骨组织和软组织的愈合方面均有较好的作用,其在治疗牙周疾病及牙周炎方面亦有显著疗效[4-6]。目前有报道[7]显示LLLT可能通过调节腺苷-3’,5’-环化一磷酸(cyclic ade‐nosine monophosphate, cAMP) /核 转 录 因 子 -κB(nuclear transcription factor kappa B,NF-κB)抑制脂多糖(lipopolysaccharide,LPS)诱导的人牙周膜细胞炎症反应,但是关于LLLI 对hPDLFs 炎性损伤的影响和作用有待进一步研究,本研究拟探讨LLLI对LPS介导hPDLFs炎性损伤的影响及机制。
1 材料和方法
1.1 材料和仪器
hPDLFs(上海中乔新舟生物科技有限公司,货号:2630)。HRP 标记的山羊抗兔多克隆抗体、HRP 标记的山羊抗兔多克隆抗体、大肠埃希菌(Escherichia coli,E.coli) LPS、基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-3、MMP-9、磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)单克隆抗体(Sigma公司,美国),白细胞介素(interleukin,IL)-8酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒、IL-6 ELISA试剂盒、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α) ELISA 试剂盒、IL-1β ELISA 试剂盒(杭州联科生物技术股份有限公司),Trizol试剂盒、CCK8细胞增殖检测试剂盒、Hoechst 染色试剂盒、Western blot 试剂盒(上海碧云天生物技术有限公司),相关引物合成(北京赛百胜生物技术公司),DMEM 低糖培养基、胎牛血清(fetal bovine serum,FBS)(Gibco公司,美国),CO2培养箱 (Thermo Scientific Forma 公司,美国),酶标仪(Bio-Rad公司,美国),Fluo-8/AM(Invitrogen 公司,美国),Insight-PlusIQ 型激光共聚焦显微镜(Meridian 公司,美国),荧光相差显微镜(北京荣兴光恒科技有限公司)。
1.2 方法
1.2.1 hPDLFs 的培养 hPDLFs 复苏后以 10% FBS的低糖DMEM 培养基在37 ℃、5% CO2饱和湿度的细胞培养箱中培养。每隔1 d 换液,于荧光相差显微镜下观察细胞形态及生长状况,待细胞处于对数生长期时用于后续实验。
1.2.2 分组 将hPDLFs接种于5个不同培养板内培养,随机分为正常组、LPS 组、LPS+LLLI 组。正常组细胞行常规培养基培养,LPS 组和LPS+LLLI组在加入含1 mg·L-1浓度的LPS 培养基中培养24 h后,LPS 组继续常规培养及换液,LPS+LLLI 组3 个亚组在常规培养及换液的基础上分别接受2、4、6 J·cm-2的 LLLI。采 用 输出 功 率 为 100 mW~12 W 半导体激光器,波长为980 nm。功率密度设置为141.5 mW·cm-2,第1 次激光照射,记为第0天,并于第0~3 天连续照射4 d,4 d 后行后继检测。照射时间(s)=能量密度(J·cm-2)/功率密度(W·cm-2)。2 J·cm-2组照射时间为 14.13 s,4 J·cm-2组照 射时 间为 28.27 s,6 J·cm-2组 照射 时间 为42.40 s。
1.2.3 CCK-8 测定细胞活力值 LLLI 处理后,将5组细胞取出以测定每个组hPDLFs 的细胞增殖活力。使用PBS 清洗hPDLFs 2 次后,采用完全培养液重悬细胞,以密度为每孔1×104个接种于96 孔板。随后向其中加10 μL CCK8试剂,37 ℃下孵育2 h,酶标仪上测定450 nm 波长下的光密度(opti‐caldensity,OD)值,细胞存活率=(OD实验组/OD对照组)×100%。
1.2.4 细胞内游离Ca2+浓度的测定 LLLI 处理后,将 5 组 hPDLFs 经 PBS 冲洗 2 次,于 37 ℃条件下用终浓度为 10 μmol·L-1Fluo-8/AM 培养箱中孵育细胞45 min,无钙PSS 溶液清洗2 遍,将盖玻片倒置密封小室上,并向小室中加入500 μL 生理盐液,经过488 nm 的氢激光激发产生荧光,通过Insight-PlusIQ 型激光共聚焦显微镜对荧光强度行测定。细胞内 Ca2+浓度=Kd[(F-Fmin)/(Fmax-F)],式中Kd为400 nmol·L-1;F为所测到的相对荧光值;Fmax为加入10 μmol·L-1的高钙液后所得最大荧光值;Fmin为加入 10 μmol·L-1无钙液后所得最小荧光值。
1.2.5 Hoechst染色检测细胞凋亡率 LLLI处理后,将5组hPDLFs经PBS洗2次,经4%多聚甲醛固定15 min,PBS 漂洗后,每孔加入0.5 mL 的Hoechst染色液,于温箱中37 ℃下孵育30 min,PBS 洗去染料后,于倒置荧光显微镜下观察,拍照,随机取5个视野,正常细胞核染成均匀蓝色,凋亡细胞胞核碎裂浓缩,呈现明亮蓝色,计算细胞凋亡率。
1.2.6 ELISA 测定细胞上清液炎性因子 LLLI处理后,采用ELISA 法按说明书测定每个实验组hP‐DLFs 细胞上清液中 TNF-α、IL-8、IL-1β 和 IL-6 炎性因子含量,经离心取各组细胞上清液为样品进行分析,按相应的试剂盒说明书进行上清液中细胞因子的含量测定,利用酶标仪PR-521 读取各样品细胞OD 值,按照标准品浓度及对应的OD 值建立标准曲线确定 TNF-α、IL-8、IL-1β 和 IL-6 炎性因子含量。
1.2.7 MMP-2、MMP-3、MMP-9 基因表达 LLLI处理后,采用逆转录聚合酶链反应(reverse tran‐scription-polymerase chain reaction,RT-PCR) 测定5 个实验组 hPDLFs 中 MMP-2、MMP-3、MMP-9基因的表达水平。加入TRIzol 试剂对各组细胞进行裂解后,提取hPDLFs的总RNA。依据逆转录说明书行相应cDNA合成并进行扩增。扩增条件均为95 ℃预变性 1 min,95 ℃变性 30 s,59 ℃退火30 s,59 ℃延伸30 s,共40 个循环。MMP-2 上游引物序列:5’-TGACTTTCTTGGATCGGGTCG-3’,下游引物序列:5’-AAGCACCACAGATGACTG-3’;MMP-3 上游引物序列:5’-AGTCTTCCAATCCTACTGTTGCT-3’,下游引物序列:5’-TCCCCGT‐CACCTCCAATCC-3’;MMP-9 上游引物序列:5’-TGTACCGCTATGGTTACACTCG-3’,下游引物序列:5’-GGCAGGG ACAGTTGCTTCT-3’;内参GAPDH 上游引物序列:5’-TGTGGGCATCAATGGATTTGG-3’,下游引物序列:5’-ACACCATGTATTCCGGGTCAAT-3’。目的基因灰度值与GAP‐DH 灰度值的比值为MMP-2、MMP-3、MMP-9 mRNA的表达水平。
1.2.8 MMP-2、MMP-3、MMP-9 蛋白表达 LLLI处理后,通过Western blot 测定5 个实验组hPDLFs中MMP-2、MMP-3、MMP-9 蛋白的相对表达水平。提取并定量测定hPDLFs 总蛋白,将变性后的蛋白进行电泳,电泳槽内加入足量电泳液,40 V条件下电泳4~5 h,电泳后对其进行转膜,转膜时长40 min,转膜后用TBST 缓冲液反复冲洗,置于4 ℃条件下封闭12 h,向其中加入MMP-2、MMP-3、MMP-9 一抗(1∶1 000),加入一抗后进行振荡使其充分接触,振荡时间为1 h,1 h后用上述同样的冲洗方法冲洗后;加入HRP 标记的二抗(1︰1 500)后再次进行振荡使其充分接触,振荡1 h并再次冲洗3 次,最后用DAB 显色法显影,拍摄X射线胶片,用Image J 图像分析软件对各组条带行灰度值分析,以GAPDH 作为内参。目的蛋白与内参灰度比值为MMP-2、MMP-3、MMP-9蛋白表达相对表达水平。
1.3 统计学分析
采用SPSS 20.0 统计软件对实验结果进行分析,数据以均数±标准差表示,实验数据用K-S 检验符合正态分布,多组均数间的比较采用方差分析,两两比较应用最小显著差法(LSD 法)进行处理,P<0.05时表示差异有统计学意义。
2 结果
2.1 hPDLFs细胞培养
在细胞接种后24 h,显微镜下观察可见大部分hPDLFs 贴壁,细胞呈长梭形或多角形,胞体较为丰满,胞质均匀,细胞两端有较细长的突起,3 d换液一次,按1∶2 传代,经过几次传代,处于对数生长期的hPDLFs 生长较为旺盛,免疫荧光显微镜下hPDLFs 绿色荧光鉴定波形丝蛋白阳性,为中胚层来源的成纤维细胞(图1左)。相差显微镜下观察其排列形状多为栅栏状、漩涡状或放射状(图1右)。
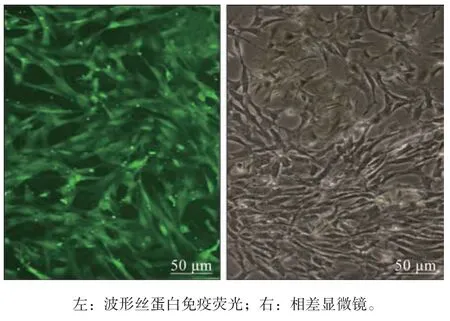
图 1 hPDLFs的鉴定 ×200Fig 1 Identification of hPDLFs ×200
2.2 细胞存活率及细胞内Ca2+浓度
与正常组比较,LPS 组hPDLFs 细胞内游离Ca2+浓度增加,细胞活力降低(P<0.05)。与LPS组比较,LPS+LLLI 组细胞内游离Ca2+浓度降低,细胞活力升高(P<0.05)。结果表明,LLLI 对LPS诱导hPDLFs 炎性损伤有保护作用,降低细胞内游离Ca2+浓度,照射强度为4 J·cm-2时效果最明显(表1)。
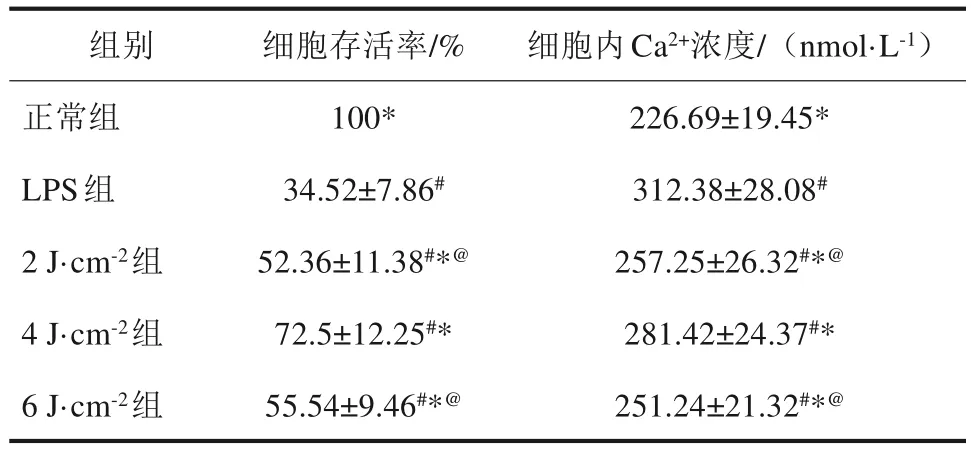
表 1 细胞存活率及细胞内Ca2+浓度Tab 1 Cell survival rate and intracellular calcium ion concentration
2.3 Hoechst染色凋亡率检测
与正常组凋亡率(7.8%±2.6%)相比较,LPS组hPDLFs 细胞凋亡率(46.2%±6.4%)显著增加(P<0.05);与LPS 组相比较,LPS+LLLI 各亚组细胞凋亡率(2、4、6 J·cm-2组细胞凋亡率分别为39.7%±4.8%、 23.1%±3.1%、 31.8%±5.7%) 降 低(P<0.05)。结果表明,LLLI对LPS诱导hPDLFs炎性损伤有保护作用,减少细胞凋亡,照射强度为4 J·cm-2时效果最明显(P<0.05)(图2)。
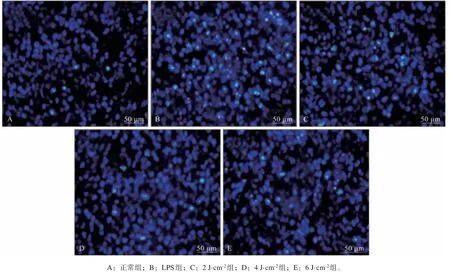
图 2 Hoechst染色检测hPDLFs细胞凋亡率 荧光显微镜 ×200Fig 2 Detection of apoptosis rate of hPDLFs by Hoechst staining fluorescence microscope ×200
2.4 细胞上清液中炎性因子含量
采用ELISA 法测定各组细胞上清液炎性因子含量,与正常组比较,LPS 组细胞上清液中TNF-α、IL-8、IL-1β 及IL-6 的含量显著升高 (P<0.05);与LPS 组相比较,LPS+LLLI 各亚组细胞上清液中TNF-α、IL-8、IL-1β 及 IL-6 的含量显著降低 (P<0.05),结果表明,LLLI 能够降低hPDLFs 炎性损伤后细胞上清液中的炎性因子,照射强度为4 J·cm-2时效果最明显(表2)。
2.5 MMP-2、MMP-3、MMP-9基因表达水平
与正常组比较,LPS 组hPDLFs 的MMP-2、MMP-3、MMP-9 基因的表达显著升高(P<0.05)。与 LPS 组相比较,LPS+LLLI 各亚组 hPDLFs 的MMP-2、MMP-3、MMP-9 基因的表达显著降低(P<0.05)。结果表明,LLLI能够降低hPDLFs炎性损伤后细胞MMP-2、MMP-3、MMP-9基因的表达水平,照射强度为4 J·cm-2时效果最明显(P<0.05)(图3)。
表 2 细胞上清液中炎性因子含量Tab 2 The content of inflammatory factors in cell su‐pernatant μg·L-1,
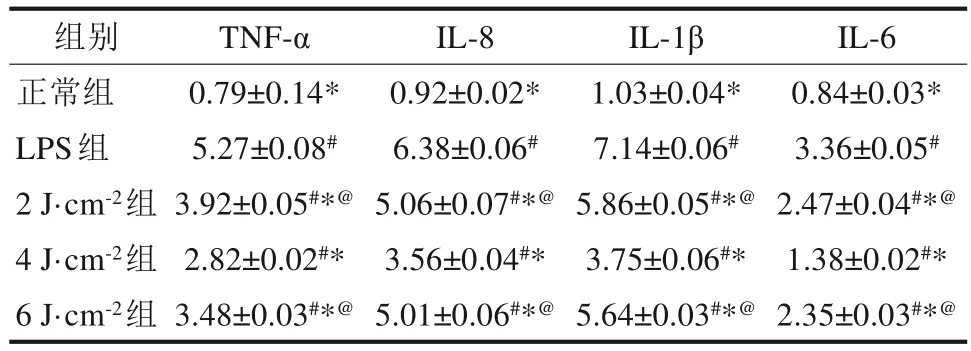
表 2 细胞上清液中炎性因子含量Tab 2 The content of inflammatory factors in cell su‐pernatant μg·L-1,
注:与正常组相比,#P<0.05;与LPS 组相比,*P<0.05;与4 J·cm-2组相比,@P<0.05。
IL-6 0.84±0.03*3.36±0.05#2.47±0.04#*@1.38±0.02#*2.35±0.03#*@组别正常组LPS组2 J·cm-2组4 J·cm-2组6 J·cm-2组TNF-α 0.79±0.14*5.27±0.08#3.92±0.05#*@2.82±0.02#*3.48±0.03#*@IL-8 0.92±0.02*6.38±0.06#5.06±0.07#*@3.56±0.04#*5.01±0.06#*@IL-1β 1.03±0.04*7.14±0.06#5.86±0.05#*@3.75±0.06#*5.64±0.03#*@
2.6 MMP-2、MMP-3、MMP-9蛋白表达水平
与正常组比较,LPS 组hPDLFs 的MMP-2、MMP-3、MMP-9 蛋白的表达显著升高 (P<0.05)。与 LPS 组 相 比 较,LPS+LLLI 各亚 组 hPDLFs 的MMP-2、MMP-3、MMP-9蛋白的表达显著降低(P<0.05)。结果表明,LLLI能够降低hPDLFs炎性损伤后细胞MMP-2、MMP-3、MMP-9 蛋白的表达,照射强度为4 J·cm-2时效果最明显(P<0.05)(图4)。
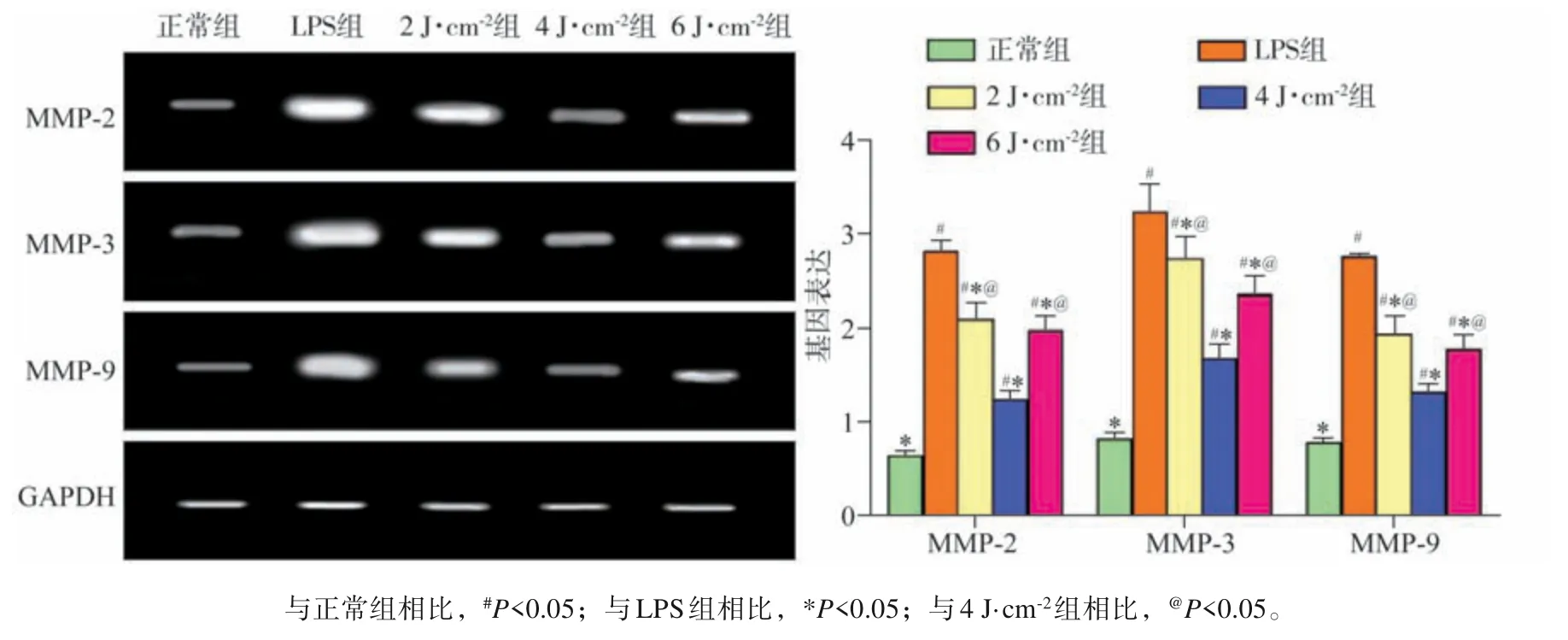
图 3 MMP-2、MMP-3、MMP-9基因表达Fig 3 MMP-2, MMP-3, MMP-9 gene expression
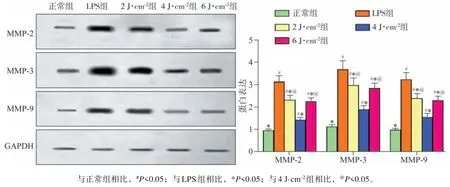
图 4 MMP-2、MMP-3、MMP-9蛋白表达Fig 4 MMP-2, MMP-3, MMP-9 protein expression
3 讨论
慢性牙周炎是最常见的牙周病,其中牙周膜成纤维细胞(periodontal ligament fibroblasts,PDLFs)在牙周炎时损伤凋亡是该病理过程的重要重要环节,本研究使用LPS 刺激hPDLFs 可以模拟牙周炎症反应过程,LPS 选择1 mg·L-1的浓度,参考国内外参考文献,和早前的预实验发现该浓度正合适能够引起中度的hPDLFs 炎性损伤,为后继研究提供炎性损伤模型,虽然加大LPS 浓度,能够显著抑制hPDLFs 的存活,但是考虑临床过程中慢性牙周炎是轻中度的长期炎性刺激,故1 mg·L-1的浓度既能导致细胞炎症,也没有造成细胞大量死亡,是一个合理的诱导剂量,但该浓度仍较参考文献浓度低,考虑与本研究hPDLFs 实验前液氮存储冻存复苏后进行LPS 诱导有关,冻存复苏对细胞的状态有影响所致,hPDLFs 细胞对LPS 诱导损伤敏感性升高[7-9]。结果显示LPS 诱导能够显著上调hP‐DLFs 细胞上清液中 TNF-α、IL-8、IL-1β 及 IL-6 的含量,hPDLFs 细胞增殖率降低,凋亡增加,细胞内游离Ca2+浓度增加,表明该牙周炎体外细胞模型成功。在此过程中 TNF-α、IL-8、IL-1β 和 IL-6 等炎性因子浸润导致牙周组织细胞内钙超载,最终导致细胞外基质中MMP-2、MMP-3、MMP-9的高表达,MMPs是一类含Zn2+的中性蛋白水解酶,能降解细胞外基质(extracellular matrix,ECM),MMPs高表达在牙周炎牙周组织破坏中起着尤为重要的作用[10-12],本研究LPS 介导炎性损伤后,hP‐DLFs 细胞 MMP-2、MMP-3、MMP-9 基因和蛋白表达显著升高印证了这一点。
本研究结果显示经LLLI 处理后,LPS 介导的hPDLFs 增殖活性上升且细胞凋亡率下降,细胞内游离Ca2+浓度亦显著降低;据此可知,LLLI 可以显著缓解LPS 引起的hPDLFs 炎性损伤。进一步采用ELISA 法测定,与LPS 组比较,LPS+LLLI 组细胞上清液中 TNF-α、IL-8、IL-1β 及 IL-6 的含量显著降低,表明LLLI 对LPS 诱导hPDLFs 炎性损伤有保护作用,LLLI 能够降低hPDLFs 炎性损伤后细胞上清液中的炎性因子,照射强度为4 J·cm-2时效果最明显。有研究[12-14]表明,牙周炎患者龈沟液中MMP-2、MMP-3 和MMP-9 的活性增高。此外,随着牙龈炎症程度的增加,MMP 活性和表达也增加,因此,MMP 途径可能是牙周组织破坏的关键途径,降低其表达意义重大。本研究中LLLI 对LPS 诱导hPDLFs 炎性损伤后细胞MMP-2、MMP-3 和MMP-9 的表达检测显示,与LPS 组相比,LPS+LLLI 各亚组 MMP-2、MMP-3 和 MMP-9 显著降低,照射强度为4 J·cm-2时效果最明显,起到了阻断MMP途径的作用。
综上所述,经过LLLI 处理后可显著改善LPS诱导的hPDLFs 炎性损伤。推测LLLI 可能是通过降低细胞上清液中 TNF-α、IL-8、IL-1β 和 IL-6 的含量进而降低hPDLFs 炎性损伤后细胞MMP-2、MMP-3和MMP-9的表达水平来发挥抗炎作用,本研究结果可为临床上采用LLLI 治疗牙周炎提供理论依据和借鉴。
利益冲突声明:作者声明本文无利益冲突。
