健脾益肾举陷汤联合西医常规治疗Ⅱ型重症肌无力的临床研究※
2021-06-10魏东生罗利俊陈晓光
魏东生 罗利俊 杨 洁 丁 君 陈晓光
(湖北省武汉市第一医院神经内科,湖北 武汉 430021)
重症肌无力(myasthenia gravis,MG)是一种由乙酰胆碱受体(AChR)抗体介导,细胞免疫依赖,补体参与,累及神经肌肉接头突触后膜而引起神经肌肉接头传递障碍,出现骨骼肌收缩无力的自身免疫性疾病[1]。目前,西医对于MG已有较为详尽的认识,并根据患者的临床表现可分为Ⅰ型(眼肌型)、Ⅱ型(全身型,又可分为ⅡA轻度全身型和ⅡB中度全身型)、Ⅲ型(重度激进型)、Ⅳ型(迟发重度型)及Ⅴ型(肌萎缩型)[2],治疗则主要依据临床分型采用不同的治疗手段,包括对症治疗、免疫抑制治疗、血浆置换及胸腺切除手术治疗等,但一般疗程较长,长期应用糖皮质激素类免疫抑制剂不良反应明显[3]。2018-01—2019-03,我们在西医常规治疗基础上联合健脾益肾举陷汤治疗Ⅱ型MG 30例,并与单纯西医常规治疗30例对照观察,结果如下。
1 资料与方法
1.1 一般资料 全部60例均为湖北省武汉市第一医院神经内科门诊(18例)及住院(42例)Ⅱ型MG患者,按照随机数字表法分为2组。治疗组30例,男8例,女22例;年龄33~72岁,平均(36.57±3.45)岁;病程3~14年,平均(5.25±2.32)年;ⅡA型19例,ⅡB型11例。对照组30例,男6例,女24例;年龄35~77岁,平均(37.18±3.17)岁;病程3~15年,平均(5.45±2.65)年;ⅡA型17例,ⅡB型13例。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 病例选择
1.2.1 诊断标准 参照《中国重症肌无力诊断和治疗指南2015》中MG的诊断标准[2]。
1.2.2 纳入标准 符合上述诊断标准;临床分型为Ⅱ型的患者;参加研究前停药3个月以上,或未经治疗者;依从性好,能够坚持完成治疗;患者自愿参加本研究,签署知情同意书,经过医院医学伦理委员会批准。
1.2.3 排除标准 接受研究前已经使用免疫抑制剂或胆碱酯酶抑制剂治疗3年以上者;临床分型为Ⅰ、Ⅲ、Ⅳ、Ⅴ型或合并全身炎症感染者;合并有心、脑、肝、肾等严重原发性疾病及精神病者;曾行胸腺切除术、血浆置换治疗者;妊娠期及哺乳期妇女。
1.3 治疗方法
1.3.1 对照组 予西医常规治疗。溴吡斯的明片(上海医药集团股份有限公司,国药准字H31020867)60 mg,每日3次口服;醋酸泼尼松片(天津天药药业股份有限公司,国药准字H12020689)小剂量递增法给药,从每日20 mg清晨顿服开始,每3 d增加5 mg,直至足量60~80 mg。若采用上述治疗后效果仍不佳者加用硫唑嘌呤片(上海上药信谊药厂有限公司,国药准字H31021422)50 mg,每日1次口服,7 d后每日2次口服。
1.3.2 治疗组 在对照组的基础上联合健脾益肾举陷汤治疗。药物组成:党参15 g,白术10 g,黄芪30 g,升麻6 g,柴胡6 g,当归15 g,甘草6 g,陈皮10 g,杜仲15 g,菟丝子15 g,枸杞子15 g,鹿角胶9 g,熟地黄15 g,川牛膝15 g。若合并风热型上呼吸道感染者加金银花15 g、连翘15 g、薄荷6 g;合并风寒型上呼吸道感染者加荆芥10 g、防风10 g;合并胸腺瘤者加三棱10 g、莪术10 g、瓜蒌皮15 g、枳壳15 g;痰湿重者加茯苓15 g、法半夏10 g;多汗自汗者加煅龙骨30 g、煅牡蛎30 g、浮小麦30 g、山茱萸30 g;失眠多梦者加酸枣仁30 g、茯神15 g、合欢皮15 g、首乌藤15 g。日1剂,水煎取汁300 mL,分早、中、晚3次温服。
1.3.3 疗程 2组均治疗6个月后统计疗效。
1.4 观察指标及方法 观察2组患者治疗前后临床症状及生活质量变化情况。临床症状采用MG定量评分表(QMGS)[4]进行评价,共包括13项内容,最高分为39分,评分越高说明症状越明显。生活质量采用MG日常生活量表(MG-ADL)[5]进行评价,包括8项内容,最高分为24分,评分越高提示生活质量越差。比较2组治疗期间激素相关不良反应消化道症状、呼吸系统感染、多汗、失眠、血压升高、血糖升高及体质量增加>5 kg发生情况。
1.5 疗效标准 根据患者QMGS评分变化情况评价疗效[4]。临床痊愈:QMGS评分减少≥95%;基本痊愈:QMGS评分减少≥80%,<95%;显效:QMGS评分减少≥50%,<80%;有效:QMGS评分减少≥25%,<50%;无效:QMGS评分减少<25%。总有效率=(临床痊愈例数+基本痊愈例数+显效例数)/总例数×100%。

2 结果
2.1 2组疗效比较 见表1。
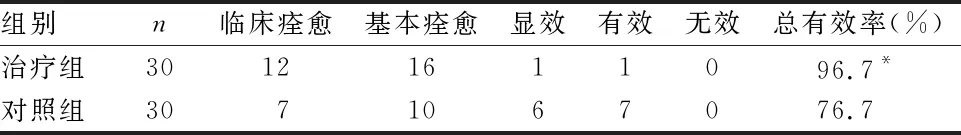
表1 2组疗效比较 例
由表1可见,2组总有效率比较差异有统计学意义(P<0.05)。治疗组疗效优于对照组。
2.2 2组治疗前后QMGS评分及MG-ADL评分变化比较 见表2。

表2 2组治疗前后QMGS评分及MG-ADL评分变化比较 分,
由表2可见,2组治疗后QMGS评分及MG-ADL评分与本组治疗前比较差异均有统计学意义(P<0.05),均降低。治疗组治疗后QMGS评分及MG-ADL评分与对照组治疗后比较差异均有统计学意义(P<0.05),治疗组均低于对照组。
2.3 2组治疗期间激素相关不良反应发生情况比较 见表3。

表3 2组治疗期间激素相关不良反应发生情况比较 例(%)
由表3可见,2组治疗期间激素相关不良反应消化道症状、呼吸系统感染、多汗及失眠的发生率比较差异均有统计学意义(P<0.05),治疗组均低于对照组。
3 讨论
MG是一种神经肌肉接头传递障碍的获得性自身免疫性疾病,是环境因素和免疫遗传因素共同作用的结果,病变部位在神经肌肉接头的突触后膜,临床特征为部分或全部骨骼肌极易疲劳,通常在活动后症状加重,经休息和抗胆碱酯酶药物治疗后症状减轻[6]。现代医学研究表明,MG主要为体液免疫介导的疾病,其发病机制为在补体参与下,体内产生的AChR抗体与突触后膜的AChR产生免疫应答,导致AChR受到破坏,不能产生足够的终板电位,突触后膜传递障碍而产生肌无力,手术、过度疲劳、感染等因素造成免疫功能紊乱,均诱导MG的发生[7-8]。MG的治疗目的主要为缓解临床症状,控制病情发展,提高生活质量,QMGS评分及MG-ADL评分均是临床上评估MG治疗效果的常用量表,可对患者治疗前后的病情及生活质量变化进行准确评价[9-10]。目前,临床上对于Ⅱ型MG的常规治疗方案为胆碱酯酶抑制剂联合糖皮质激素,必要时可加用非糖皮质激素类免疫抑制剂联合治疗。溴吡斯的明是临床上常用的胆碱酯酶抑制剂,能抑制胆碱酯酶活性,减少乙酰胆碱的破坏,促进突触间隙中乙酰胆碱的积聚,进而改善MG患者的症状表现[11]。醋酸泼尼松具有抗炎及免疫抑制作用,能够降低免疫球蛋白与表面受体的结合能力,减轻变态反应,改善MG病情,但长期使用具有一定的副作用,如易合并各种感染,包括细菌、真菌、水痘带状疱疹病毒感染等,出现血压升高、血糖升高、体质量增加、向心性肥胖、内分泌功能紊乱等,应引起高度重视[12-13]。硫唑嘌呤也是临床治疗MG的常用药物,主要用于对糖皮质激素耐受的MG患者,其也具有免疫抑制作用,通过抑制嘌呤合成途径抑制淋巴细胞的增殖,阻止抗原敏感淋巴细胞转化为免疫母细胞,产生免疫抑制作用[14-15]。
MG属于中医学痿证范畴,早在《素问·痿论》就提出“治痿独取阳明”,随着后世医家对其病因病机研究的不断深入,辨治理论也不断完善,认为其病机根本乃是脾肾亏虚[16]。肾为先天之本,脾为后天之本,肾主骨生髓,肾虚则骨髓化生乏源,骨枯髓减,骨软无力;脾主肌肉、四肢,脾虚则气血生化乏源,中气不足,则上睑下垂、眼睛闭合不全,肌肉、四肢失于濡养而出现乏力。《素问·太阴阳明论》言:“脾病而四肢不用何也?岐伯曰:四肢皆禀气于胃,而不得至经,必因于脾,乃得禀也。今脾病不能为胃行其津液,四肢不得禀水谷气,气日以衰,脉道不利,筋骨肌肉,皆无气以生,故不用焉。”此外,中医学认为,糖皮质激素类药物属于大温大热之品,长期服用容易导致气阴耗伤,出现少气懒言、动则多汗、口舌干燥、腰膝痠软、头晕耳鸣、舌红少苔、脉细数无力等脾气亏虚、肾阴不足的表现[17]。因此,治疗应以健脾益肾为主。健脾益肾升陷汤为补中益气汤合左归丸加减而成,方中黄芪、党参、白术健脾益气,补中升阳,敛汗固表,对长期使用糖皮质激素多汗患者甚有益处;升麻、柴胡和解表里,升阳举陷;当归养血活血;陈皮理气和胃,使诸药补而不滞;熟地黄填精髓,益肾阴;鹿角胶、菟丝子温补肝肾,益精养血;枸杞子补肾益精,养肝明目;杜仲、川牛膝益肝肾,强腰膝,健筋骨;甘草调和诸药。诸药合用,辨证加减,共奏健脾益肾、补中益气、强筋健骨、升阳举陷的功效。现代药理学研究表明,补中益气汤可通过下调实验性自身免疫性MG(EAMG)大鼠外周血中辅助性T淋巴细胞(Th)17的水平,减少T淋巴细胞及B淋巴细胞的活化和增殖,降低血清免疫球蛋白G(IgG)及AChR抗体水平,减轻神经肌肉接头处的炎性反应,从而改善MG的肌无力症状[18];左归丸也可以抑制实验性自身免疫性脑脊髓炎(EAE)小鼠IL-17细胞分化,降低免疫炎性反应[19]。
本研究结果显示,治疗组疗效明显优于对照组(P<0.05),治疗组治疗后QMGS评分及MG-ADL评分明显低于对照组(P<0.05),治疗组治疗期间激素相关不良反应消化道症状、呼吸系统感染、多汗及失眠的发生率明显低于对照组(P<0.05)。提示健脾益肾举陷汤联合西医常规治疗Ⅱ型MG患者临床疗效确切,可明显改善患者临床症状,提高生活质量,减少激素相关不良反应的发生,值得临床借鉴参考。
