阿托伐他汀对野百合碱诱导的大鼠肺动脉高压及肺组织白细胞介素-8表达的影响
2021-06-09冯垚张洪淞李爱歆刘擎
冯垚 张洪淞 李爱歆 刘擎
(1佳木斯大学附属第一医院,黑龙江 佳木斯 154000;2佳木斯市中心医院)
肺动脉高压(PAH)是指肺血管阻力进行性增高的一类疾病,严重影响原发性心肺疾病患者的预后,最终可导致患者右心衰竭而死亡。近年来有关PAH发病机制及治疗的研究已成为国内外学术研究的热点。研究发现,血管重构(VR)和新生、血管和组织间多种炎性因子浸润所致的炎症性改变及原位血栓的形成是PAH的主要病理学改变。其中血管重构被认为是造成血管病变及循环功能紊乱的主要病理学基础〔1〕。PAH的VR首先是从构成血管内膜的内皮细胞(EC)功能障碍开始。EC可分泌多种参与调节血管收缩及舒张、纤维溶解等过程的生物活性物质,故其受损后可出现血管舒缩障碍、肺小动脉管腔缩小、平滑肌细胞增生、内膜增厚等典型的病理学改变。而PAH过程中血管新生的活跃也是EC凋亡被抑制的一种体现〔2〕。研究显示,特发性PAH(IPAH)患者的肺部血管病灶中可检测到巨噬细胞和淋巴细胞等多种炎性细胞的浸润,且患者血清中亦可检测到多种前炎性细胞因子和炎性标志物的表达上调,包括白细胞介素(IL)-1、IL-6、可溶性P选择素(sP-Sel)和可溶性细胞间黏附因子(sICAM)-1等〔3〕。可见炎症反应在PAH的发生和演进中扮演重要角色,研究PAH的炎症过程可能成为寻求有效治疗该病的新靶点。IL-8是由巨噬细胞、内皮细胞等多种细胞表达的一种重要的中性粒细胞趋化因子,其可通过诱导中性粒细胞脱颗粒而促使血管EC上调表达和分泌IL-8,IL-8进而在血管的炎性循环中发挥重要调节作用。Koch等〔4〕在硫化氢对PAH大鼠血管炎症作用的研究中发现,PAH模型组IL-8含量要明显高于对照组,这表明IL-8在PAH的炎性反应中具有一定的作用。野百合碱(MCT)可在肝脏中代谢成为吡咯MCT,后者进而经过一系列病理生理过程而使血管内皮损伤、平滑肌细胞增生和肺血管重构。由于MCT可转变为可使血管屏障功能受损的吡咯MCT,故其已被广泛应用以制备经典的PAH动物模型〔5〕。研究发现,MCT诱导的PAH大鼠肺组织中参与炎症反应细胞因子转录的核因子(NF)-κB mRNA表达升高,说明炎症反应在MCT致PAH发生和发展中起重要作用〔6〕。
目前临床上治疗PAH的药物主要包括前列腺素类、磷酸二酯酶抑制剂和内皮素受体拮抗剂等,虽然这些药物可在一定程度上治疗PAH和改善心功能,但有关各类药物的有效性和安全性还需经临床实践进一步验证。作为3-羟基3-甲基戊二酰辅酶(HMG-Co)A还原酶抑制剂,他汀类药物目前以其独立于降脂作用之外的多效性作用被广泛应用于临床,这包括其被用于改善血管内皮功能、治疗动脉硬化、抑制炎症反应、改善凝血功能和抑制平滑肌细胞增殖等。临床研究发现,辛伐他汀可加速冠状动脉手术患者中性粒细胞的凋亡,抑制炎症反应,并可改善PAH患者的右心收缩压升高、6 min步行距离试验缩短和心输出量降低〔7〕。在他汀类药物中,阿托伐他汀属第3代产品,其临床效用和抗炎作用明显强于比辛伐他汀和氟伐他汀。本研究通过MCT构建炎症性PAH大鼠模型,并应用阿托伐他汀干预来研究其对模型大鼠PAH、右心室肥大指数和血清IL-8含量的影响,初步探讨阿托伐他汀治疗PAH的作用机制。
1 材料与方法
1.1溶液及药品配制 ①0.01 mol/L枸橼酸盐缓冲溶液(pH6.0):称取3.0 g枸橼酸三钠和0.4 g枸橼酸,将二者加入1 000 ml双蒸水中,磁力搅拌使其分溶解。② 苏木素染液:称取2.5 g苏木素加入25 ml无水乙醇中,充分搅拌使其溶解;称取22 g硫酸铝钾加入到500 ml双蒸水中,加热使其充分溶解;将苏木素-乙醇溶液加入硫酸铝钾溶液中,并尽快加热至沸腾;迅速移离热源,搅拌溶液直至温度降至90℃左右;称取1.25 g一氧化汞,缓慢加入溶液中,搅拌溶液直至一氧化汞完全溶解;迅速将溶液置于冷水中静置;次日过滤后密闭储存备用。③ 12.5 mg/ml MCT溶液:将MCT加入适量的20%乙醇中,搅拌使其充分溶解;加入一定量生理盐水至MCT浓度为12.5 mg/ml。④1 mg/ml阿托伐他汀溶液:将20 mg阿托伐他汀用研磨器研碎,并加入20 ml生理盐水中充分混合溶解,制备成1 mg/ml 阿托伐他汀溶液。
1.2PAH大鼠模型的建立及动物分组 选取体重200~220 g的雄性SD大鼠24只,在恒温(21±1)℃、明暗交替(12 h/d)和相对湿度为(50±5)%条件下自由摄食水饲养。将实验动物随机分为PAH模型组、阿托伐他汀组和对照组各8只。PAH模型组和阿托伐他汀组按60 mg/kg腹部皮下一次性注射MCT溶液,对照组则注射等量的生理盐水。自腹腔注射之日起,阿托伐他汀组按10 mg/kg灌胃给予阿托伐他汀溶液,PAH模型组和对照组则灌胃给予等量的生理盐水。各组均每日灌胃1次,持续3 w。实验中共2只大鼠死亡,均属于PAH模型组,分别死于实验中的第17天和第21天,呼吸困难为大鼠死亡前的主要表现。
1.3记录各组实验动物基本情况及生存情况
1.4血流动力学检测 按孙波等〔8〕报道的方法进行操作,具体如下:将外径为1 mm、具有刻度的10 cm长右心软管预充肝素钠,并用三通管与换能器连接备用;用10%的水合氯醛按300 mg/kg对大鼠进行腹腔麻醉注射;待固定麻醉大鼠后,手术暴露剥离右侧颈外静脉和颈总静脉,并进行右心插管;将导管经换能器与数据采集分析系统连接,利用系统软件测定平均肺动脉压(MPAP)。
1.5右心室肥厚指数检测 用手术剪沿房室沟将心房和大血管根部剪掉,然后再沿后室壁间沟切下右心室;吸水纸吸取残留血液后,对右心室游离壁(RV)和左心室+室间隔(LV+S)进行称重;利用公式计算右心室肥厚指数(RVHI),RVHI= RV/(LV+S)。
1.6肺组织苏木素-伊红染色及计算肺小动脉管壁厚度占血管外径的百分比(WT%)和肺动脉管壁面积占血管总面积的百分比(WA%) 切取右肺中叶组织,进行常规甲醛固定和石蜡包埋;沿右肺门水平横向行厚度为 5 μm的切片,然后将切片行苏木素-伊红(HE)染色;在光镜下评估肺小动脉病变情况;按Barth等〔9〕报道的方法测算各组实验肺组织的肺动脉直径,将直径为50~150 μm的血管设定为目标血管;不间断地分别测算10个目标血管的血管总面积(TA)、血管腔面积(VA)、管壁厚度(WT)和血管外径(ED)。分别利用以下公式计算WT%和WA%;WT%=(2×WT/ED)×100%,WA%=(TA-VA)/TA×100%。
1.7血清中IL-8含量的检测 利用酶联免疫吸附试验(ELISA)检测大鼠血清IL-8含量。
1.8统计学方法 采用SPSS17.0软件进行t检验、Pearson相关性分析。
2 结 果
2.1大鼠一般状态与存活情况 对照组及阿托伐他汀组体毛顺滑富有光泽,行动灵活、反应敏捷,饮食正常,PAH模型组体毛暗淡少光泽,萎靡不振、反应迟钝,饮食量减少。
2.2各组血流动力学及右心室肥厚指数、WT%、WA%、IL-8含量 与对照组比较,PAH模型组和阿托伐他汀组MPAP和RVHI、WT%、WA%、IL-8含量均显著增高(均P<0.05);与PAH模型组比较,阿托伐他汀组MPAP和RVHI、WT%、WA%、IL-8含量显著降低(P<0.05),见表1。
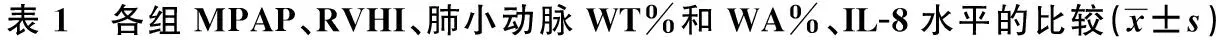
组别nMPAP(mmHg)RVHIWT%WA%IL-8(ng/ml)对照组815.11±0.7124.93±4.6520.82±4.8330.63±4.7613.65±1.13PAH模型组623.61±2.011)32.87±2.11)38.66±5.481)56.18±6.51)61.21±5.421)阿托伐他汀组820.43±1.341)2)26.65±1.71)2)21.43±4.31)2)37.08±3.81)2)29.36±4.451)2)
2.3各组肺小动脉形态学改变 对照组肺小动脉的管壁厚度均一,管腔中见有连续完整的内皮细胞,且仅有少量结缔组织见于血管周围;PAH模型组肺小动脉可见管壁增厚和管腔缩小,内皮细胞间的连续性出现断裂且不完整,有大量的结缔组织见于血管周围,且管壁可见大量炎性细胞浸润;阿托伐他汀组肺小动脉管壁厚度较均一,仅见轻度管壁增厚和管腔缩小。见图1。
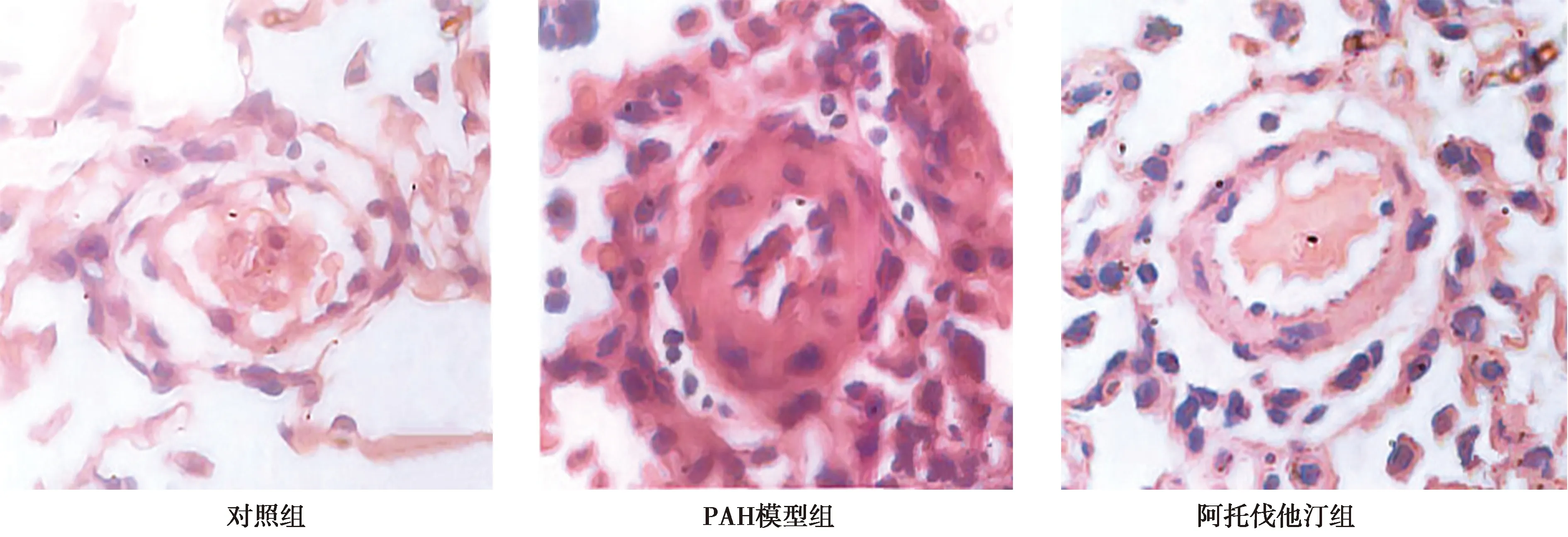
图1 各组肺小动脉形态学改变(×400)
2.4IL-8含量与MPAP、肺小动脉WT%和WA%的相关性 IL-8含量与MPAP、肺小动脉WT%和WA%呈明显正相关(r=0.82、0.87、0.64,均P<0.05)。
3 讨 论
即便PAH临床类型众多,但各类型病理生理学的最显著特点均是血管性炎症及血管重构引起的PAH的进行性恶化,进而导致右心衰竭乃至全心衰竭,甚至死亡。迄今为止,临床治疗PAH的效果不佳,且经常出现不同的不良反应。多种因素如缺血缺氧、局部微血栓的形成、血管收缩和舒张因子失衡及炎症等均可引起PAH发生复杂性血管病变。本文MCT诱导大鼠PAH模型的成功构建与先前的研究成果相符〔10〕,确认了MCT可通过作用于肺动脉系统,导致出现肺动脉EC损伤、平滑肌细胞增殖和肺间质大量炎性细胞浸润等病理学改变,引发炎症性PAH。本研究说明阿托伐他汀能在一定程度上降低肺动脉压力,这与Souza-Costa等〔11〕实验结果一致。
研究表明PAH造成肺血管新生及重建,由于血管新生可致血管阻力增大,进而加重组织缺血缺氧,而在缺血缺氧条件下,组织为了代偿又会增加血管新生,由此产生血管新生和组织缺血缺氧之间的恶性循环,进一步加重了肺动脉重构和PAH。Simonini等〔12〕研究显示,当抑制PAH大鼠的血管新生后,可减少大鼠的肺动脉重建,其PAH亦有所改善。本研究表明应用MCT可导致大鼠发生肺血管重建;而当应用阿托伐他汀干预后肺小动脉WT%和WA%显著减小,提示阿托伐他汀可抑制血管新生,改善肺血管重构。
IL-8是目前发现的对中性粒细胞趋化活性最强的细胞因子。研究证实肿瘤坏死因子(TNF)-α和IL-1β等在炎症反应中的作用很大程度上是通过诱导IL-8来介导完成的。MCT造成肺血管内皮损伤后各种因子进入血管平滑肌中层,刺激IL-8的分泌和表达〔13〕。IL-8通过刺激平滑肌细胞的迁移和增殖而导致中膜肥厚,并出现肺血管重建。PAH和缺血缺氧状态可使骨髓中的内皮祖细胞动员出来,并向损伤部位归巢〔14〕。IL-8可诱导内皮祖细胞发生迁移和增殖,促进新生血管形成〔15〕。但因为新生血管滋养管具有易碎性和渗出性,故其可加速平滑肌细胞增殖,进一步促进肺血管重建,进而使PAH病情加重和恶化。本研究提示IL-8可参与PAH进程,且在肺血管新生及重建中发挥显著作用;阿托伐他汀可通过降低IL-8的分泌,即抗炎途径对PAH起到一定治疗作用;通过降低IL-8的表达减轻血管重建、抑制血管新生可能进一步起到延缓PAH的作用,这与陈建英等〔16〕研究结果一致。
研究表明,在PAH发展早期和整个治疗过程中他汀类药物可经抗炎作用而治疗PAH〔17〕。进一步实验发现阿托伐他汀能降低脂多糖诱导的人肺上皮细胞IL-6等炎症因子分泌,表明阿托伐他汀可对人肺细胞发挥直接抗炎作用,但其机制尚不明确。本研究发现阿托伐他汀可抑制IL-8的分泌来减轻PAH,考虑可能的机制为抑制调节免疫炎症相关基因的重要转录因子NF-κB的激活和活性亚基P50的释放,使其与DNA结合能力降低,减少IL-8的产生和分泌,抑制炎症反应。Farooq等〔18〕发现他汀类可通过抑制细胞内P38丝裂素活化蛋白激酶(MAPK)通路来减轻人EC的炎症反应,而P38MAPK可介导人肺血管EC上包括IL-8、细胞间黏附分子(ICAM)-1在内的趋化因子和黏附分子的表达。他汀类可下调MCT诱导PAH大鼠模型的细胞癌基因c-fos、TNF-α等表达,从而降低对IL-8的诱导作用。
综上,阿托伐他汀能减轻MCT诱导的肺部炎症,降低MPAP和抑制右心室肥厚,可降低模型大鼠血清IL-8水平,提示其可能经下调IL-8表达来发挥抗炎和抑制血管重构功能。然而,有关阿托伐他汀治疗PAH是否存在剂量依赖性、具体通过何途径降低IL-8的表达仍需要深入研究。
