miR-15b-5p靶向CRKL基因对缺氧/复氧诱导心肌细胞凋亡和增殖的作用机制
2021-06-09黄粮吴瑞霞王岚肖杰成忠
黄粮 吴瑞霞 王岚 肖杰 成忠
(华中科技大学同济医学院附属普爱医院心血管内科,湖北 武汉 430030)
急性心肌梗死(AMI)具有较高的发病率,且已严重威胁人类生命安全,目前临床主要采用经皮冠状动脉介入及溶栓等方法治疗AMI以避免心肌缺血缺氧,但缺血心肌恢复血液供应后又可诱发心肌缺血再灌注损伤〔1〕。因此,如何有效阻止缺血再灌注所致心肌损害及减少心肌细胞凋亡成为AMI治疗过程中的首要问题。研究表明缺氧/复氧(H/R)诱导的心肌损伤、心力衰竭等疾病的重要发病机制主要为心肌细胞凋亡增加及活性降低〔2〕。探究H/R诱导心肌细胞增殖及凋亡的作用机制对改善患者心脏功能及降低死亡率均具有重要意义。微小RNA(miRNA)是一类内源性非编码小RNA分子,并可通过调控靶基因表达进而参与细胞分化及凋亡的生物学过程〔3〕。微小RNA-15b-5p(miR-15b-5p)在胃癌、肝癌等多种恶性肿瘤中均呈高表达,并可抑制肿瘤细胞增殖、促进细胞凋亡〔4〕。Liu等〔5〕研究表明,通过抑制大鼠中miR-15b-5p表达可预防大鼠脑缺血/再灌注损伤,但关于其具体作用机制尚未完全阐明。通过生物信息学软件预测出CRKL是miR-15b-5p的靶基因,张志升等〔6〕研究表明沉默CRKL可促进H/R诱导的心肌细胞凋亡并降低心肌细胞生存率,但关于其如何调控心肌细胞凋亡及增殖尚未完全清楚。本研究通过敲低miR-15b-5p表达并进行H/R干预探讨抑制miR-15b-5p表达对H/R诱导心肌细胞凋亡及增殖的影响及其对CRKL基因的调控作用,拟揭示H/R诱导的心肌损伤等发病机制,为防治AMI等心脏疾病再灌注损伤提供新思路。
1 材料与方法
1.1细胞与主要试剂 大鼠H9C2心肌细胞株购自中国科学院上海生命科学研究院细胞资源中心。重组真核质粒pcDNA3.1及空质粒均购自湖南丰晖生物科技有限公司;DMEM培养基与胎牛血清(FBS)均购自美国Gibco公司;miR-15b-5p mimic及阴性转染质粒、miR-15b-5p抑制剂(anti-miR-15b-5p)、anti-miR-NC及转染试剂盒均购自美国Invitrogen公司;CRKL siRNA(si-CRKL)与阴性对照siRNA(si-NC)均购自美国CST公司;Trizol、反转录及实时荧光定量PCR试剂盒均购自日本TakaRa公司;小鼠抗人CRKL抗体购自美国Cell Signaling公司;细胞凋亡试剂盒购自江苏碧云天生物研究所;MTT检测试剂盒购自美国Sigma公司;野生型及突变型CRKL基因3′UTR荧光素酶表达载体均购自百奥迈科生物技术有限公司;双荧光素酶报告基因检测试剂盒购自上海艾跃生物科技有限公司。
1.2细胞转染及分组 大鼠H9C2心肌细胞培养于含有10% FBS的DMEM培养基,放入37℃、5%CO2培养箱培养,待细胞生长密度至60%时更换为不含FBS的DMEM培养基,分别将miR-15b-5p抑制剂(anti-miR-15b-5p)、anti-miR-NC瞬时转染至H9C2心肌细胞,将H9C2心肌细胞分为Con组(不进行任何处理的心肌细胞)、anti-miR-15b-5p组、anti-miR-NC组。分别将pcDNA-CRKL转染至H9C2心肌细胞,将H9C2心肌细胞分为pcDNA组、pcDNA-CRKL组。后续研究中将anti-miR-NC及anti-miR-15b-5p转染至H9C2细胞以此验证miR-15b-5p是否靶向调控CRKL表达。分别将si-NC、si-CRKL与anti-15b-5p共转染至H9C2细胞,将H9C2细胞分为anti-15b-5p+si-NC组、anti-15b-5p+si-CRKL组。转染后继续培养8 h,将培养基更换为完全培养基,每组细胞均备2份,一份细胞继续培养48 h后收集各组H9C2心肌细胞用于后续实验。
1.3构建H/R心肌细胞模型 制备缺氧培养基:采用不含FBS的DMEM培养液,其与氮气及CO2充分饱和,时间超过3 h。制备复氧培养基:取含FBS的DMEM培养液,置于室温常氧培养箱,时间超过3 h。取出另一份转染24 h后及未经任何处理的H9C2心肌细胞,加入缺氧培养基并置于低氧培养箱培养(缺氧模型),24 h后取出培养瓶,胰酶消化细胞,1 000 r/min离心5 min,吸取上清,加入复氧培养基,放入常氧培养箱培养细胞(复氧模型),培养1 h后检测细胞凋亡〔7〕。
1.4qRT-PCR检测H9C2心肌细胞中miR-15b-5p及CRKL mRNA表达 利用Trizol试剂提取H9C2心肌细胞RNA,将2 μg RNA反转录为cDNA,参照qRT-PCR试剂盒说明书配置体系,置于实时荧光定量PCR仪检测miR-15b-5p及CRKL mRNA相对表达量,PCR扩增条件为95℃ 5 min循环1次,95℃变性30 s,60℃退火30 s,72℃延伸30 s,重复40次。miR-15b-5p以U6为内参基因,CRKL以GAPDH为内参基因,2-ΔΔCt法计算miR-15b-5p及CRKL mRNA相对表达量。
1.5Western印迹检测H9C2心肌细胞中CRKL蛋白表达 分别取各组H9C2心肌细胞置于EP试管中,分别加入蛋白裂解液经离心后提取细胞总蛋白,测定蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,使用半干法将蛋白凝胶转移至聚偏二氟乙烯(PVDF)膜,封膜2 h,TBST洗膜,加入CRKL抗体过夜(4℃),加入二抗,室温孵育2 h,电化学发光(ECL)显色,利用X线胶片显影定影,并采用Imageproplus6.0图像分析软件分析蛋白条带灰度。
1.6流式细胞术检测H9C2心肌细胞凋亡 应用膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)细胞凋亡试剂盒检测细胞凋亡,收集各组对数生长期H9C2心肌细胞接种于6孔细胞培养板(密度1×108/L),0.25%胰酶消化细胞,细胞呈圆形时加入DMEM培养基(含有10%FBS)终止消化,置于离心机离心,弃上清,重悬细胞,分别加入10 ml Annexin V 后室温下孵育,15 min后使用200目滤网过滤细胞,置于流式细胞仪检测细胞凋亡率。
1.7MTT检测H9C2心肌细胞增殖活性 用MTT法检测H9C2心肌细胞增殖活性,以每孔1×105个细胞接种于96孔细胞培养板,分别于培养24、48、72 h时加入20 μl、5 mg/ml的MTT溶液,室温孵育4 h,弃培养液后分别在每孔加入150 μl二甲基亚砜(DMSO),振荡10 min后溶解结晶物,置于酶标仪上检测各孔在波长为490 nm处光密度(OD)值,OD值大小即细胞增殖能力。
1.8双荧光素酶报告基因实验 使用NCBI下载CRKL的3′UTR序列并利用Primer5.0设计引物,琼脂糖凝胶电泳分离条带,收回纯化的扩增片段,构建WT-CRKL、MUT-CRKL载体,转染前收集H9C2心肌细胞,以每孔2×104个细胞的密度接种于24孔细胞培养板,将miR-15b-5p mimic与质粒共转染至H9C2心肌细胞,含有10% FBS DMEM培养基培养细胞,放入37℃、5%CO2培养箱培养5 h,更换新鲜培养基,转染2 h后收集细胞裂解液,根据荧光素酶检测试剂盒说明书操作,利用生物发光仪检测荧光素酶活性。
1.9统计学处理 采用SPSS21.0软件行t检验、单因素方差分析及χ2检验。
2 结 果
2.1H/R处理对心肌细胞中miR-15b-5p和CRKL表达的影响 相比于Con组(0.97±0.08、1.02±0.09、0.57±0.06),H/R组H9C2心肌细胞中miR-15b-5p表达(2.73±0.18)显著升高,CRKL mRNA及蛋白表达(0.47±0.08、0.22±0.04)显著降低(P<0.05),见图1。

图1 H/R处理对心肌细胞中CRKL 蛋白表达的影响
2.2抑制miR-15b-5p表达对H/R诱导心肌细胞凋亡的影响 qRT-PCR检测结果显示H/R+anti-miR-15b-5p组H9C2心肌细胞中miR-15b-5p表达(1.14±0.11)显著低于H/R+anti-miR-NC组(2.77±0.21,P<0.05),提示抑制miR-15b-5p表达细胞系转染效率较高;Con组(1.00±0.08)显著低于H/R组(2.81±0.16)。流式细胞术结果显示,与Con组〔(7.69±0.81)%〕相比,H/R组H9C2心肌细胞凋亡率〔(21.47±2.06)%〕明显升高(P<0.05)。与H/R+anti-miR-NC组〔(23.46±2.17)%〕相比,H/R+anti-miR-15b-5p组细胞凋亡率〔(14.28±1.39)%〕显著降低(P<0.05)。见图2。

图2 细胞凋亡流式图
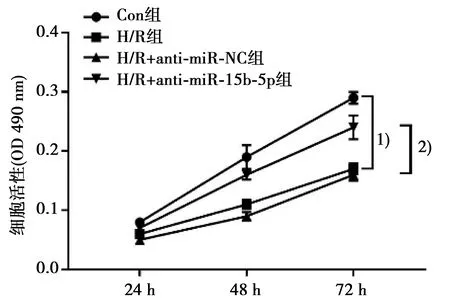
2.3抑制miR-15b-5p表达对H/R处理心肌细胞增殖的影响 MTT实验结果显示,H/R组心肌细胞OD值显著低于Con组(P<0.05),H/R+anti-miR-15b-5p组显著高于H/R+anti-miR-NC组(P<0.05),见图3。

与Con组比较:1)P<0.05;与H/R+anti-miR-NC组比较:2)P<0.05图3 各组心肌细胞增殖比较
2.4过表达CRKL对H/R诱导心肌细胞凋亡和增殖的影响 通过构建CRKL过表达载体并转染至H9C2心肌细胞,转染后构建H/R模型,Western印迹验证CRKL过表达转染效率,H/R+pcDNA-CRKL组H9C2心肌细胞中CRKL蛋白表达(0.47±0.03)显著高于H/R+pcDNA组(0.24±0.02,P<0.05),H/R组(0.26±0.03)显著低于Con组(0.61±0.05),表明CRKL过表达转染成功。流式细胞术及MTT实验结果显示H/R组H9C2心脏细胞凋亡率〔(24.57±2.35)%〕显著高于Con组〔(8.13±0.84)%〕,H/R+pcDNA-CRKL组〔(15.47±1.38)%〕相较于H/R+pcDNA组〔(26.79±2.17)%〕明显降低(P<0.05),而H9C2心肌细胞增殖活性显著高于H/R+pcDNA组(P<0.05)。见图4,图5。

1~4:Con组、H/R组、H/R+pcDNA组、H/R+pcDNA-CRKL组图4 CRKL蛋白表达
与Con组比较:1)P<0.05;与H/R+pcDNA组比较:2)P<0.05图5 过表达CRKL对H/R诱导的心肌细胞增殖的影响
2.5miR-15b-5p靶向调控CRKL的表达 采用microRNA.Org等靶基因预测软件发现miR-15b-5p与CRKL存在靶向作用,分别转染miR-15b-5p mimic、miR-NC与WT-CRKL、MUT-CRKL的荧光素酶报告基因载体进入心肌细胞,检测荧光素酶活性变化,结果显示转染miR-15b-5p mimic后,相对于miR-NC组(1.02±0.08),携带有WT-CRKL报告基因载体的心肌细胞荧光素酶活性明显降低(0.39±0.04,P<0.05),而携带有MUT-CRKL报告基因载体的心肌细胞在转染miR-15b-5p mimic后荧光素酶活性无明显变化(0.99±0.07、1.01±0.09,P>0.05)。Western印迹进一步验证miR-15b-5p与CRKL的靶向调控关系,结果显示miR-15b-5p组H9C2心肌细胞中CRKL蛋白表达(0.24±0.03)明显低于miR-NC组(0.59±0.05,P<0.05),anti-miR-15b-5p组(0.87±0.07)明显高于anti-miR-NC组(0.57±0.06,P<0.05),见图6,图7。

图6 CRKL 3′UTR中与miR-15b-5p互补的核苷酸序列

1~4:miR-NC组、miR-15b-5p组、anti-miR-NC组、anti-miR-15b-5p组图7 miR-15b-5p调控CRKL蛋白的表达
2.6抑制CRKL表达逆转了抑制miR-15b-5p表达对H/R诱导心肌细胞凋亡和增殖的作用 分别共转染si-NC、si-CRKL与anti-15b-5p进入H/R诱导的H9C2心肌细胞,Western印迹结果显示H/R+anti-15b-5p+si-CRKL组CRKL蛋白表达(0.42±0.04)明显低于H/R+anti-15b-5p+si-NC组(0.74±0.06,P<0.05),H/R+anti-miR-156-5p组(0.72±0.07)明显高于H/R+anti-miR-NC组(0.21±0.03)。流式细胞术检测结果显示H/R+anti-miR-15b-5p组H9C2心肌细胞凋亡率〔(12.57±1.14)%〕明显低于H/R+anti-miR-NC组〔(22.76±2.11)%〕,H/R+anti-15b-5p+si-CRKL组〔(17.69±1.73)%〕相较于H/R+anti-15b-5p+si-NC组〔(10.78±1.34)%〕明显升高(P<0.05),而心肌细胞活性明显降低(P<0.05),见图8,图9。

1~4:anti-miR-NC组、anti-miR-15b-5p组、anti-miR-15b-5p+si-NC组、anti-miR-15b-5p+si-CRKL组图8 CRKL蛋白表达
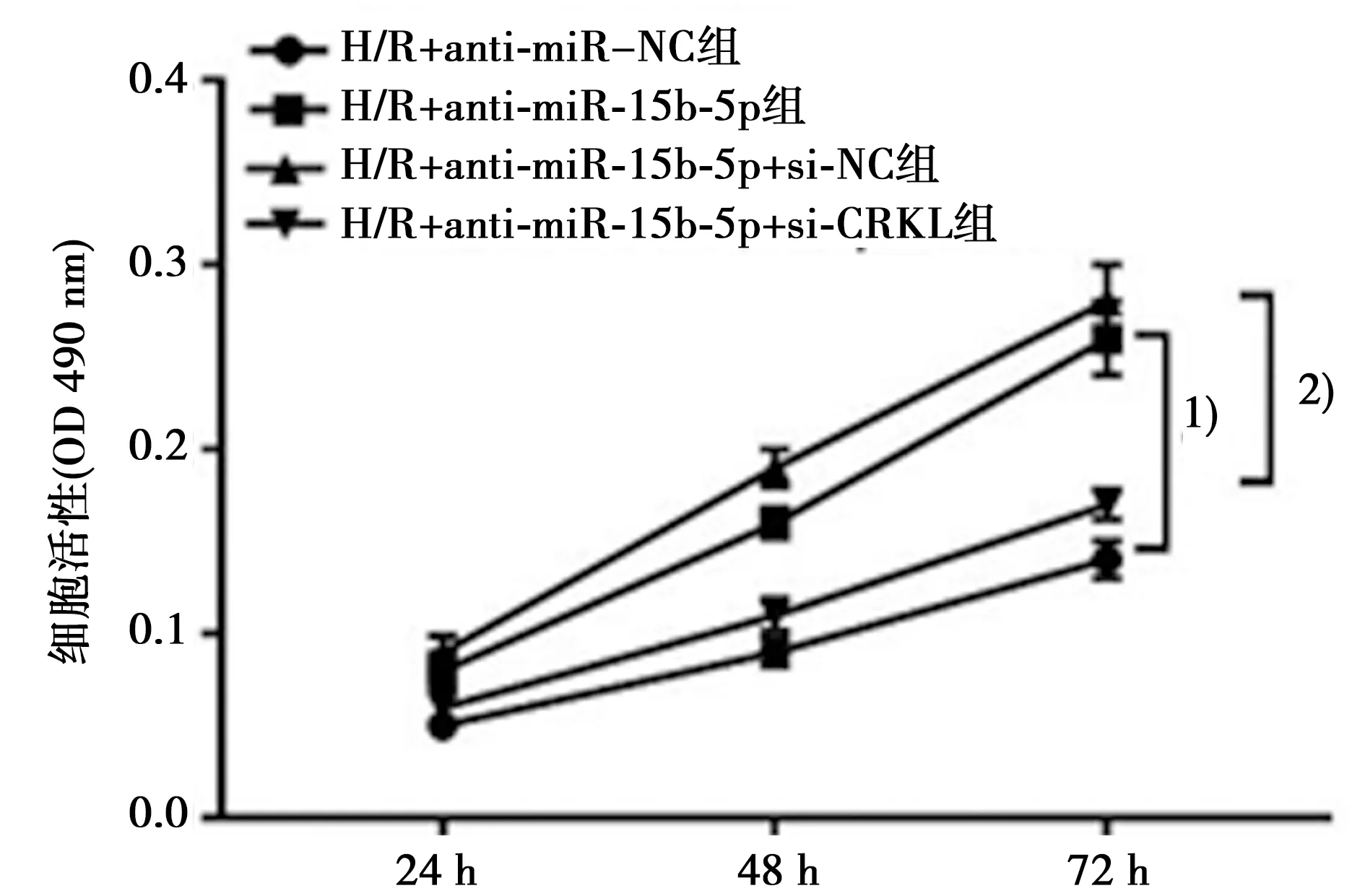
与H/R+anti-miR-NC组比较:1)P<0.05;与H/R+anti-15b-5p+si-NC组比较:2)P<0.05图9 抑制CRKL表达逆转了抑制miR-15b-5p表达对H/R诱导的心肌细增殖的促进作用
3 讨 论
心肌缺血再灌注损伤可引发心律失常及心肌梗死等状况,研究显示缺血再灌注损伤心肌细胞中细胞凋亡蛋白表达水平升高,并可促使心肌细胞凋亡〔8,9〕。因此减少缺血再灌注损伤诱发的心肌细胞凋亡可有效保护AMI患者心肌。部分miRNA异常表达可能在心肌缺血再灌注损伤过程中发挥重要作用〔10〕。因此本研究进一步探究miRNA对H/R诱导心肌细胞凋亡和增殖的作用机制,可为心血管疾病治疗提供新靶点。
miR-15b-5p具有多种生物学功能并可调控子宫肌瘤等不同肿瘤细胞增殖及凋亡过程〔11〕。相关研究发现miR-15b可调节血管生成、心肌缺血再灌注损伤及细胞凋亡等过程,进一步分析发现miR-15b在缺血再灌注损伤小鼠模型的心肌细胞中呈高表达,并可抑制Bcl-2表达进而促使细胞凋亡〔12,13〕。miR-15b-5p异常表达与冠状动脉疾病发生及发展过程密切相关〔14~16〕。由此推测miR-15b-5p可促进心肌细胞凋亡并抑制细胞增殖。本研究结果说明H/R处理后心肌细胞中miR-15b-5p呈高表达。本研究通过抑制miR-15b-5p表达并进行H/R处理,结果说明抑制miR-15b-5p表达可增强H/R诱导的心肌细胞增殖能力并降低心肌细胞凋亡率。提示心肌细胞H/R损伤可能与miR-15b-5p表达水平升高有关,抑制miR-15b-5p表达可能对心肌细胞H/R损伤具有保护作用。
肿瘤抑制因子SASH1可与CRKL相互作用进而抑制结直肠癌上皮-间质转化,研究发现miR-1827可靶向调节CRKL表达进而调节肺腺癌肿瘤细胞迁移、侵袭及血管生成过程〔17,18〕。H/R诱导的心肌细胞中CRKL蛋白表达明显降低,通过采用shRNA敲低CRKL基因表达可能通过降低p-ERK1/2蛋白表达进而促进H/R诱导的心肌细胞凋亡〔19,20〕。本研究结果说明CRKL蛋白表达水平降低可加重H/R诱导的心肌细胞损伤。通过构建CRKL过表达载体转染至H9C2心肌细胞行H/R处理,结果说明CRKL过表达可减少H/R引起的心肌细胞损伤并可能改善患者心脏功能。提示上调CRKL表达水平可能减轻H/R诱发的组织器官损伤。本研究证实miR-15b-5p高表达可促进心肌细胞凋亡,经生物信息学预测软件发现miR-15b-5p与CRKL可能存在靶向作用,进一步采用双荧光素酶报告基因实验验证miR-15b-5p可靶向调控CRKL基因表达,提示miR-15b-5p可能通过下调CRKL基因表达进而促进心肌细胞凋亡。本研究转染CRKL siRNA沉默CRKL表达,结果说明抑制CRKL表达可逆转抑制miR-15b-5p表达对H/R诱导的心肌细胞凋亡和增殖的作用。提示miR-15b-5p可直接靶向调控CRKL表达进而促进H/R诱导的心肌细胞凋亡并降低细胞增殖能力。由此可知,H/R诱导的心肌细胞损伤过程中CRKL蛋白表达降低,miR-15b-5p高表达并可降低CRKL蛋白表达进而促进心肌细胞凋亡。
综上,miR-15b-5p在H/R损伤过程中发挥重要作用,抑制miR-15b-5p可减少H/R诱导的心肌细胞凋亡并促进细胞增殖,而miR-15b-5p可能是通过负向调控CRKL而发挥作用,miR-15b-5p可能成为临床诊断及治疗AMI的重要靶点基因。但关于miR-15b-5p与CRKL是如何调控H/R损伤诱导的心肌细胞凋亡及其可能作用通路均需深入研究。
