C57BL6近交系小鼠前列腺癌原位移植瘤模型建立及比较*
2021-06-09付启航王雷雷徐阳阳
张 政,张 欣,付启航,岳 悦,王雷雷,陈 辉,徐阳阳△
(1.哈尔滨医科大学附属肿瘤医院放疗科,哈尔滨 150000;2.哈尔滨理工大学化学与环境工程学院,哈尔滨 150000;3.哈尔滨医科大学附属肿瘤医院医学影像专业,哈尔滨 150000;4.哈尔滨医科大学附属肿瘤医院泌尿外科,哈尔滨 150000)
近年来,前列腺癌的发病率在全球呈逐年升高的趋势,已是男性泌尿生殖系统最常见的恶性肿瘤之一[1]。目前,人们虽然对前列腺癌的治疗研究较多,但大多停留在皮下移植瘤模型的层面上,因其在生理结构和疾病发生、发展的过程上都不符合前列腺癌的一般规律,所以模拟效果并不太理想。RM-1前列腺癌原位移植瘤方面,目前主要有两种移植方式[2-3],因其生存期短、操作难度较高且对正常组织损伤较大,所以导致模拟结果多具有局限性。本研究通过长期摸索,发现一种新的更适合于实验研究的成瘤方式。本文旨在对此方法进行介绍,并与其他两种原位成瘤方式进行比对分析,以探讨其实际应用模拟价值。
1 材料与方法
1.1 材料
1.1.1实验动物
选择C57BL6雄性近交系7周龄(18~20 g)小鼠38只,均购自哈尔滨医科大学附属第二医院动物实验中心,饲养环境恒温、恒湿、清洁、无特殊病原体,允许小动物自由摄取食物和饮水。
1.1.2前列腺癌细胞株
小鼠前列腺癌细胞株系即RM-1细胞株购自中国医学科学院上海细胞库,生长于RPMI1640完全培养液中,在5%CO2,37 ℃环境中常规培养。
1.2 方法
1.2.1实验分组
取2只小鼠进行皮下成瘤,用于原位的肿瘤移植。将余下的36只小鼠随机分成3组,每组12只。A组为瘤丝注射组、B组为细胞注射组、C组为肿块移植组。
1.2.2荷瘤小鼠模型的建立
1.2.2.1皮下荷瘤鼠的建立
取2只C57BL6近交系小鼠,剪去小鼠背部毛发,用医用乙醇清洁小鼠背部,接种制备细胞浓度为2×107个/mL的RM-1前列腺癌细胞,并将其接种于小鼠背部皮下。每只接种100 μL。定期查看肿瘤生长状况。用于瘤丝注射组和肿块移植组的肿瘤均取自上述鼠背皮下肿瘤。
1.2.2.2A组模型的建立
用于移植的瘤丝来源于上述荷瘤鼠。取1 mL注射器并抽吸10 μL生理盐水。将取出的瘤块置于低温、无菌的0.9%生理盐水中,用1 mL注射器针头轻轻划拨肿瘤外周,将划下来的肿瘤丝置于微量注射器尖端,轻轻回抽注射器,以肿瘤丝刚好堵住微量注射器尖端为宜。取出上述C57BL6小鼠12只,用镊子沾水后,轻轻剔去腹部毛发,用医用乙醇对小鼠腹部进行消毒。用10%水合氯醛麻醉小鼠,仰卧位,取下腹部正中切口长1.5~2.0 cm,显露腹腔。轻轻提拉膀胱,暴露前列腺,将顶有肿瘤丝的针头插入前列腺包膜下,此时注射生理盐水,将肿瘤丝推入前列腺内,缓慢拔出针头。恢复器官位置,用6-0单针缝合线分别连续缝合腹肌和皮肤,用聚维酮碘再次对伤口进行消毒处理。待小鼠苏醒后放回笼中。
1.2.2.3B组模型的建立
取对数生长期RM-1前列腺癌细胞,配成浓度为2×107个/mL溶液。取出上述C57BL6小鼠12只,用镊子沾水后,轻轻剔去腹部毛发,用医用乙醇对小鼠腹部进行消毒。从小鼠右下腹缓慢注射10%水合氯醛麻醉小鼠,待小鼠麻醉后,取仰卧位,沿腹部正中线距离外生殖器约0.5 cm处做1.5~2.0 cm手术切口,显露腹腔。找出膀胱所在位置,用镊子轻轻提拉膀胱,推开膀胱底部周围组织,显露前列腺,1.5 mm×2.0 mm×2.0 mm大小,分为左右两叶,有明显的腺体组织特征,用微量注射器向右侧前列腺包膜下注射RM-1细胞悬液10 μL,以包膜和腺体分离,肉眼可见轻微鼓起为标准[2]。恢复器官位置,其余同1.2.2.2。
1.2.2.4C组模型的建立
取出皮下荷瘤鼠的瘤块,切成直径1 mm的肿瘤块。用上述建立细胞注射原位瘤模型的方法找出前列腺,用尖刀分离两腹侧叶,将肿瘤块置于两腹侧叶间形成的缝隙中用8-0单线缝合针将肿块与前列腺缝合在一起,轻轻关闭并缝合被摸[3]。恢复器官位置,其余同1.2.2.2。
1.2.3实验观察
以小鼠出现严重恶病质,濒死状态为实验结束的终点,此时安乐处死小鼠。观察小鼠成瘤情况,取出肺、肠、肝、脾、肾、胃进行甲醛固定,石蜡包埋,切片,苏木精-伊红(HE)染色后光镜下观察是否有转移灶。
1.3 统计学处理
2 结 果
2.1 3组小鼠成瘤及转移情况比较
A、B、C组小鼠成瘤率分别为100%、91.67%、91.67%。处死小鼠,解剖打开腹腔,可观察到肿瘤呈块状,3组小鼠均有大量且广泛的腹腔组织浸润,膀胱、腹膜均肉眼可见肿瘤侵犯,腹膜后及盆腔淋巴结均已和肿瘤融合成块,无法分离,满腹血性液体。且重要的器官如肺、肠、肝、脾、肾、胃均有转移(图1),其中,A、B、C组小鼠肺转移率分别为83.33%、25.00%、33.33%,肝转移率分别为75.00%、25.00%、25.00%,A组小鼠的肺、肝转移率明显高于B、C组(P<0.05),B、C组小鼠的肺、肝转移率比较差异无统计学意义(P>0.05);3组小鼠的建模成功率和肠、脾、肾、胃器官转移率比较,差异均无统计学意义(P>0.05),见表1。
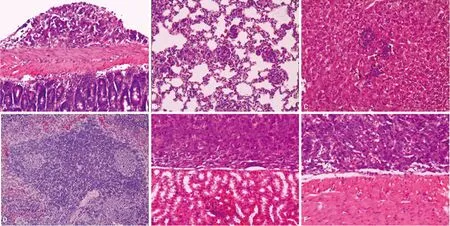
A:肠;B:肺;C:肝;D:脾;E:肾;F:胃。
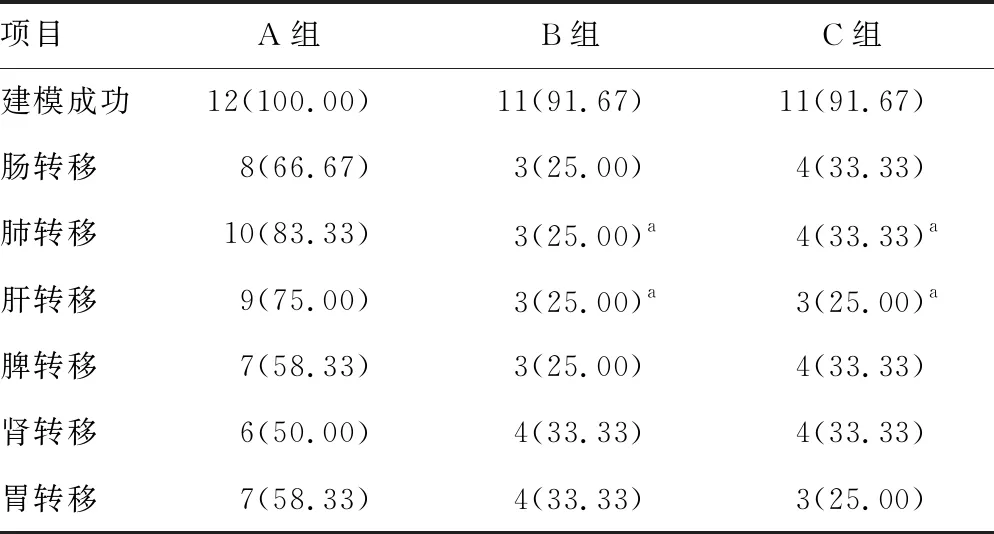
表1 3组小鼠建模成瘤及转移情况比较[n(%),n=12]
2.2 3组小鼠生存时间比较
A、B、C组小鼠生存时间分别为(17.33±2.19)、(14.7±2.39)、(13.58±2.43)d,A组小鼠生存时间明显长于B、C组(P<0.05);B、C组小鼠生存时间比较,差异无统计学意义(P>0.05)。
2.3 3组小鼠成瘤方式操作难度比较
A组要求相对较低。B组成瘤方式易导致细胞液外溢造成人为肿瘤转移,对术者注射器持握的平稳性要求较高,C组需对前列腺筋膜进行缝合,此操作不仅要求术者具有较好的显微手术技术,且对小鼠机体有一定的损伤,破坏了原有前列腺生理结构。
3 讨 论
长期以来人们对前列腺癌模型的建立多停留在皮下水平,皮下成瘤具有便于观察、实验简便的特点,但不能真实模拟前列腺癌转移情况[4]。有文献表明,在超声低回声反射阳性时,即临床检测怀疑为前列腺癌的时候,41.5%的患者已有转移[5]。盆腔淋巴结和肺部转移是晚期前列腺癌患者常见症状,也是晚期前列腺癌治疗的重点和难点。临床中前列腺癌患者的主要治疗方法为雄激素剥夺治疗(ADT),但效果不甚理想,绝大多数患者都会从激素敏感性前列腺癌(HSPC)发展成为转移性激素抵抗性前列腺癌(mCRPC)[6-7]。有效地建立晚期转移性前列腺癌小鼠模型,具有非常高的临床价值和社会意义[8]。目前临床中常用CT作为判断前列腺癌腹腔淋巴结转移的方式,CT可通过观察淋巴结大小判断有无淋巴结转移。但CT的分辨率较低,小于1 cm的淋巴结难以观察[9]。有研究表明,前列腺癌在发生周围组织粘连和侵犯外周器官之前,已有41%的患者发生淋巴结转移[10]。因小鼠的淋巴结较小,且晚期前列腺癌小鼠腹腔肿瘤浸润性的转移粘连,加之满腹血性腹水使得晚期腹腔淋巴结转移情况难以观察。对于此本研究认为,淋巴结转移观察的时间窗应控制在腹腔广泛转移之前,以减少晚期广泛粘连对观察带来的干扰。
传统的前列腺原位移植瘤模型建立通常以细胞注射或瘤块移植的方式进行。通过传统方式建立小鼠前列腺原位癌模型,虽有很好的成瘤率,但器官转移率相对较低。不能很好地模拟临床中晚期前列腺癌多发转移的情况。而在动物实验中,药物实验往往需要一定的观察时间窗[11-12]。传统成瘤方式生存时间短,在药物疗效实验观察中有一定的劣势,有可能药物尚未发挥作用小鼠便已经死亡,其短暂的生存期限制了药物方面的观察研究[13-14]。为此,如何在保持良好成瘤率的前提下,提高肿瘤的转移率和增加小鼠的存活时间,是当下动物模型构建领域需要解决的问题。本实验通过瘤丝注射的方式进行原位瘤移植,观察发现通过瘤丝注射方式进行前列腺癌原位移植可提供较好的成瘤率和器官转移效果。在生存时间上,瘤丝注射也较传统成瘤方式明显延长。
在模型制作难度方面,因小鼠的前列腺癌非常小,只有约1.5 mm×2.0 mm×2.0 mm大小,传统制作方法对术者精准度要求均较高。使用细胞注射法成瘤,在细胞注射时,稍有不慎,极易使注射液外溢,而注射液为无色肿瘤细胞液,少量溢出时肉眼难以观察。有文献表明,注入肿瘤细胞后3周内,有70%的移植瘤模型会出现针道转移,从而造成人为播散[15],所以,此方法增加了人为腹腔转移的风险。手术时需要术者小心谨慎,认真观察,对注射器持握的平稳性要求较高,是一项难度较高的精准细致的操作。肿块移植成瘤时,因肿块肉眼可见,所以一定程度上可以降低肿瘤人为转移的风险。但因前列腺较小,此操作亦需要全神贯注,小心谨慎,当肿块放入两腹侧叶间的缝隙后,应小心将筋膜复位,筋膜为一薄层结缔组织,缝合需格外小心以确保瘤块被筋膜严密包裹,这需要术者有较好的外科操作技术,且因需对筋膜进行切开再缝合,一定程度上破坏了前列腺原有的组织结构,对小鼠产生了较大的伤害。因此,如何在不改变小鼠解剖结构的前提下,降低模型制作难度,提升成瘤方法的实用性,是当下需要解决的问题。而本实验所采用的瘤丝注射法,只需将1 mL注射器针头插入筋膜下,然后注射10 μL生理盐水,此番操作既不会造成细胞液渗漏导致人为种植转移,也无需对筋膜进行切开再缝合,不仅降低了操作难度而且减少了人为种植转移和对小鼠的伤害。
本研究通过新的C57BL6小鼠原位前列腺癌成瘤方法——瘤丝注射法,并于传统的两种C57BL6小鼠RM-1前列腺癌原位移植瘤模型进行比对,主要从成瘤率、血道转移、生存期及操作难度方面进行剖析,客观的比较了三种成瘤方式的实验应用价值。总之,瘤丝注射法不仅均具有很好的成瘤率,且对组织损伤小,血道转移率高,易于操作及普及。其成瘤方式更适合于模拟晚期前列腺癌患者多发转移的研究,且其生存时间窗相对较长,可以对药物的治疗效果进行更好的评价,具有更高的临床模拟价值。
