体外膜肺氧合在急性暴发性心肌炎中的临床应用及效果分析
2021-06-08丘国政吕立文朱瑞凯潘春熹段文龙陈升鑫庞会锋
丘国政,吕立文,朱瑞凯,陈 万,石 磊,潘春熹,段文龙,陈升鑫,庞会锋
急性暴发性心肌炎(acute fulminant myocarditis,AFM)被定义为一种发作迅速、血流动力学严重损害的心脏炎症,其临床表现为严重的心肌收缩功能的下降,进而导致心源性休克、恶性心律失常甚至心脏骤停[1]。AFM起病急、病死率高,往往伴随着血流动力学不稳定,是临床心血管急危疾病。一旦确诊为AFM,及时有效的机械辅助支持是首选的治疗方案和救治中心环节[2]。体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)作为一种循环辅助支持技术,它经过导管将血引到体外,通过膜式氧合后再输回患者体内,可充分降低心脏前后负荷,使心肌获得休息[3]。在积极的药物治疗和主动脉内球囊反搏(intra-aortic balloon pump,IABP)不能纠正或不足以改善循环的情况下,ECMO可能是为衰竭心脏提供恢复时间的有效的一种手段。ECMO在发达国家已被证实在AFM中能够提供迅速、有效的支持[4]。本研究现将ECMO辅助AFM患者治疗的临床应用及效果分析报道如下。
1 资料与方法
1.1一般资料 选取2019-06~2020-12在广西壮族自治区人民医院急诊监护病房住院使用ECMO辅助治疗的AFM患者10例。入选标准:在急性心肌炎的基础上,出现严重的血流动力学障碍的并发症,如心源性休克、心律失常、心脏骤停等,符合中华医学会的AFM的诊断标准[2]。排除标准:不可逆的脑功能损害、恶性肿瘤晚期。本研究已通过本院伦理委员会审核,经过患者家属同意并签署知情同意书。
1.2方法
1.2.1 设备 采用美国美敦力(Medtronic)或德国迈柯唯(Maquet)公司生产的离心泵、动静脉涂层导管等,使用静脉-动脉体外膜肺氧合(venoarterial extracorporeal membrane oxygenation,VA-ECMO)模式,行股静脉、股动脉穿刺或者切开置入导管,转流方向为股静脉-离心泵-体外膜肺-股动脉。在同侧股动脉置入远端灌注管,以防远端肢体缺血。
1.2.2 ECMO的管理 在ECMO上机早期,泵血流量可设置患者理想心输出量的较高水平,辅以血管活性药物。随着AFM患者的血流动力学稳定,可下调泵血流量,减少血管活性药物的使用。ECMO上机期间需要全身肝素化实施抗凝,动态检测激活凝血酶时间(activated coagulation time,ACT)使其维持在180~200 s。ECMO期间患者按需应用镇静、镇痛、肌松等药物,以确保患者安静接受治疗。
1.2.3 ECMO的撤离 当ECMO循环支持血流量下调至20%,需要较小剂量的血管活性药物时,患者的血流动力学仍较稳定,稳定2~4 h可考虑撤去ECMO。
1.2.4 观察指标及检测方法 10例患者均在我院进行肌酐、乳酸、肌酸激酶同工酶(creatine kinase isoenzyme-MB,CK-MB)、肌钙蛋白I、左心室射血分数(left ventricular ejection fraction,LVEF)、脑尿钠肽(brain natriuretic peptide,BNP)的检测。观察ECMO治疗前和治疗后1个月的肌酐、乳酸、CK-MB、肌钙蛋白I、LVEF、BNP等指标的变化情况。采集患者ECMO上机前后的静脉血3 ml,以转速3 000 r/min离心10~15 min,然后收集血清,以免疫荧光法进行心肌酶谱检测,对CK-MB进行含量测定,阳性参考值>2.88 ng/ml。肌钙蛋白I采用化学发光法测定,阳性参考值>0.1 ng/ml。血浆BNP水平的检测采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定,阳性参考值>300 pg/ml。肌酐采用酶法检测,阳性参考值>84 μmol/L。采用超声检查仪器(迈瑞M9)进行心脏彩超检查,确定患者的LVEF,并由专业超声医师多次检测取平均值,另由有资质的超声医师评估结果。

2 结果
2.110例患者的基线资料 本研究共纳入符合标准病例10例,其中男7例,女3例,年龄4~42(20.9±14.2)岁。急性生理学与慢性健康状况评分系统Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHEⅡ)评分为(34.3±7.65)分,序贯器官衰竭评分(Sequential Organ Failure Score,SOFA)为(10.4±7.03)分。10例均出现心律失常。启动ECMO指征:7例心源性休克,3例难治性心脏骤停。见表1。
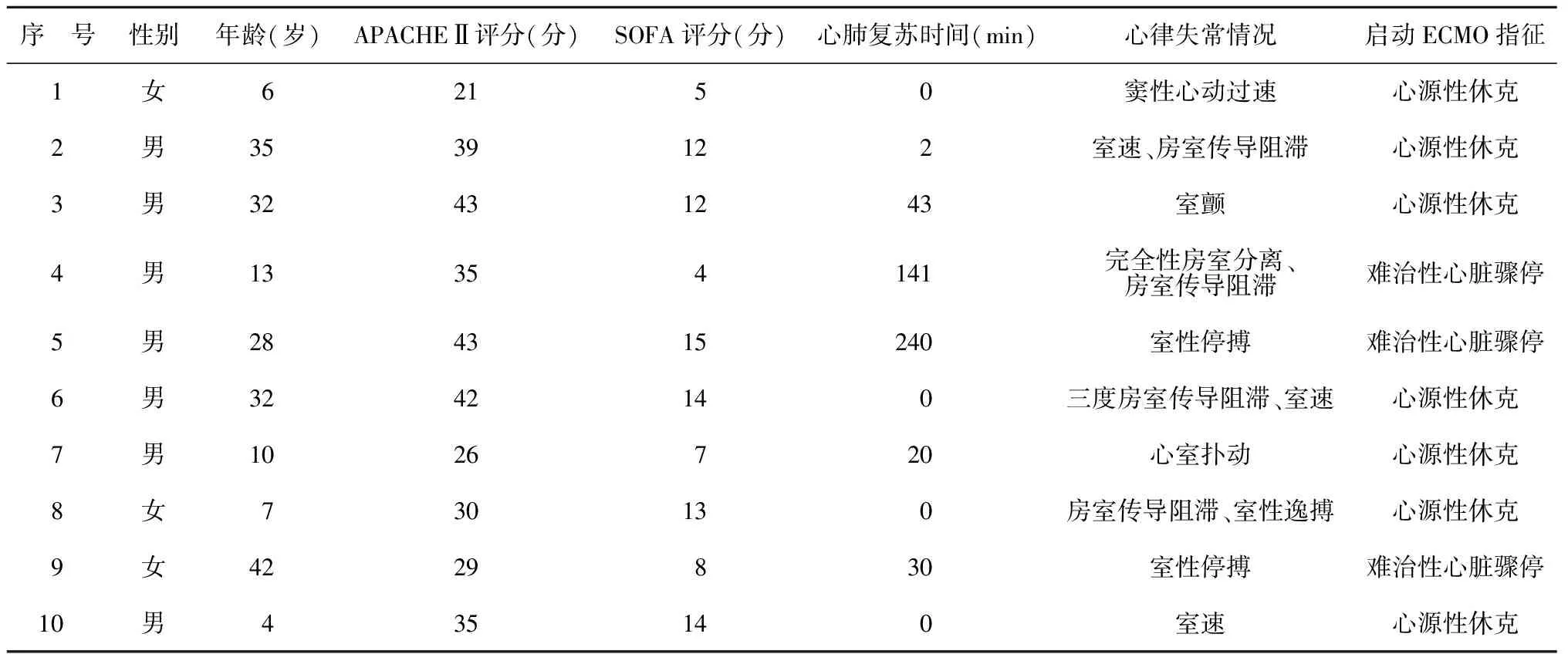
表1 10例患者的基线资料
2.210例患者ECMO治疗前后的相关指标变化比较 ECMO辅助治疗后,AFM患者BNP、CK-MB、肌钙蛋白I、乳酸较治疗前明显降低,而LVEF明显升高,差异均有统计学意义(P<0.05),肌酐未见明显差异(P>0.05)。见表2。
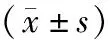
表2 10例患者ECMO治疗前后的相关指标变化比较
2.310例患者ECMO相关数据及转归情况 治疗后,ECMO初始ECMO转速为(3239.00±593.73)r/min,ECMO初始血流量为(2.79±0.89)L/min,ECMO辅助时间为(87.70±42.81)h,呼吸机辅助时间为(117.90±88.23)h,ECMO成功撤机7例。未成功撤机3例,其中2例为体外心肺复苏(extracorporeal cardiopulmonary resuscitation,ECPR),1例为儿童VA-ECMO出现了严重出血并发症。平均3个月随访,好转出院患者均无恶性心律失常、急性心力衰竭发作,患者均能正常生活。见表3。

表3 10例患者ECMO相关数据及转归情况
3 讨论
3.1AFM病情凶猛,可迅速导致心力衰竭,甚至危及生命。目前尚无针对AFM的特效治疗方法。AFM急性期多为支持性治疗,包括IABP、心室辅助装置、ECMO等,其中ECMO在辅助治疗AFM中,与前两者相比具有不受恶性心律失常的影响、安装快捷方便、不存在心脏切口并发症等明显优势[5-7]。因此,近年来,ECMO在辅助治疗AFM中被越来越多地使用。本文就使用ECMO辅助治疗AFM进行研究,为临床提供参考依据。
3.2AFM是一种罕见的心血管病理过程,但其病因通常不明确,有研究表明心肌肌钙蛋白I升高是检测进行性心肌损伤的可靠指标,肌钙蛋白I浓度升高与心力衰竭的快速进程(<1个月的持续时间)相关,这表明心肌坏死是早期事件,多数患者需要迅速诊断和积极治疗以限制其恶化的演变[8]。VA-ECMO以其应用的简便性和快速性,能够在提供的双心室支持的基础上辅助呼吸支持,被证实是为AFM患者的康复或更积极的治疗提供了桥梁[9]。有研究报道,及时进行VA-ECMO治疗可使AFM患者的存活率提高至80%,而未接受VA-ECMO支持的患者存活率仅为50%[10]。本研究中,ECMO辅助治疗AFM患者存活7例,这与既往研究生存率相似[11-12]。先前的研究报道反映心脏炎症状态的血清标志物除了肌钙蛋白I,CK-MB、BNP、乳酸、肌酐等也与该疾病的严重程度具有相关性[13]。本研究中ECMO辅助治疗后患者的BNP、CK-MB、肌钙蛋白I、乳酸较治疗前明显降低,LVEF明显升高(P<0.05),肌酐未见明显差异(P>0.05),这可能与患者入院时未有明显肾脏疾病以及ECMO辅助时间短尚未造成肾损伤有关。患者出院3个月后的随访结果显示,患者远期均未有明显心脏衰竭、严重心律失常等并发症的发生。由此可见,ECMO辅助治疗AFM可有效改善患者的生存率及远期预后。本研究的局限性在于属于回顾性分析,样本数量太少,存在信息偏倚,在后续的研究中可加大样本例数进行分析。
综上所述,ECMO辅助治疗AFM可以有效提高患者生存率,有利于改善患者的远期预后。
