美洲锦鳚抗冻蛋白的表达与特性分析
2021-06-08赵庆春许子华
陈 莹, 赵庆春, 吴 琼, 胡 北, 许子华
(中国人民解放军北部战区总医院 药学部实验室, 辽宁 沈阳 110000)
0 引言
【研究意义】我国高寒地域广泛,涵盖东北、西北、华北等,人体长时间暴露在低温环境中极易导致寒冷损伤,急需增强抵御寒冷的能力和提高寒冷情况下的作业能力[1]。抗冻蛋白是一类能抑制冰晶生长或抑制重结晶的蛋白质,主要应用于农业、医学、食品、工业等领域,医学方面的应用主要集中在细胞及器官的超低温保存方面,若能拓展至冻伤防治领域,将会是一大突破,对寒冷损伤的预防研究具有重大意义[2-3]。【前人研究进展】生活在低温环境下的鱼类为了适应生存环境,在长期进化中产生了一种能抑制冰晶生长或抑制重结晶的蛋白质,即抗冻蛋白(antifreeze peoteins,AFPs)。抗冻蛋白最早在1969年由Devries在极区海鱼血液中发现,目前已证明AFPs普遍存在于鱼类、植物、昆虫、细菌和真菌中[1-3]。抗冻蛋白能在结冰或亚结冰条件下保护生物体不受伤害,海水的冰点大约在-1.8℃,由于导热介质的不同,海水中的温度变化比陆地小。针对抗冻蛋白的作用机制研究,学者们提出了多种假说,大多数研究者比较接受Raymond在1977年提出的吸附抑制学说,该学说认为在低温条件下,AFPs具有选择吸附性,首先结合在冰晶生长的表面,使冰晶停止生长,而未被AFPs覆盖的区域晶体则沿着平面逐渐向前推进,最终形成圆形的表面,使其表面曲率增加,进而增加晶体表面积,从而影响晶体生长[4-8]。【研究切入点】基于仿生学原理,利用分子生物学技术,结合生物信息学分析,研究美洲锦鳚抗冻蛋的表达与特性,为探索寒冷损伤防治的新方法奠定理论基础。【拟解决的关键问题】美洲锦鳚体内的抗冻蛋白为Ⅲ型抗冻蛋白,研究低温诱导获得可溶性AFPs的诱导条件,通过生物信息学分析构建美洲锦鳚抗冻蛋的低温表达系统,研究鱼类抗冻蛋白的特征特性。
1 材料与方法
1.1 材料
1.1.1 载体和菌株 PMD18T-AFP质粒、感受态大肠杆菌(Escherichiacoli)菌株DH5α、BL21(DE3)均为中国人民解放军北部战区总医院药学部实验室保藏。
1.1.2 主要试剂 PCR扩增试剂、限制性内切酶Xho I、Nde I,T4 DNA连接酶,Taq酶以及DL2000 DNA marker等购自宝生物工程(大连)公司,异丙基β-D-硫代半乳糖苷(IPTG)、氨苄青霉素(Amp+)、超低分子量蛋白marker、Bradford蛋白浓度测定试剂盒、Tricine-SDS-PAGE凝胶制备试剂盒、考马斯亮蓝快速染色液均购自Solarbio公司。
1.2 方法
1.2.1 构建表达载体 设计引物:F: 5'-TAATACGACTCACTATAGGG-3',R: 5'-GCTAGTTATTGCTCAGCGG-3'。通过PCR从PMD18T-His6-AFP质粒上获取目的基因,利用Xho Ⅰ、VNdeⅠ限制性内切酶双酶切,得到的酶切片段用T4 DNA连接酶与pET22b载体连接,使目的基因克隆至pET-22b载体。将重组质粒转化E.coli BL21(DE3)的感受态细胞,并涂布于含有氨苄青霉素(Amp+)的LB固体培养基上,37℃倒置培养。通过菌落PCR鉴定,扩增所得的片段经琼脂糖凝胶电泳检测,筛选出阳性克隆的单菌落,并送至金唯智生物科技有限公司进行测序。
1.2.2 诱导表达 将重组菌株接种至含Amp+的新鲜LB液体培养基中,恒温震荡培养至OD600为0.6~0.8,考察不同诱导温度(18℃,28℃,37℃)及不同终浓度诱导剂(IPTG)(0 mmol/L, 0.1 mmol/L,0.2 mmol/L,0.4 mmol/L)对目的蛋白表达量的影响,优化诱导条件。培养结束后,离心去除培养基,收集菌体,超声破碎后离心,吸取上清液,得到可溶性蛋白,通过 Elisa分析蛋白表达情况,确定最佳诱导条件。
1.2.3 蛋白纯化 经扩大培养后收集菌体,超声破碎的上清液通过Chelating Sepharose Fast Flow层析对含有His-tag的目的蛋白进行纯化,将样品以0.8 mL/min的流速上样,再用含不同浓度咪唑的缓冲液洗脱,收集不同条件下的洗脱液进行Tricine-SDS-PAGE分析。
1.2.4 质谱(MALDI-TOF/TOF)鉴定 从Tricine-SDS-PAGE分析的胶条上切取目的蛋白,经处理后通过MALDI-TOF/TOF串联质谱仪检测,采用自动获取数据及正离子模式进行数据采集,将一级与二级质谱数据整合,并使用GPS 3.6(Applied Biosystems)和Mascot 2.3(Matrix Science)对数据进行全面分析和蛋白鉴定。
1.2.5 生物信息学分析 从基因数据库(GenBank/EMBL)中获取各种鱼类抗冻蛋白的序列信息,用MEGA 7.0 进行多序列比对,用邻接法(Neighbor-joining)构建系统进化树。
1.2.6 性质分析 根据结构、活性、作用机制等的差异,对几种鱼类抗冻蛋白的性质进行比较分析。
2 结果与分析
2.1 载体构建
培养后的菌落通过PCR鉴定(图1),筛选出的阳性单菌落序列与GeneBank中鱼类抗冻蛋白的序列比对一致。
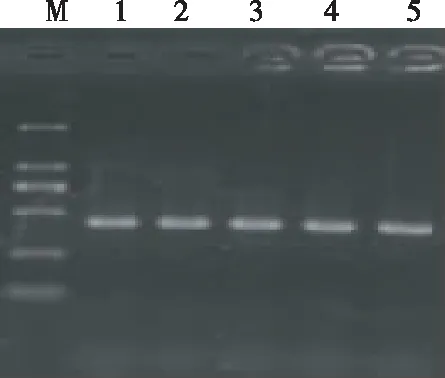
注:M为DNA marker,1~5为AFP的PCR产物。
2.2 诱导表达
从图2看出,加入终浓度为0.1 mmol/L的IPTG,诱导温度为18℃时,目的蛋白表达量最高。
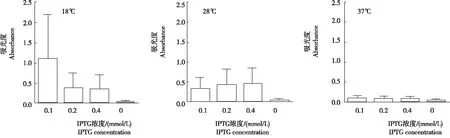
图2 不同诱导温度及诱导剂不同浓度处理目的蛋白的表达量
2.3 蛋白分离纯化
电泳结果(图3)显示,最终纯化的蛋白仅有1条清晰条带,说明目的蛋白基本达到电泳纯。
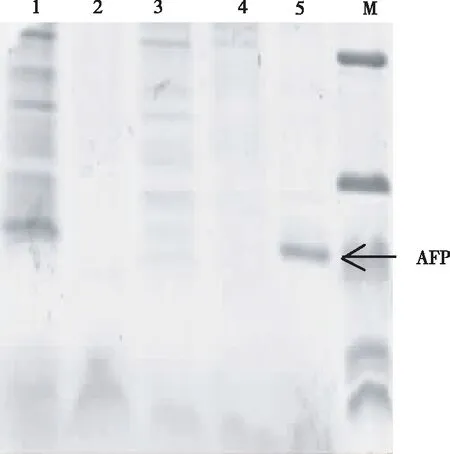
注:M为Protein ladder,1为菌体裂解液,2为穿过液,3为洗涤液,4为低浓度咪唑洗脱液,5为高浓度咪唑洗脱液。
2.4 质谱(MALDI-TOF-TOF)鉴定
通过 MALDI-TOF/TOF串联质谱仪对目的蛋白进行鉴定,有效地优化了诱导条件,通过GPS 3.6(Applied Biosystems)和Mascot2.3(Matrix Science)对数据进行全面分析和蛋白鉴定结果显示(图4),目的蛋白为美洲锦鳚抗冻蛋白。
图4 重组AFP的质谱鉴定结果
2.5 生物信息学
从图5可知,美洲锦鳚AFP与大西洋狼鱼(Anarhichaslupus)、大西洋鲱(Clupeaharengus)、鳜鱼(Sinipercachuatsi)等鱼类的亲缘关系较近,与其他鱼类的亲缘关系较远。
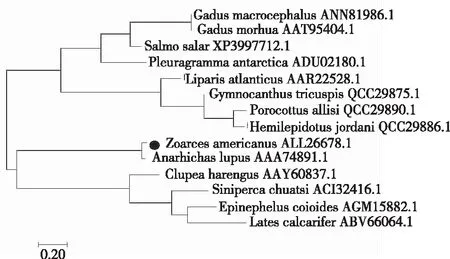
图5 鱼类AFP氨基酸序列的系统进化树
2.6 鱼类几种抗冻蛋白的性质
从表1和图6看出,在鱼类几种抗冻蛋白中分子量最小的是AFPⅠ,其富含丙氨酸,结构相对简单,由α螺旋组成,主要与冰晶表面的锥面或二级棱面结合。AFP II分为2种亚型,Ca2+依赖亚型与Ca2+不依赖亚型,其中Ca2+有助于蛋白质分子构象的稳定,分子中所含的半胱氨酸形成几对二硫键,整个结构中包括多个α螺旋、β折叠及无规则卷曲,其主要通过锥面或二级棱面与冰晶表面结合。作为球状蛋白的AFP III,主要由多个β折叠组成,与冰晶的锥面和棱面发生相互作用。AFGP富含糖基,由三糖肽(-Ala-Ala-Thr-)串联而成,可分为8种亚型,AFGP1亚型分子量最大,而AFPG8亚型分子量最小,主要与冰晶的棱面相结合。HAFP是最后一类发现的鱼类抗冻蛋白,由相同亚基组成同源二聚体,空间结构呈四螺旋捆,通过锚定机制与冰晶结合[8-11]。

表1 鱼类几种抗冻蛋白的性质
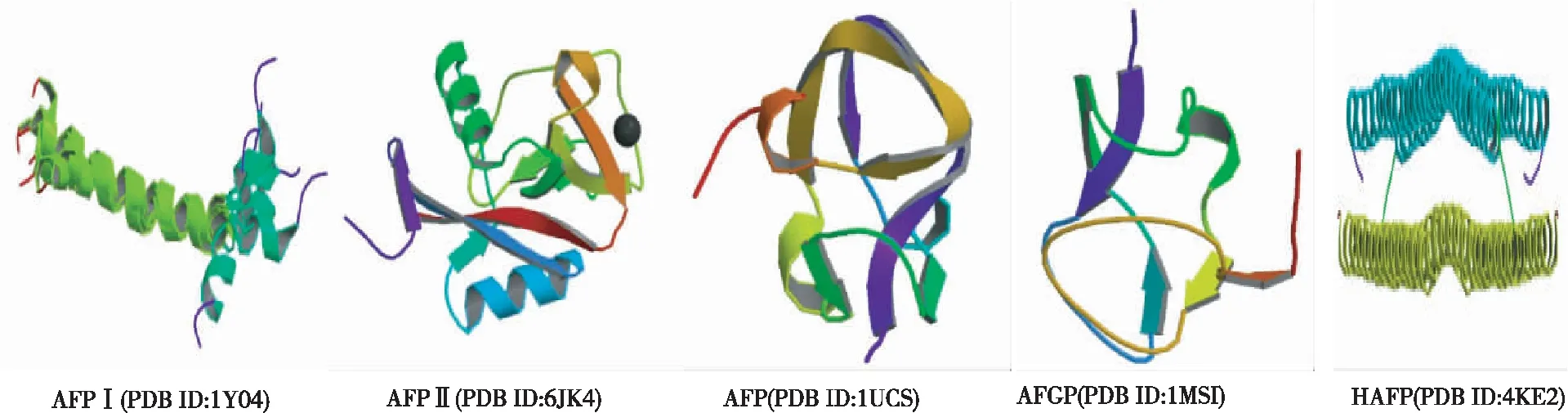
图6 鱼类几种抗冻蛋白的构象
3 讨论
目前,抗冻蛋白的基因工程表达大多是利用原核表达体系。对IPTG诱导条件优化结果表明,不同诱导温度和终浓度诱导剂(IPTG)对表达效率有影响,重组美洲锦鳚抗冻蛋白在18℃及0.1 mmol/L IPTG的诱导条件下表达水平更高。表明,较低的温度降低了蛋白质折叠速率,低浓度的IPTG降低了表达速率,尽可能避免了包涵体的生成,产生的可溶性蛋白更利于分离纯化[12-14]。此外,作为小分子蛋白质的AFP宜采用Tricine-SDS-PAGE进行分析,以弥补普通SDS-PAGE对较低分子量的蛋白质分辨率不高的缺点。当较大的冰晶以小冰晶为单位逐渐生长时,就会形成重结晶,造成组织的物理损伤,这种现象是造成细胞损伤的主要原因。通过与冰晶结合,抑制其生长和变形,并控制及阻断重结晶过程,有效减少细胞和组织的损伤[15-19]。
抗冻蛋白是一种高效的生物活性物质,因具有特殊的热滞活性已被广泛地应用在相关的农业、工业、医学、食品等领域,其在冷冻食品工业中发挥着很好的保鲜作用,BINDSLEV-JENSEN等[20]曾经对抗冻蛋白的致敏性进行研究,发现其与已知的过敏源没有同源性,且在加入抗冻蛋白之后无组胺释放,表明抗冻蛋白无致敏性,是一种比较安全的食品添加剂,应用价值潜力巨大。
4 结论
研究成功构建了美洲锦鳚抗冻蛋白的低温表达系统,通过生物信息学分析,采用邻接法(Neighbor-joining)构建了系统进化树。美洲锦鳚抗冻蛋白诱导的最佳温度为18℃,IPTG加入终浓度为0.1mmol/L。美洲锦鳚AFP与大西洋狼鱼(Anarhichaslupus)、大西洋鲱(Clupeaharengus)、鳜鱼(Sinipercachuatsi)等鱼类的亲缘关系较近,而与其他鱼类的亲缘关系较远。
