植物多酚与鲢鱼肌球蛋白相互作用及其对肌原纤维蛋白结构和凝胶形成的影响
2021-06-07裘乐芸邓泽元郑溜丰
裘乐芸,邢 倩,邓泽元,郑溜丰
(南昌大学 食品科学与技术国家重点实验室 南昌330047)
我国水域辽阔,生物资源丰富,是世界上渔业资源最丰富的国家,其中淡水鱼养殖产量占世界总产量的50%以上。近年来,鱼糜制品(包括鱼丸、鱼糕和鱼卷等)作为一类富含优质蛋白质、口感嫩爽、食用方便的低胆固醇健康食品,其产量和市场需求逐年增加,是我国水产加工产业的重点发展环节[1]。然而,鱼糜制品主要以海洋鱼类为原料,较少使用淡水鱼,主要原因是淡水鱼糜普遍存在凝胶强度差、凝胶易劣化等问题,限制了我国淡水鱼糜制品加工产业的发展。如何通过科学手段提高淡水鱼糜的凝胶特性,是现代水产品加工的重要科学问题。
加热是鱼糜制品加工的关键环节。水浴加热是我国生产鱼糜制品的传统加热方式,其热量由鱼糜外部向内部缓慢传递,导致凝胶在50~70℃停留时间过长,加剧凝胶劣化程度[2]。近年来,微波加热由于具有加热速度快、物料受热均匀以及热转换效率高等诸多优点,广泛应用于蔬菜、水果和肉制品的保鲜和深加工中[3]。与水浴加热相比,微波加热缩短了凝胶劣化的时间,肉制品表现出更好的凝胶形成和持水能力[4]。目前国内外部分研究表明微波加热代替水浴加热能够明显提高鱼糜的凝胶强度与持水能力[5]。
天然植物多酚尤其是茶多酚,因具有抗菌、抗炎、抗过敏、抗慢性病、抗癌等生理功效而受到关注,被广泛用于抑制肉制品的脂肪氧化及保鲜[6]。蛋白质变性伸展是高温诱导鱼糜凝胶形成的必要条件[7]。除作为天然抗氧化剂外,茶多酚可与蛋白质相互作用,修饰蛋白质侧链氨基酸功能基团,改变蛋白质结构及功能特性[8-9]。国外研究表明,向鱼糜中添加氧化酚类化合物或从天然产物中提取的单宁类物质,能够显著提高鱼糜凝胶的破断强度和凹陷深度[10]。EGCG 是绿茶茶多酚的主要组成成分,以微波为加热方式,添加EGCG 是否能改善淡水鱼糜的凝胶特性及其机理有待探究。
肌原纤维蛋白是肌肉的基本组成单位,其中肌球蛋白是最重要的功能蛋白,对鱼糜凝胶的形成起关键作用[11-12]。本研究通过同源建模构建鲢鱼肌球蛋白的三维结构,利用分子对接技术探究3种常见植物多酚【表没食子儿茶素没食子酸酯(EGCG)、山奈酚、槲皮素】与肌球蛋白的结合能力及位点,进一步研究EGCG 与肌球蛋白的结合对整个肌原纤维蛋白二级结构和聚集行为的影响及添加EGCG 并微波加热对肌原纤维蛋白凝胶特性的改善作用,旨在为开发具有理想凝胶特性的淡水鱼糜制品提供试验和理论依据。
1 材料与方法
1.1 材料与试剂
鲢鱼,购于南昌市江大南路农贸市场,现杀去骨后运至实验室。
绿茶提取物(EGCG 50.00%,咖啡因0.65%),陕西嘉禾生物公司;表没食子儿茶素没食子酸酯(EGCG)、二丁基羟基甲苯(BHT),郑州康本生物有限公司;BCA 蛋白浓度测定试剂盒(增强型),上海碧云天生物技术有限公司;SDS-PAGE 凝胶制备试剂盒,博士德生物工程有限公司;十二烷基硫酸钠(SDS),上海生工生物工程有限公司;三羟甲基氨基甲烷(Tris);氯化钠、氯化钾等试剂均为国产分析纯级。
1.2 设备与仪器
TDL-5-A 低速大容量离心机,上海安亭科学仪器厂;SHZ-A 水浴恒温振荡器,上海博讯实业有限公司医疗设备厂;VS-25S 手持匀浆器,无锡沃信仪器制造有限公司;DYCZ-24DN 迷你双垂直电泳仪,北京六一仪器厂;BROOKFIELD CT3 质构仪,美国博勒飞公司;凝胶成像仪1600R,上海天能科技有限公司。
1.3 试验方法
1.3.1 肌原纤维蛋白的提取 将鲢鱼的白色肌肉切碎,于碎肉机中制成肉糜。加入5 倍体积的低盐缓冲液(含0.05 mol/L NaCl 及20 mmol/L Tris-HCl,pH 7.5),12 000 r/min 匀浆3 次,每次20 s,间隔20 s,在8 000×g、4℃条件下离心10 min,取沉淀,重复3 次。在沉淀中加入5 倍体积的高盐缓冲液(含0.045 mol/L NaCl 及20 mmol/L Tris-HCl,pH 7.5),12 000 r/min 匀浆3 次,每次20 s,间隔20 s,在8 000×g、4℃条件下离心10 min,取上清液并加入去离子水,在4℃下沉淀30 min,沉淀即为肌原纤维蛋白[13]。采用BCA 试剂盒的方法测定蛋白质浓度。
1.3.2 EGCG 修饰肌原纤维蛋白 将肌原纤维蛋白沉淀配成60 mg/mL 溶液,加入不同质量的EGCG 使溶液EGCG 质量浓度分别为0.125,0.25,0.375,0.5,0.75,1 mg/mL,搅拌混匀后,25℃水浴振荡90 min[14]。振荡结束后样品于4℃下保存,3 d内使用。
1.3.3 蛋白质的SDS-PAGE 分析 采用SDSPAGE 分析EGCG 修饰前、后肌原纤维蛋白的分子质量分布。蛋白样品加入上样缓冲液后于95℃加热10 min 使蛋白变性。采用10%的分离胶及5%的浓缩胶进行凝胶电泳,电泳结束后进行考马斯亮蓝染色,脱色后使用凝胶成像仪成像。
1.3.4 水浴加热制备蛋白凝胶经EGCG 修饰后,采用两段式加热法制备肌原纤维蛋白凝胶,即低温凝胶化(40℃下水浴30 min)及高温鱼糕化(90℃下水浴30 min)。加热结束后立即在冰水浴中放置60 min 以充分形成凝胶,储存于4℃,并于1 d 内进行凝胶测试。
1.3.5 微波加热制备蛋白凝胶经EGCG 修饰后,在40℃下水浴30 min 后,微波加热60 s,使温度维持在90℃左右,功率150 W。为防止微波高温加热过度导致水分大量损失,分3 次加热,每次20 s,间隔20 s[15]。加热结束后立即在冰水浴中放置60 min 以充分形成凝胶,储存于4℃,并于1 d内进行凝胶测试。
1.3.6 凝胶的质构测定 制备的凝胶于室温平衡2 h 后,用BROOKFIELD CT3 质构分析仪测定凝胶的穿刺性能,将凝胶切成高25 mm 的小圆柱体,断面的中心置于质构仪探头的正下方样品台上,选用球形探头P/5S(直径5 mm),进行1 次压缩,测试前速度2 mm/s,测试中速度1 mm/s,测试后速度10 mm/s,压缩距离15 mm,触发力5 g,数据采集速度100 Hz。每个处理组测4 次。测试过程中的最大力即为破断强度,对应的压缩距离为凹陷深度,凝胶强度等于破断强度与凹陷深度的乘积[16]。
1.3.7 肌球蛋白的同源建模及与几种酚类化合物的分子对接
1)同源建模 由于鲢鱼肌球蛋白的三维结构是未知的,因此通过同源建模构建该蛋白的三维结构。在NCBI 上搜索鲢鱼的肌球蛋白氨基酸序列,采用同源模型服务软件SWISS-MODEL 预测该肌球蛋白的三维结构,选择相似度且评分最高的模型作为鲢鱼肌球蛋白的三维晶体结构。利用MolProbity 评价该三维结构模型的结构合理性,获得拉氏构象图[17]。
2)分子对接EGCG、山奈酚、槲皮素的分子结构从Automated Topology Builder 上下载。采用分子对接软件AutoDockTools 对肌球蛋白与小分子化合物进行对接,使用Flexible Docking 模块,计算配体与蛋白结合的活性位点及对接能,从100 次对接中选择结合能量最低且次数最多的构象作为最佳结合姿态进行分析[18]。
1.3.8 肌原纤维蛋白的红外光谱称取4 mg 左右冷冻干燥的肌原纤维蛋白样品和100 mg 溴化钾粉末,研磨至样品与溴化钾均匀。用压片机制成试片,取出试片置于红外光谱仪内。设定参数为:扫描次数32 次,分辨率4 cm-1,扫描波数范围4 000~400 cm-1,对反应体系红外光谱图的1 600~1 700 cm-1区采用傅里叶自去卷积和谱线拟合技术处理推测蛋白质二级结构的变化[19]。本文中的二级结构定量计算通过PeakFit 软件完成。
2 结果与分析
2.1 鲢鱼肌球蛋白的三维同源建模
根据鲢鱼肌球蛋白的氨基酸序列,从SWISSMODEL 上寻找到一种与其高度相似且评分最高的蛋白三维结构模型,其中序列一致性(Identity)为74.12%,覆盖率(Courage)为99%,序列相似性(Similarity)为52%,全局模型质量评估(GMQE)分数为0.52,满足同源建模的标准,依此构建的三维结构模型见图1。由图1可知,该蛋白由轻链和重链组成,这是肌球蛋白典型的结构特点。
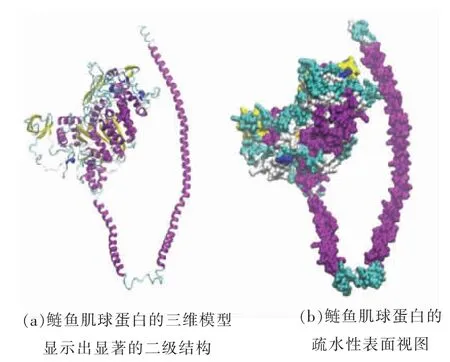
图1 鲢鱼肌球蛋白的三维结构Fig.1 Three dimensional model of the myosin from sliver carp
为进一步说明同源建模结果的合理性,通过在SWISS-MODEL 网页上查看和下载建模后的结构特征图,对肌球蛋白的三维结构进行验证。由图2a~c 可知,该三维结构模型趋于真实的蛋白质结构。此外,拉氏构象图显示,该三维结构模型有86.5%(824/953)的氨基酸位于有利区域,95.7%(912/953)的氨基酸位于可接受区域,仅有4.3%(41/953)的氨基酸位于不可接受区域(图2d),故该三维蛋白结构模型可靠,可用于后续的分子对接研究。
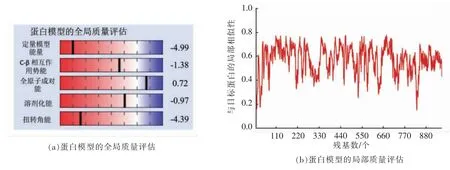
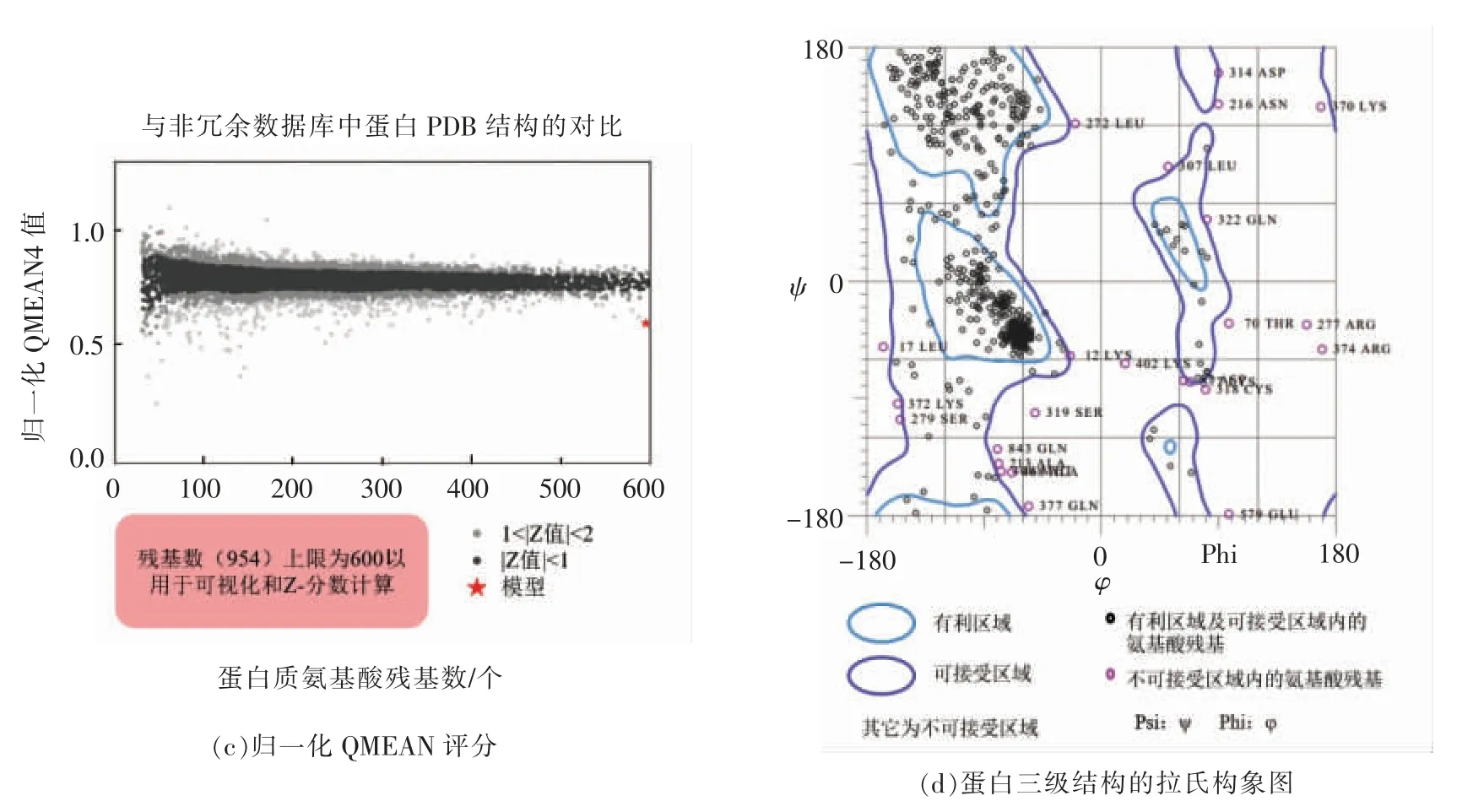
图2 鲢鱼肌球蛋白三维结构模型的质量评价Fig.2 Quality evaluation of three dimensional model of the myosin from sliver carp
2.2 植物多酚与肌球蛋白的分子对接
选择植物中含量丰富的3 种多酚(EGCG、山奈酚、槲皮素),分别下载其结构保存为PDB 格式文件,用Flexible Docking 进行分子对接试验。将酚类化合物对接入鲢鱼肌球蛋白的结合位点,结果见图3~5。由图可知,EGCG、山奈酚、槲皮素与肌球蛋白均存在较强的结合,对接能分别为-32.84 kJ/mol(-7.85 kcal/mol),-30.75 kJ/mol(-7.35 kcal/mol),-27.49 kJ/mol(-6.57 kcal/mol)。这3 种植物多酚与肌球蛋白的结合发生在同一区域,并且以氢键、疏水相互作用等非共价方式结合,其中EGCG 的结合能力最为显著(对接能量最低)。虽然山萘酚只有一个氢键作用但结合能比槲皮素大,可能是因为范德华力和疏水作用力等更强所造成的[20]。因此,选择EGCG 进行后续研究,探究其与肌球蛋白的相互作用对整个肌原纤维蛋白结构及聚集行为的影响。
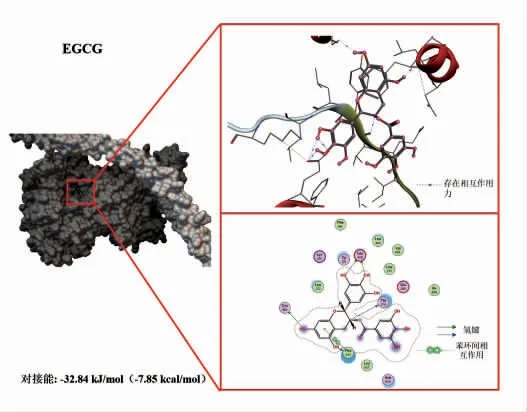
图3 EGCG 与鲢鱼肌球蛋白的分子对接结果Fig.3 Molecular docking results of EGCG with myosin from sliver carp
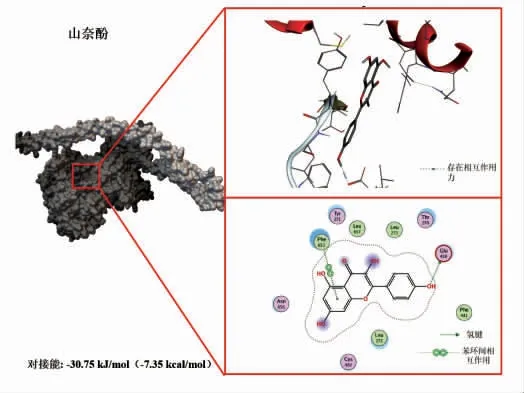
图4 山萘酚与鲢鱼肌球蛋白的分子对接结果Fig.4 Molecular docking results of kaempferol with myosin from sliver carp
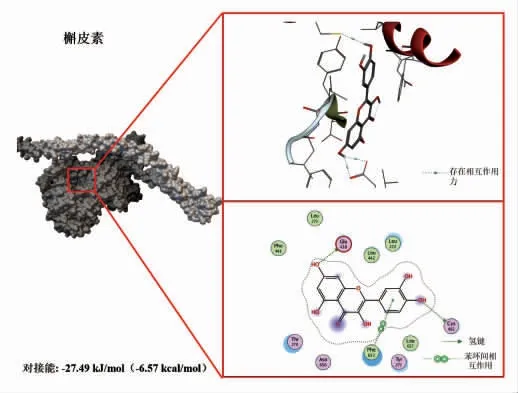
图5 槲皮素与鲢鱼肌球蛋白的分子对接结果Fig.5 Molecular docking results of quercetin with myosin from sliver carp
2.3 EGCG 修饰对鲢鱼肌原纤维蛋白二级结构的影响
茶多酚与蛋白质的相互作用被广泛关注,EGCG 是绿茶多酚中主要的功能活性成分,可通过与蛋白质形成氢键、疏水键等非共价键来影响蛋白质二级和三级结构,使蛋白质结构展开。相关研究主要集中在其对α-乳清蛋白、β-酪蛋白、β-乳球蛋白和血清白蛋白的结构和功能改性上[21-22]。肌球蛋白是肌原纤维蛋白的重要组成部分,为进一步探究EGCG 与肌球蛋白的相互作用是否影响整个肌原纤维蛋白的二级结构,通过傅里叶红外光谱对肌原纤维蛋白的二级结构进行分析,如图6所示。酰胺Ⅰ带(1 700~1 600 cm-1)主要来自C=O 和C-N 伸缩振动,其吸收峰与蛋白质二级结构对应如下:β-折叠1 610~1 640 cm-1,无规则卷曲1 640~1 650 cm-1,α-螺旋1 650~1 658 cm-1,β-转角1 660~1 695 cm-1[23]。
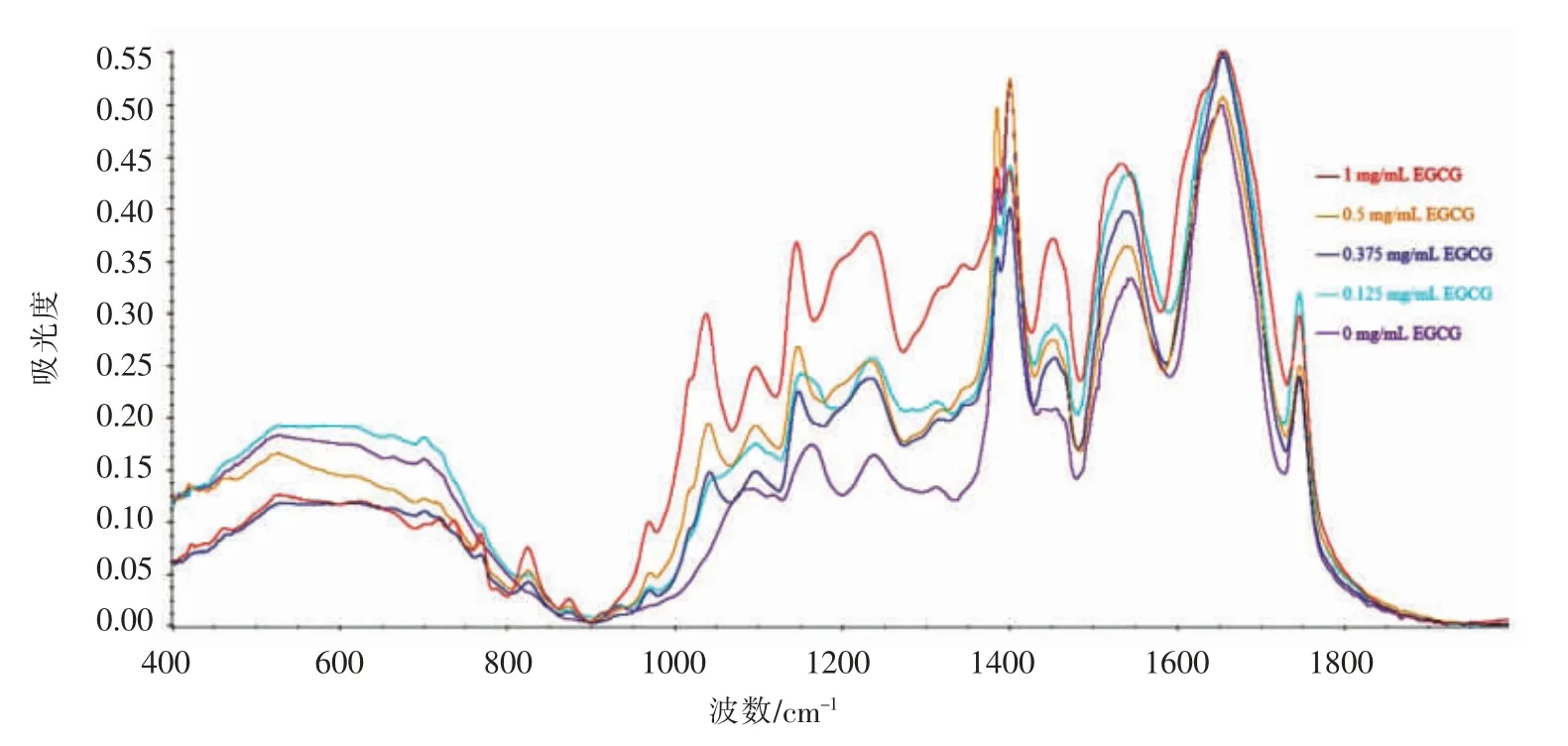
图6 不同剂量EGCG 修饰鲢鱼肌原纤维蛋白后的红外光谱Fig.6 FT-IR spectra of myofibrillar protein from sliver carp modified by different doses of EGCG
通过FTIR 分析EGCG 修饰或未修饰的肌原纤维蛋白的二级结构,结果见表1。加入EGCG 后肌原纤维蛋白的α-螺旋含量减少,β-转角和无规则卷曲含量增加,且随着质量浓度的增加呈先增大后减小的趋势,说明EGCG 的添加使肌原纤维蛋白二级结构由α-螺旋结构向无规则卷曲和β-转角结构转化,提示EGCG 与肌球蛋白结合后可能对整个肌原纤维蛋白的二级结构有显著影响。β-转角和无规则卷曲的形成有利于后续高温诱导蛋白质相互交联,增大鱼糜的凝胶强度[24]。此外,除非共价相互作用外,酚类化合物还可通过共价相互作用的方式与蛋白质发生结合[25]。在高温条件下,植物多酚易被氧化形成醌类物质,其作为一种亲电子物质极易进一步与蛋白质肽链的末端氨基以及赖氨酸、组氨酸、色氨酸、酪氨酸、半胱氨酸和蛋氨酸的游离氨基或巯基等共价结合[26],而这些氨基酸在淡水鱼肉中含量丰富[27],提示植物多酚在高温下易与淡水鱼肌原纤维蛋白发生高程度的共价结合,从而促使蛋白凝胶网络的形成。
2.4 EGCG 修饰对鲢鱼肌原纤维蛋白聚集行为的影响
蛋白质变性伸展有利于其聚集形成网络结构,图7是用EGCG 修饰前、后的鲢鱼肌原纤维蛋白的SDS-PAGE 电泳图。对于肌原纤维蛋白原液,在220 ku 附近的明显条带为肌球蛋白重链(Myosin heavy chain,MHC),在45 ku 附近的明显条带为肌动蛋白(Actin,AC),而在18~22 ku 附近的明显条带为肌球蛋白轻链(Myosin light chain,MLC)。未添加多酚但经过修饰过程的对照组(C组)与蛋白原液相比(M 组),蛋白条带并没有显著差异。而TP 组和EGCG 组肌原纤维蛋白中MHC、AC、MLC 蛋白明显减少,且在40 ku 和100 ku 附近有新的不连续条带生成,说明含量减少的蛋白发生了聚集。
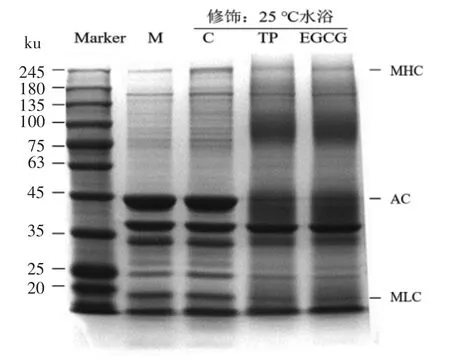
图7 茶多酚和EGCG 修饰肌原纤维蛋白前、后的SDS-PAGE 电泳图Fig.7 Electrophoresis patterns of myofibrillar protein from sliver carp before or after modification of tea polyphenols and EGCG
2.5 添加EGCG 对鲢鱼肌原纤维蛋白凝胶特性的影响
为了更好地将EGCG 应用于鱼糜制品实际生产中,进一步探究添加EGCG 对高温诱导鲢鱼肌原纤维蛋白凝胶形成的影响。采用水浴或微波高温加热的方式制备鲢鱼肌原纤维蛋白凝胶,其凝胶特性的结果见表2。与水浴加热相比,微波加热显著提高了凝胶的破断强度、凹陷深度及凝胶强度(P<0.05)。在一项关于深海鱼的研究中也发现了微波加热可以显著提高蛋白质的凝胶强度[28]。微波加热能显著改善鱼糜凝胶特性的可能原因是:鱼糜在加热过程中温度迅速升高且受热均匀,减少了50~70℃时鱼糜的凝胶劣化。因此,微波加热下鱼糜吸收相同或较少能量,能获得较高的凝胶强度,优于水浴加热[29]。在采用微波加热方式制备凝胶的基础上,添加0.125~1 mg/mL EGCG 均能进一步显著改善肌原纤维蛋白的凝胶特性,且这种改善作用在添加量为0.5 mg/mL 时达到最大,其凹陷深度和凝胶强度分别增加了59.9%和89.8%,而添加高剂量的EGCG(1 mg/mL)反而降低了肌原纤维蛋白的凝胶特性。适量的EGCG 修饰对肌原纤维蛋白凝胶的改善作用可能与其通过酚羟基与蛋白质上的赖氨酰、半胱氨酰等氨基酸残基的交联密切相关[30]。
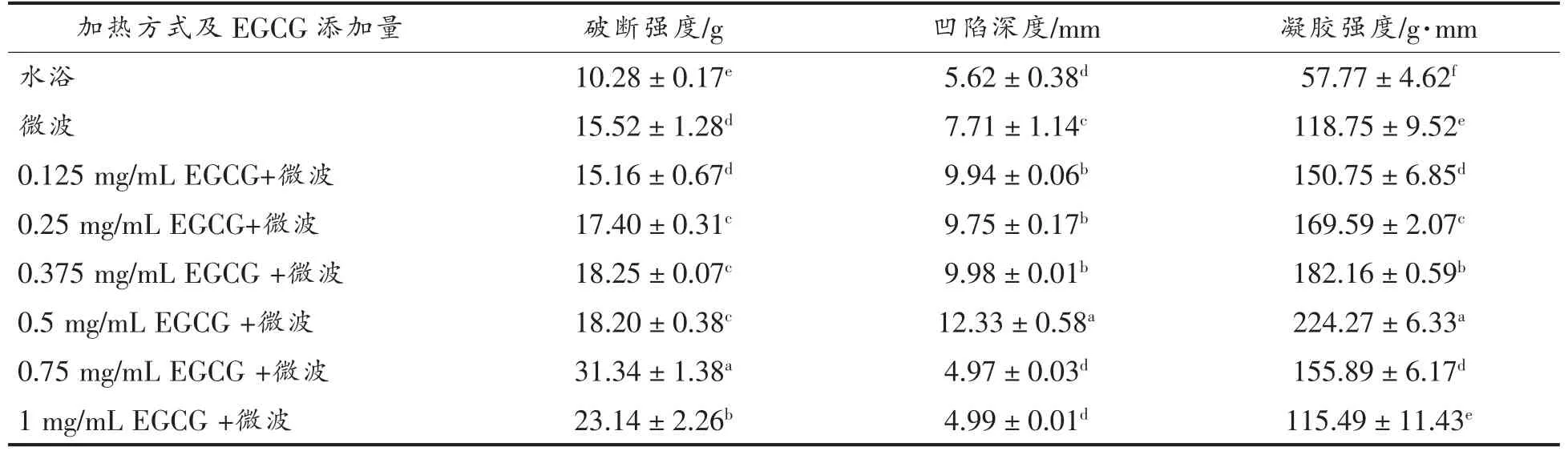
表2 不同加热方式及添加EGCG 对鲢鱼肌原纤维蛋白凝胶特性的影响Table 2 Effects of different heating methods and addition of tea polyphenols on gel properties of myofibrillar protein from sliver carp
植物多酚已被证明能通过抗氧化作用提高蛋白质的凝胶特性[31-32]。添加人工合成抗氧化剂BHT对微波诱导的鱼糜蛋白凝胶形成的影响如图8所示。添加0.5~2 mg/mL 的BHT 并不影响肌原纤维蛋白的凝胶强度。另外,利用分子对接技术也发现BHT 不能与肌球蛋白分子对接上,表明两者间无法发生结合,推测植物多酚对肌原纤维蛋白凝胶特性的改善很可能不依赖于其抗氧化作用,而与其和肌球蛋白相互作用引起蛋白结构的改变密切相关。

图8 添加不同质量分数BHT 对鲢鱼肌原纤维蛋白凝胶强度的影响Fig.8 Effects of supplementation with different mass fraction of BHT on gel strength of myofibrillar protein from sliver carp
3 结论
试验选取的3 种植物多酚(EGCG、山奈酚、槲皮素)均能与鲢鱼肌球蛋白的同一区域发生较强的结合,并且结合方式为氢键、疏水相互作用等非共价键,其中EGCG 与蛋白的结合能力最强。EGCG 与肌球蛋白的相互作用能引起整个肌原纤维蛋白二级结构的改变,具体表现为α-螺旋含量降低,β-转角及无规则卷曲含量增加,蛋白结构变得松散,有利于蛋白质之间发生聚集及凝胶的形成。添加0.125~1 mg/mL EGCG 并微波高温加热可以改善鲢鱼肌原纤维蛋白的凝胶特性,且改善作用在添加量为0.5 mg/mL 时达到最大。
