细胞壁缺失对副溶血性弧菌生物学特性的影响
2021-06-07刘雪飞吴思楠李秀霞牟伟丽郭晓华李学鹏励建荣
刘雪飞,吴思楠,李秀霞,谢 晶,牟伟丽,郭晓华,李学鹏*,励建荣
(1 渤海大学食品科学与工程学院 辽宁省食品安全重点实验室生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州121013 2 上海海洋大学食品学院 上海201306 3 蓬莱京鲁渔业有限公司 山东烟台265600 4 山东美佳集团有限公司 山东日照276800)
副溶血性弧菌(Vibrio parahaemolyticus)是一种嗜盐性弧菌,属于革兰氏阴性短杆菌,该菌大多存在于近海岸的贝类和海水鱼类等水产品中,有时也会出现在腌渍食品中,是世界上沿海地区引起食物中毒主要的食源性致病菌之一[1]。据估计,每年约有7 600 万人患病,5 000 人死于食源性疾病,其中很大一部分归因于沙门氏菌和副溶血性弧菌[2]。副溶血性弧菌最早是在1950年日本的一次由沙丁鱼引起的大规模食物中毒事件中发现的[3],之后逐渐在各国的沿海地区发现,并持续至今,已超过沙门氏菌成为世界食源性致病菌之首[4]。其感染途径主要是食用未完全煮熟的海鲜类食品,进而导致急性胃肠炎,甚至会使人死亡[5]。同时,副溶血性弧菌也是水生动物弧菌病爆发的病原体,给水产养殖业带来巨大的经济损失。深入研究副溶血性弧菌的防控技术,对促进水产品的食用安全和海洋经济发展具有双重意义。
由于在临床治疗和水产养殖系统中广泛使用抗菌剂,副溶血性弧菌中耐药株的流行日益加剧,50%的临床和环境分离株具有耐多药性[6]。自1968年喹诺酮类药物问世以来,临床上一直未引入有效对抗革兰氏阴性菌的新型抗生素[7]。细菌对现有抗生素已进化出多种对抗机制,如通过主动外排系统增强药物的外排作用,产生β-内酰胺酶使药物失去活性,或将药物作用的靶点加以修饰或改变等等[8],急需寻找具有新的作用位点且安全有效的替代防治策略。
革兰氏阴性菌之所以很难找到有效的抑制药物,主要是因为其细胞的包膜结构较复杂,具有双层膜结构(位于内侧的细胞质膜称为内膜,细胞壁最外层的膜称为外膜),在两层膜间为肽聚糖层,与外膜共同构成细胞壁。外膜是革兰氏阴性菌的特有构造,具有典型的不对称性磷脂双层结构,由脂多糖、磷脂和外膜蛋白构成。一直以来,细胞与外界环境的物质交换部位主要关注的是细胞质膜,近10年间研究人员才开始关注外膜,尤其是外膜蛋白在物质穿膜过程中的作用[9]。外膜蛋白包括连接外膜层与肽聚糖层的脂蛋白(Lipoprotein)和跨外膜的孔蛋白(Porin)。单体孔蛋白由8~22 个偶数跨膜链以反向平行方式通过相邻链间的氢键作用形成β-桶状结构。跨膜链的数量决定孔蛋白的拓扑结构,从而导致孔径的不同[10]。孔蛋白可以选择性地吸收各种营养物质,同时也能阻拦多种有害大分子物质进入细胞[11]。在去掉细胞壁的大肠杆菌原生质体中,胞内高积累化合物与胞内低积累化合物之间的积累差异明显变小,这一结果证实外膜是小分子在革兰氏阴性菌中化合物积累的主要障碍[7]。吴贤斌等[12]曾将大肠杆菌外膜孔蛋白OmpW 去除,发现缺失株对硫酸新霉素和氨苄青霉素的敏感性明显增加。与亲本株相比,在大肠杆菌孔蛋白OmpF/OmpC 缺失株中观察到高积累药物积累量显著降低,说明小分子穿过外膜主要通过孔蛋白[7]。以上研究结果均显示,细胞壁尤其是外膜对于革兰氏阴性菌的生存是必不可少的,而去除细胞壁或是外膜对于革兰氏阴性菌可能是致命的。
肉桂醇是我国《食品添加剂使用卫生标准》中允许使用的食品香料,被证实对革兰氏阳性菌和阴性菌均有抑菌效果[13]。Mazzarrino 等[14]针对肠炎沙门氏菌和单增李斯特菌筛选出21 种有抑菌活性的精油,发现肉桂的抑菌效果是有效的。目前关于肉桂醇对副溶血性弧菌的抑制作用及机理的研究尚未见报道,本文采用肉桂醇作为抑菌剂探究细胞壁的缺失对副溶血性弧菌生物学特性的影响,明确肉桂醇的作用靶点,为副溶血性弧菌的防控提供试验依据。
1 材料与方法
1.1 菌株、培养基和试剂
副溶血性弧菌(V.parahaemolyticus ATCC17802)保存于-80℃超低温冰箱中。
3%氯化钠碱性蛋白胨水(APW)、营养琼脂,北京奥博星生物技术有限责任公司。以上培养基均121℃灭菌20 min。
肉桂醇、Tris、EDTA、硫酸粘杆菌素、十二烷基肌氨酸钠(SLS)、SYBR Green I、PI,生工生物工程(上海)股份有限公司;溶菌酶、马来酸盐,合肥博美生物科技有限责任公司;考马斯亮蓝G-250,天津市福晨化学试剂厂;蔗糖、氯化镁、磷酸二氢钾、乙醇,天津市天力化学试剂有限公司;磷酸、氢氧化钠、无水碳酸钠、氯化钠、碳酸氢钠,天津市风船化学试剂科技有限公司;常用药敏试纸,杭州滨和微生物试剂有限公司;牛血清蛋白,北京索莱宝科技有限公司。
1.2 仪器、设备
ZD-85A 气浴恒温振荡器,金坛市科析仪器有限公司;真空干燥箱,上海一恒科学仪器有限公司;GI54DS 型自动蒸汽压力灭菌锅,厦门致徽仪器有限公司;5804R 高速冷冻离心机,Eppendorf中国有限公司;Czone5F 自动菌落计数仪,杭州迅数科技有限公司;perkin elmer v3 酶标仪,成都必成丰瑞生物技术有限公司;UV-2550 紫外-可见分光光度计,日本岛津公司;Scientz-IID 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;SDS 电泳系统、Gel Doc XR+凝胶成像仪,美国BIORAD 有限公司;Accuri C6 Plus 流式细胞仪,BD生物科学北京卓越中心。
1.3 试验方法
1.3.1 菌体活化及原生质体制备 将副溶血性弧菌按1%的接种量加入APW 中,37℃、130 r/min培养12 h,连续培养2 代。
参考Xu 等[15]的方法制备副溶血性弧菌原生质体。将活化的菌液置于4℃、6 000 r/min 离心收集菌体细胞。用0.01 mol/L Tris-Hcl(pH 7.0)洗涤3 次,细胞重悬于含有0.5 mol/L 蔗糖的0.01 mol/L Tris-Hcl(pH 7.0)中,缓慢加入EDTA 溶液(pH 8.0,20 min 之内完成此步)至其终浓度为0.01 mol/L。37℃、100 r/min 振荡20 min,获得一组除去外膜层的细菌细胞(Outer membrane deficient group,OMDG),留此阶段部分菌体冷藏备用。另一部分菌体在4℃、3 000 r/min 离心收集细胞,用SMM 缓冲剂(20 mmol/L 马来酸盐、0.5 mol/L 蔗糖、20 mmol/L MgCl2,pH 6.5)清洗2 次,细胞重悬于SMM 缓冲剂(含1 mg/mL 溶菌酶)中,37℃、100 r/min 振荡30 min,除去肽聚糖层,缓慢滴加EDTA溶液(pH 8.0)使其终浓度为0.01 mol/L,放入37℃的培养箱温育15 min,获得一组去壁的细菌细胞(Cell wall deficient group,CWDG),将此原生质体冷藏备用。未处理的菌体(Untreated group,UG)同样冷藏备用。
1.3.2 最小抑菌浓度测定 采用二倍稀释法处理肉桂醇原液(质量浓度为1 g/mL),使其质量浓度依次为原液的1/2 至1/2048。试管内物质组成为8.9 mL APW、1 mL 菌液(分别为UG、OMDG 和CWDG)和0.1 mL 不同质量浓度的肉桂醇溶液。所有试管置于37℃培养24 h 后观察菌体生长情况,使培养液保持澄清的最小药物质量浓度即为肉桂醇对副溶血性弧菌的最小抑菌浓度(MIC)。
1.3.3 细胞膜完整性测定 参考张赟彬等[16]的方法,将菌悬液在4℃、3 000 r/min 条件下离心15 min 收集菌体,磷酸缓冲液(pH 7.0)清洗并重悬。向新的离心管中加入10 mL 菌悬液和45 μL 肉桂醇(1/4 MIC、1/2 MIC、MIC、空白),37℃培养6 h,在6 000 r/min 下离心3 min 收集上清液。在波长260 nm 处测定其吸光度值,即为菌液中核酸的含量。同时采用考马斯亮蓝法对上清液中的蛋白质进行染色,测定其在波长280 nm 处的吸光度值,即为菌液中蛋白质的含量。
1.3.4 硫酸粘杆菌素试验参考Richter 等[7]的方法并适当修改,先向96 孔板每孔中加入20 μL 硫酸粘杆菌素溶液(6 μmol/L)和178 μL 稀释好的菌悬液,静置30 min,再加入不同质量浓度的肉桂醇(1/4 MIC、1/2 MIC、MIC、空白)2 μL,混匀并置于37℃培养18~24 h 后用酶标仪测定其在波长280 nm 处的吸光度值。
1.3.5 外膜蛋白的提取及质量浓度测定 参考Chiu 等[17]的方法进行外膜蛋白的提取,并稍作修改。在4 000 r/min、4℃条件下收集细胞,经4℃生理盐水洗涤3 次,重悬于少量体积的盐水中,利用超声波细胞粉碎机进行细胞破碎处理(300 W、冰浴5 min),间歇10 次完成。在5 000 r/min、4℃条件下离心20 min,收集上清;于15 000 r/min 离心40 min,沉淀重悬于2 g/100 mL SLS 中并在室温条件下孵育1 h 后,于15 000 r/min 离心40 min,沉淀即为外膜蛋白。
利用考马斯亮蓝法(Bradford 法)[18]测定获得的外膜蛋白质量浓度。首先利用标准蛋白溶液绘制标准曲线,如图1所示。测定波长595 nm 处外膜蛋白样品的吸光度值,根据标准曲线公式计算出外膜蛋白的质量浓度。
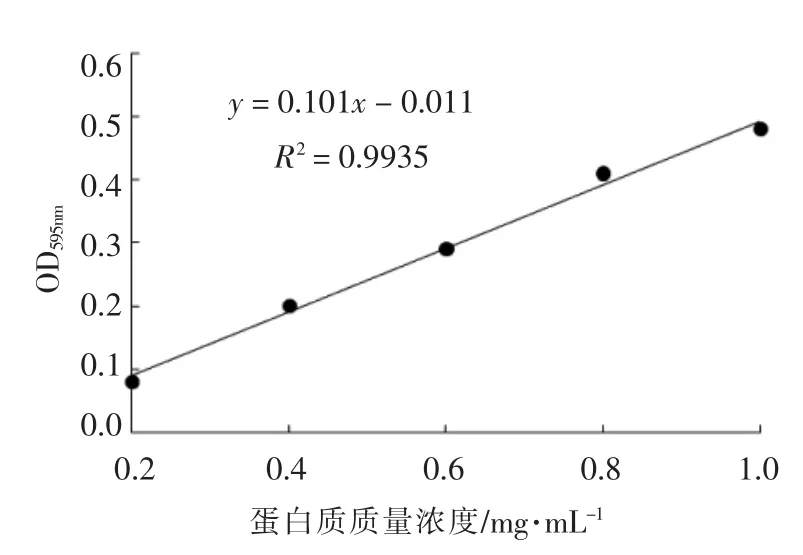
图1 牛血清蛋白标准曲线Fig.1 Bovine serum albumin standard curve
1.3.6 外膜蛋白SDS-PAGE 采用非连续缓冲系统垂直板电泳,选用12%分离胶,5%浓缩胶。外膜蛋白样品沸水浴5 min,加样量为20 μL【16 μL 蛋白溶液+4 μL(5×)蛋白上样缓冲液】,80 V 电压进行样品浓缩,样品进入分离胶后加压至120 V,当溴酚蓝即将跑出胶板时,停止电泳。胶板考马斯亮蓝染色后置于凝胶成像系统拍照。
1.3.7 外膜蛋白竞争试验参考Lam 等[19]的方法进行外膜蛋白竞争试验,并作一定的改动。将50 μL 肉桂醇、50 μL 外膜蛋白(质量浓度在2~512 μg/mL)加入96 孔板中,37℃下孵育1 h。之后向每孔中加入100 μL 副溶血性弧菌悬液(约2.5×106个/mL,使肉桂醇终质量浓度为1/2 MIC),37℃下孵育2 h。各孔中取出50 μL 混合培养液,转移至第2 个96 孔板中,并加入100 μL 盐水和染料混合物(即含有0.1% SYBR Green I 和0.1%PI 的盐水),用流式细胞仪分析第2 个96 孔板中的各孔,确定细胞凋亡情况。
1.3.8 药敏试验 参考李莉等[20]的方法,向100 mL 营养琼脂培养基中分别加入500 μL 处理好的菌液(包括UG、OMDG、CWDG),混匀后倒平板,待培养基凝固后向每个平板中放入3 片相同的药敏试纸(包括四环素、红霉素、万古霉素、环丙沙星、利福平),所有平板置于37℃培养18~24 h,测量抑菌圈直径。
1.3.9 统计分析数据处理采用Excel 2010 并绘制图表,利用SPSS 19.0 对所有数据进行差异显著性分析,所有试验均重复测定3 次,测定结果表示为平均数±标准差。
2 结果与分析
2.1 细胞壁缺失对副溶血性弧菌最小抑菌浓度的影响
在确定肉桂醇对副溶血性弧菌有抑菌活性基础之上,采用二倍稀释法测定3 组副溶血性弧菌(包括UG、OMDG、CWDG)的MIC,结果见表1,细胞壁缺失可以改变副溶血性弧菌对抑菌剂的敏感性。肉桂醇对UG、OMDG 和CWDG 的MIC 分别为原液质量浓度的1/32、1/256 和1/256。由该结果可知,丢失外膜层使菌体对肉桂醇的敏感程度增加,而进一步丢失肽聚糖层未改变菌体对肉桂醇的敏感程度,说明外膜是肉桂醇抑制副溶血性弧菌的主要作用位点。彭志峰等[21]曾对比土霉素和四环素对鸭源鸡杆菌亲本株RU 和外膜孔蛋白OmpW突变株ΔOmpW 的MIC,结果显示,ΔOmpW 的MIC 值分别降低到RU 的1/8 和1/32,与本试验结果一致。以上结果说明,外膜孔蛋白是外膜层中抑菌剂作用的靶点。
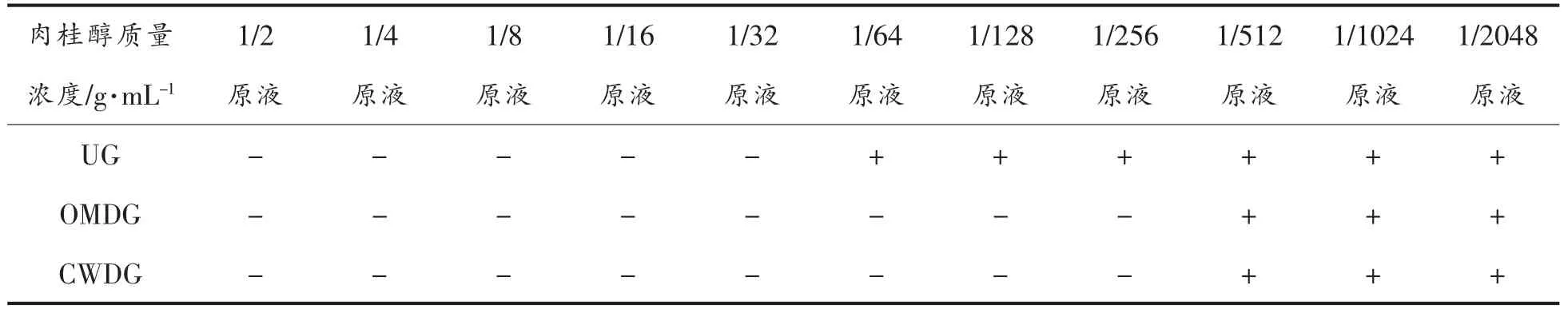
表1 细胞壁缺失对副溶血性弧菌最小抑菌浓度的影响Table 1 Effects of cell wall deletion on the minimum inhibitory concentration of V.parahaemolyticus
2.2 细胞壁缺失对副溶血性弧菌细胞膜完整性的影响
核酸和蛋白质均是菌体重要的单位结构物质,在核酸和蛋白质的特征吸收波长处菌液吸光度值增大时,说明二者发生了外渗,表明细胞膜完整性遭受破坏[22]。从表2中可以看出,通过不同质量浓度的肉桂醇处理后,3 组副溶血性弧菌的细胞膜均受到不同程度的破坏,并且随着肉桂醇质量浓度的增加,受到的破坏也越大,说明肉桂醇会作用于细菌细胞膜。当肉桂醇质量浓度低至1/4 MIC 时,对3 组副溶血性弧菌的抑制作用已经减弱,与空白组的细胞膜受损程度相近。相较于UG,OMDG 和CWDG 菌液中特征性吸光度值无显著差异(P<0.05),表明进一步的去除肽聚糖层对细胞膜的完整性无影响,即细胞壁中外膜层是菌体抵抗抑菌剂的主要结构,对细胞膜的损伤有保护作用。
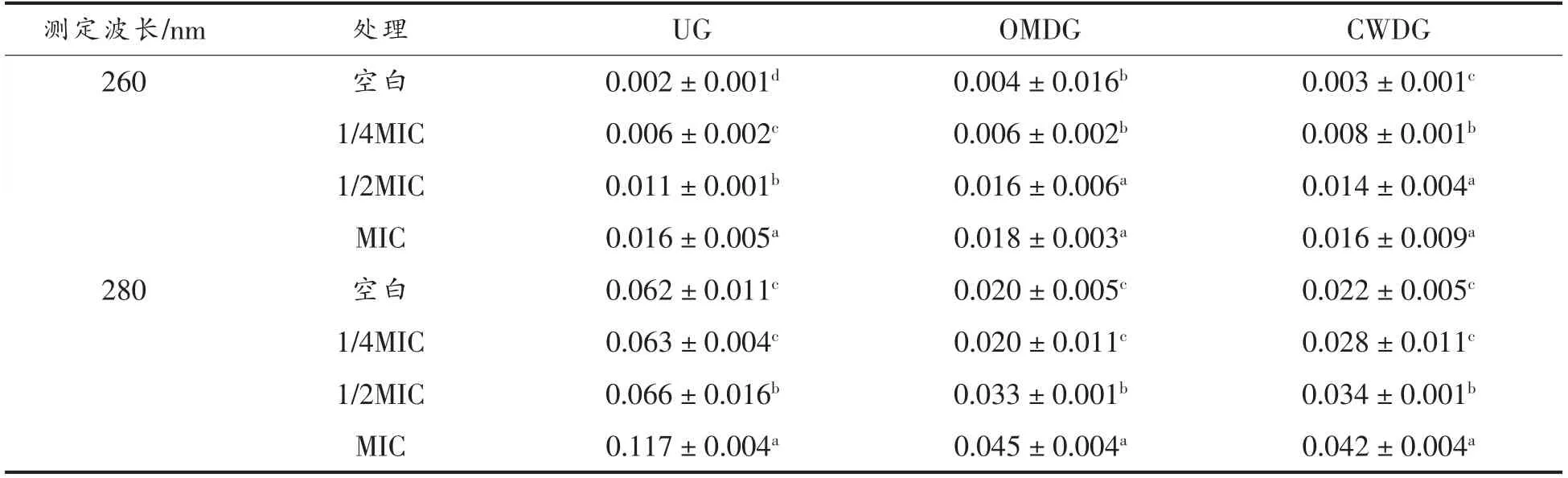
表2 细胞壁缺失对副溶血性弧菌细胞膜完整性的影响Table 2 Effects of cell wall deletion on cell membrane integrity of V.parahaemolyticus
2.3 内膜通透性对肉桂醇抑菌性能的影响
硫酸粘杆菌素是一种窄谱抗生素,对革兰氏阴性菌有很强的抑菌作用。它先与外膜层中的脂多糖结合,破坏外膜通透性,进而与细胞膜上脂蛋白结合,使细胞膜的通透性增加、表面张力降低,导致胞内的重要物质外渗,严重时引起菌体死亡[23]。由表3可知,在UG 中,肉桂醇质量浓度越低,菌体受到的破坏越小,内容物渗出越少,OD 值就越小;在OMDG 和CWDG 中,由于外膜层已被去除,细胞膜被硫酸粘杆菌素破坏,导致加入的肉桂醇已经没有可以作用的部位,因此肉桂醇质量浓度的变化对结果无影响,故肉桂醇可能对外膜和细胞膜都有作用。
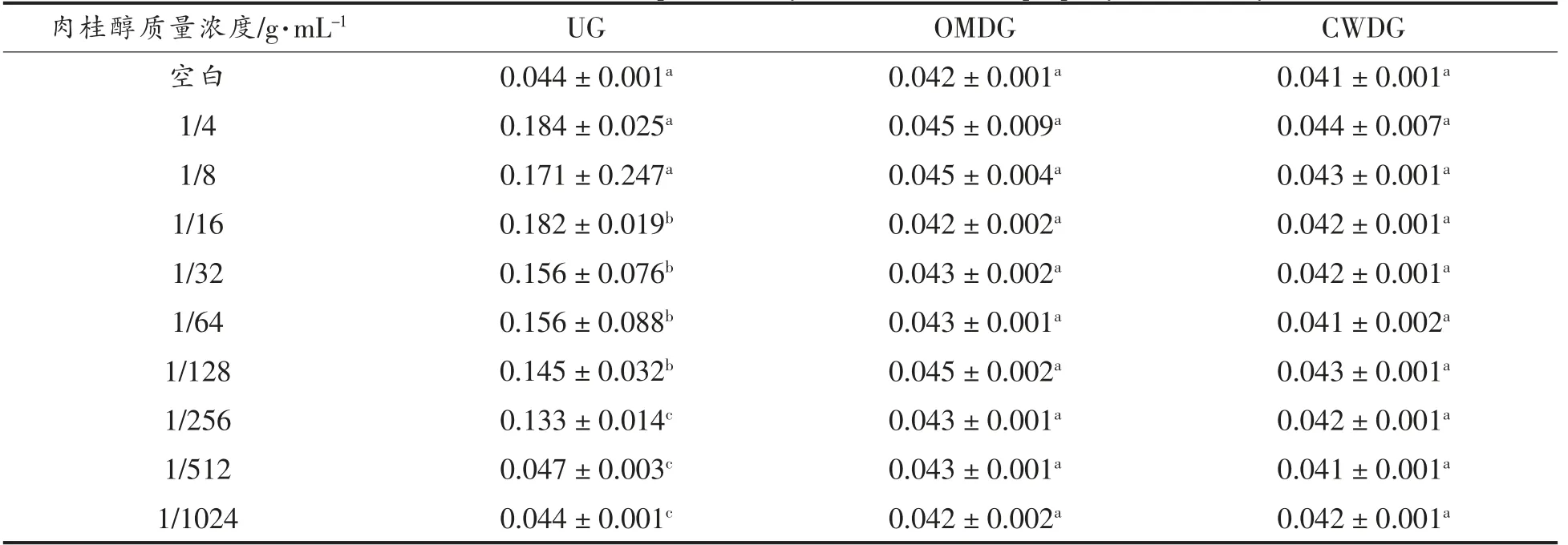
表3 内膜通透性对肉桂醇抑菌性能的影响Table 3 Effects of inner membrane permeability on antibacterial property of cinnamyl alcohol
2.4 外膜蛋白SDS-PAGE
将从试验菌株副溶血性弧菌ATCC17802 中提取的外膜蛋白进行SDS-PAGE 试验,结果见图3。共获得10 条蛋白条带,其分子质量大小在18.4~66.2 ku 之间,与之前文献报道的副溶血性弧菌外膜蛋白分子量范围相符[24]。
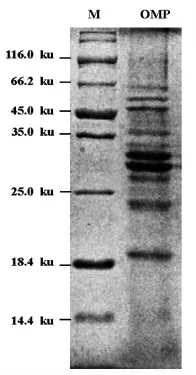
图2 副溶血性弧菌外膜蛋白SDS-PAGE 图谱Fig.2 SDS-PAGE electrophoretogram of outer membrane proteins of V.parahemolyticus
2.5 外膜蛋白竞争试验
竞争试验主要是用来判断肉桂醇的作用位点是否为外膜层中的外膜蛋白。由图1计算出提取的外膜蛋白样品的质量浓度为512 μg/mL,满足竞争试验中对外膜蛋白的浓度要求。将副溶血性弧菌的外膜蛋白与1/2 MIC 肉桂醇互混1 h 后再与菌体细胞共培养,外膜蛋白以剂量依赖方式减小肉桂醇对菌体细胞的损伤作用(图3),这说明肉桂醇能与外膜蛋白产生相互作用,故菌体无法被PI 染色,凋亡图中总凋亡率随外膜蛋白质量浓度的增大而降低。
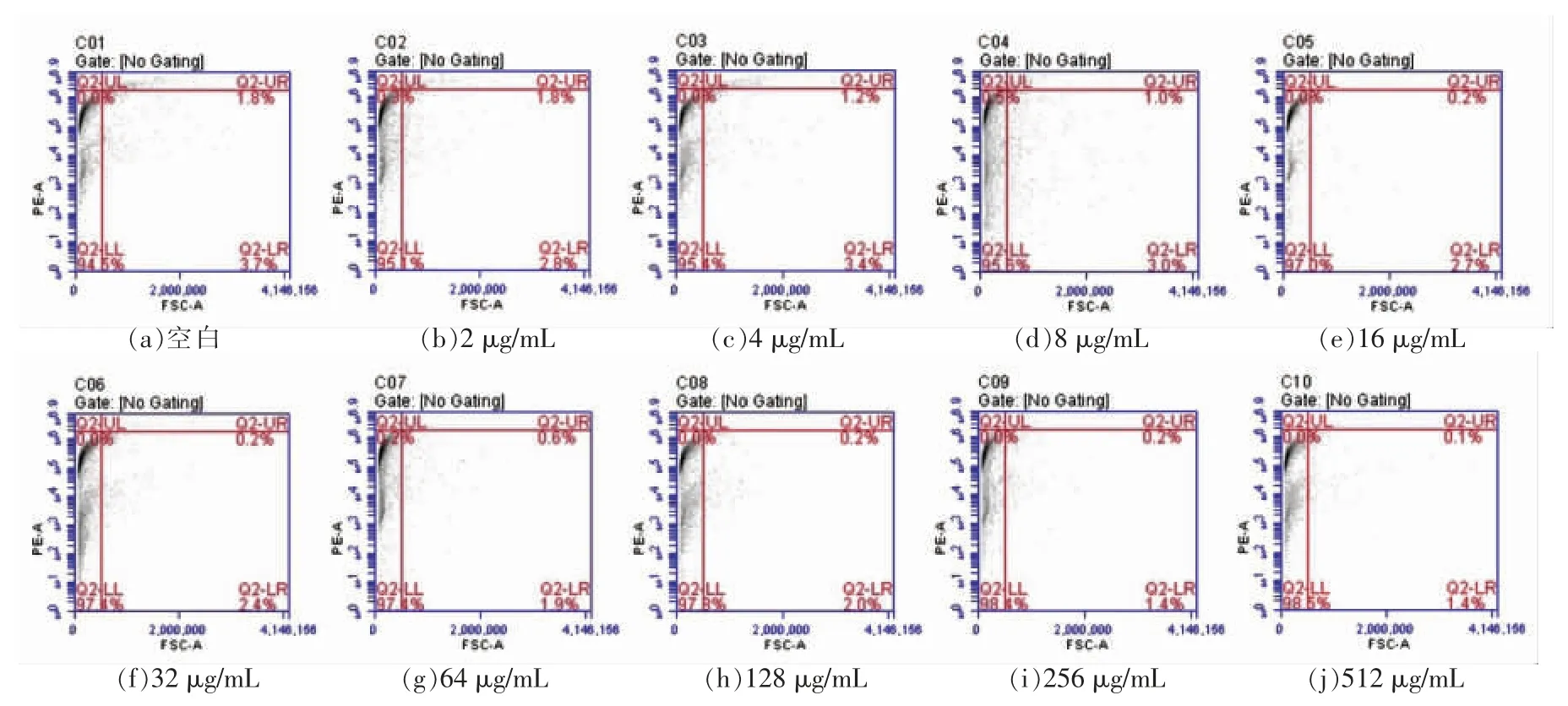
图3 副溶血性弧菌凋亡图Fig.3 Apoptosis diagram of V.parahaemolyticus
2.6 细胞壁缺失对副溶血性弧菌药物敏感性的影响
细胞壁缺失对副溶血性弧菌药物敏感性的影响见表4。抗生素在抑菌过程中作用的靶点不尽相同,四环素和红霉素能抑制蛋白质的合成,万古霉素能抑制细胞壁的合成,环丙沙星能抑制DNA的合成和复制,利福平能抑制RNA 的合成[25]。所测抗生素对UG 均有效,作用于细胞壁的万古霉素对OMDG 和CWDG 无效,说明处理的菌体缺失了其作用靶点。然而,利福平在接触OMDG 细胞时药效下降,这可能是因为外膜尤其是外膜蛋白是利福平进入菌体的通道,而在接触CWDG 细胞时药效丢失,可能肽聚糖层也在该药进入细胞过程中起到一定作用,具体机制有待进一步研究。
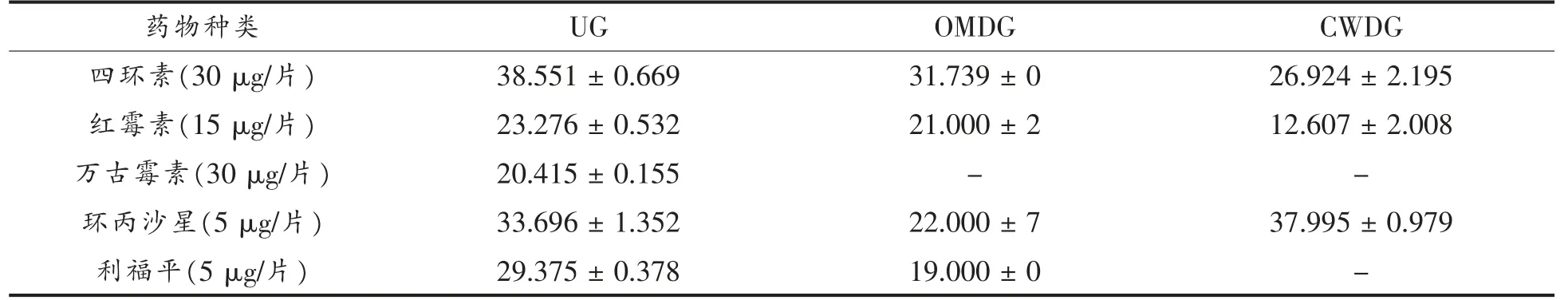
表4 细胞壁缺失对副溶血性弧菌药物敏感性的影响(mm)Table 4 Effects of cell wall deletion on drug sensitivity of V.parahaemolyticus(mm)
3 结论
结果表明,肉桂醇对各种状态的副溶血性弧菌均有抑菌作用。在此基础上初步研究了肉桂醇对副溶血性弧菌的作用靶点,发现肉桂醇首先作用于外膜蛋白,之后引起细胞膜损伤,导致细胞内容物外渗,从而使副溶血性弧菌的生长受到抑制。细胞壁尤其是外膜对于革兰氏阴性菌的生存至关重要,可以阻断多种有害物质进入菌体。当环境中外膜蛋白的浓度降低时,副溶血性弧菌对肉桂醇的抗性降低,外膜蛋白可以作为抑菌剂开发的新靶点。
