间充质干细胞移植改善脑室周围白质软化损伤作用的研究*
2021-06-07巴依尔才次克王彦梅朱艳萍
巴依尔才次克 王彦梅 朱艳萍
(新疆医科大学第一附属医院新生儿科,乌鲁木齐 830054)
医学的进步使得早产儿的存活率取得了极大的增长,但早产儿仍然存在诸多并发症。脑室周围白质软化(periventricular leukomalacia,PVL)是胎儿早产的并发症之一,会对中枢神经系统的结构和功能造成不可逆的损伤,严重影响患儿的认知等中枢功能,然而此类疾病多预后不佳,且目前尚无有效的治疗方法[1]。
脑室周围白质梗死、软化的病因,可能与胎儿低血压、脑血流灌注不足、不稳定等因素有关。早产儿中枢系统中的少突胶质细胞(oligodendrocyte,OLs)及少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)对缺血十分敏感。Chung等[2]研究显示,PVL病理损伤过程中,OPC的增殖、分化受阻,同时OLs发生凋亡,进而髓鞘再生障碍,同时还伴随有胶质细胞的炎性激活。因此,有效抑制早产儿中枢系统中OLs的凋亡,促进OPC的增殖和分化,是治疗PVL的重要思路之一。
神经干细胞在脑损伤后能迅速增殖分化形成OPCs及星形胶质细胞等,对损伤髓鞘进行吞噬,并形成新的髓鞘,产生修复作用[3]。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)是一种多能干细胞,具有在一定条件下分化成神经干细胞的潜质。基于以上事实,本研究旨在探究hUC-MSCs可否用来恢复少突胶质细胞及其前体细胞的功能,进而修复髓鞘损伤。并进一步研究hUC-MSC产生修复作用同时对自身神经干细胞的影响。
1 材料与方法
1.1 主要试剂耗材及设备
7 日龄健康清洁级SD大鼠,体质量(18±2)g,购自新疆医科大学动物实验研究中心,实验动物合格证号:No:11400730598260)。FITC-CD73、FITC-CD90、PE-CD105购自eBioscience;RFP慢病毒(上海吉玛制药技术有限公司);苏木素-伊红(珠海贝索生物技术有限公司);TUNEL检测液(Roche);嘌呤霉素、BrdU(Sigma);Caspase-1抗体、Bcl-2抗体(Santa Cruz);流式细胞仪(BD calibur);三气培养箱(Thermo);异戊烷、脑立体定位仪(上海玉研科学仪器有限公司);冰冻切片机(Leica);正置显微镜、荧光显微镜(尼康)。
1.2 hUC-MSC细胞获取
获取健康SD大鼠新生儿脐带后,DMEM/F12保存送至实验室。PBS清洗后剪碎,0.1%胶原酶Ⅰ和0.125%胰酶,37 ℃消化30 min,100目滤网过滤后在混有10% FBS 和1%青霉素、链霉素双抗的DMEM/F12培养基中,种瓶培养。传代2次后,取部分细胞,用流式细胞术进行鉴定。在PBS重悬的细胞中,分别加入CD73、CD90和CD105抗体,4 ℃避光孵育20 min后PBS洗净,并上机流式细胞仪进行检测。
将细胞在1×106个/mL的浓度下用MOI=100的RFP慢病毒进行转染,并用嘌呤霉素筛选制得稳转hUC-MSC细胞。
1.3 动物分组及模型构建
1.3.1动物分组:采用随机数表法分为空白组、模型组和移植组,每组24只。选取7日龄SD大鼠构建脑白质损伤模型。
1.3.2模型构建:模型组和移植组大鼠经异戊烷麻醉后于体视显微镜下用6-0#尼龙缝合线结扎右侧颈总动脉,并缝合伤口。30 min后,在8% O2和 92% N2的恒温(37 ℃)相对湿度70%的三气培养箱中缺氧处理2.5 h。空白组仅剥离右侧颈总动脉,不进行后续操作。造模结束后,所有大鼠放回母鼠身边饲养。
1.4 hUC-MSC细胞移植
缺血缺氧造模24 h后,将密度为1×105个/mL的hUC-MSC稳转细胞用脑立体定位仪注入移植组实验动物侧脑室中(坐标:AP:-0.5 mm;ML:2 mm;DV:-2 mm)。
1.5 认知功能检测
模型构建及细胞移植14 d后,采用Morris水迷宫方法检测实验动物认知功能改变。前4 d,每天固定时间进行一次定位航行训练,每次训练都要分别从四个象限将鼠面朝池壁放入,并记录120 s内寻找平台的潜伏期,120 s内未能上台则人工引导上台(潜伏期记为120 s)。第5天,进行空间探索实验,将大鼠从任意一个象限面朝池壁放入水中,记录60 s内穿过平台所在象限的次数。开展实验时采用Any-Maze处理系统(Steolting)进行数据获取。
1.6 脑组织病理学检测
实验动物在造模及细胞移植7 d和14 d 后分别进行灌流取脑处理,并制备石蜡切片。1%戊巴比妥钠麻醉后用冷的PBS心脏灌流,洗净循环系统中的血液。之后分别用冷的4%多聚甲醛进行心脏灌流、取脑并分别保存于4%多聚甲醛中,4 ℃保存。多聚甲醛保存的样品由南京东极生物科技公司制作石蜡切片。石蜡切片经二甲苯和不同浓度乙醇脱蜡水化后,分别用苏木素-伊红染色,正置显微镜下观察脑室周边及皮层部位的病理变化。HE染色参照Uehara等的评分方法进行评分[4]。评分标准如下:0度为正常;1度为白质轻度疏松,神经元轻度形变;2度为白质稀疏加深伴空泡化,神经元存在凝固性坏死,并呈三角样皱缩。
1.7 透射电镜检测
新生SD大鼠麻醉后分别用冷PBS和2%戊二醛心脏灌流。取脑后,于冰上在右侧胼胝体处切取1 mm3的组织块,继续用2%戊二醛和1%四氧化锇固定,并用不同浓度梯度的乙醇脱水。之后将样品由电镜室进行环氧树脂包埋及制50 nm厚度样,并进行拍照。图像分析时,将8 000×放大的样品照片随机选取4方视野,采用ITEM图像分析软件检测神经纤维横断面的髓鞘数目及厚度。髓鞘厚度=(最薄内径+最厚内径)/2。
1.8 细胞凋亡检测
将各组别实验动物造模7 d和14 d的脑组织在多聚甲醛中固定后,转移至不同浓度梯度的蔗糖多聚甲醛溶液中进一步脱水。液氮冷冻后,用冰冻切片机制备10 μm厚冰冻切片。Triton-X100透化并用H2O2灭活后,载玻片上每个组织切片上滴加50 μm TUNEL检测液避光孵育2 h后DAPI处理5 min标记细胞核。封片后在荧光显微镜下观察。
凋亡相关蛋白的检测采用造模7 d的脑皮层组织,采用RIPA组织裂解混合液裂解组织,获取蛋白之后采用BCA试剂盒进行蛋白定量。并将蛋白和上样缓冲液混合加热使蛋白变性。聚丙烯酰胺凝胶电泳蛋白质上样时控制上样量在20 μg/孔,蛋白分离后湿法转印至PVDF膜上,BSA封闭后分别加入一抗、二抗工作液孵育,洗掉未结合抗体后滴加ECL发光液,于化学发光检测仪中拍照,quantity one软件分析条带灰度值,并与内参蛋白比较排除误差,进行量化统计分析。
1.9 细胞增殖检测
分别于取材前10 h,即造模和移植后2 h对所有实验动物进行BrdU腹腔注射,每只鼠注射一次,注射剂量为100 mg/kg。
将各组实验动物造模7 d和14 d的石蜡切片进行BrdU-hUC-MSC双重标记免疫荧光处理。封片后荧光显微镜下观察。
1.10 统计分析

2 实验结果
2.1 间充质干细胞分离情况
结果如图1所示。流式细胞实验检测显示提取出的原代间充质干细胞中,CD73、CD90、CD105等抗体标记后,相较橘色的阴性对照均为阳性表达;且细胞形态学表现为成纤维细胞形态,证明MSC细胞分离纯化成功。
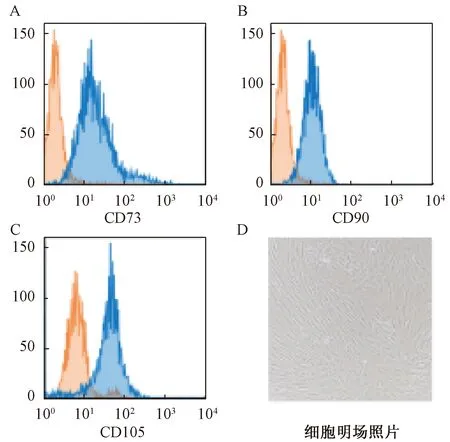
图1 hUC-MSC细胞鉴定Fig.1 hUC-MSC cell identification
2.2 认知功能检测结果
结果如图2所示。通过Morris水迷宫实验发现,相较空白组,进行缺血缺氧造模的大鼠在定位航行实验中,更偏好沿池壁行进,找到平台所用时间均显著增加,而进行hUC-MSC移植的大鼠找到平台所用时间则降低。在第5天的空间探索实验中,模型组大鼠探索目标象限的时间和进入目标象限的次数相比空白组均显著降低。而hUC-MSC的移植则能增加目标象限的停留时间和穿越次数。由此可见,大鼠的空间认知功能得到改善。
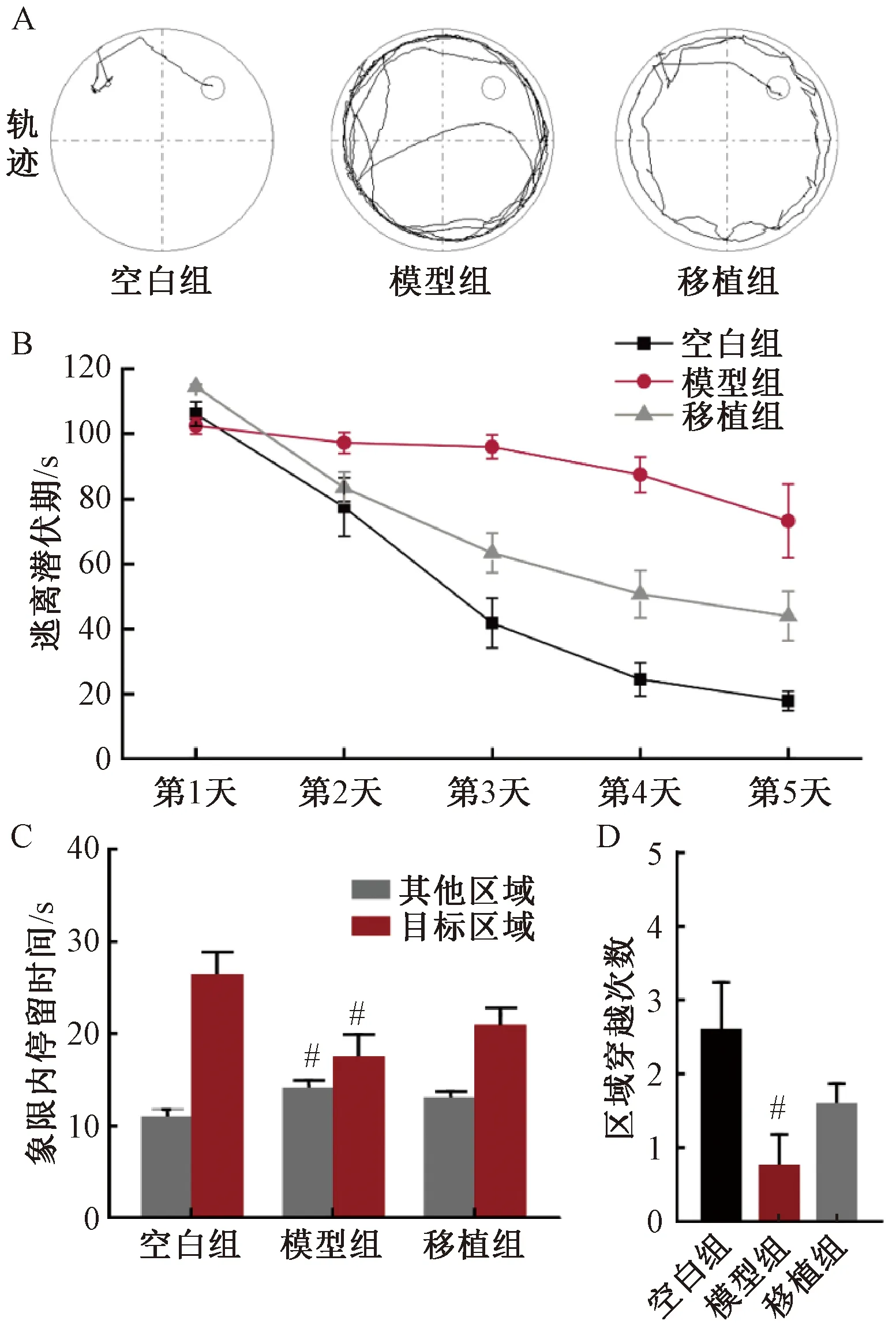
图2 Morris水迷宫实验结果注:与空白组相比,#P<0.05Fig.2 Results of Morris water maze experimentNote: Compared with the control group, #P<0.05
2.3 细胞增殖检测结果
结果如图3所示。通过BrdU掺入实验及免疫荧光检测发现,空白组BrdU存在一定程度表达,说明海马区存在正常的细胞增殖。PVL造模后BrdU表达水平显著下降,说明脑白质损伤后海马区细胞的增殖受到抑制,而hUC-MSC的移植则能够显著增加海马区增殖细胞数目,且双标记免疫荧光实验发现移植组存在未与hUC-MSC共定位的增值细胞。由此可见,hUC-MSC的移植能够促进自身神经干细胞的增殖。
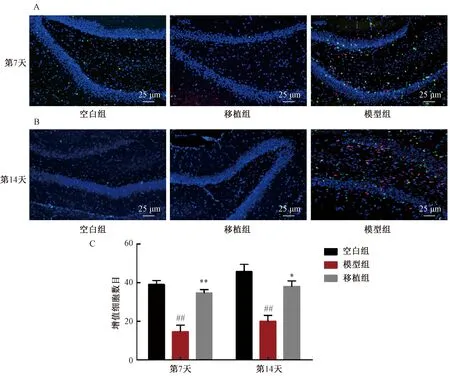
图3 BrdU检测细胞增殖注:与空白组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01Fig.3 Cell proliferation detected by BrdUNote: Compared with the model group,*P<0.05,**P<0.01
2.4 病理实验及透射电镜检测结果
结果如图4和图5所示。通过对脑室周围皮层的HE染色检测发现,空白组神经细胞形态饱满,细胞核与细胞质界限分明。而模型组神经元变形成三角形或菱形状,尼氏体固缩,同时胶质细胞存在一定程度的增生。hUC-MSC移植则能减轻这些病理损伤,视野中形态正常的神经元占比增加。

图4 HE染色检测病理损伤Fig.4 Pathological lesions were detected by HE staining
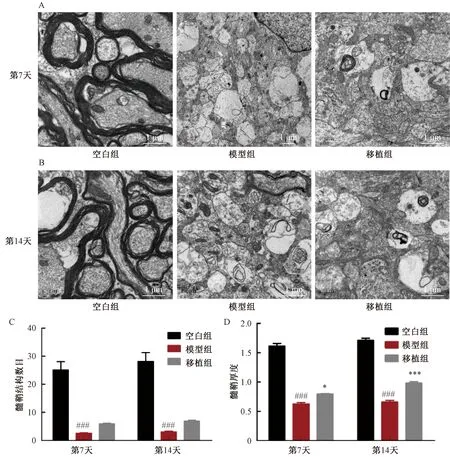
图5 透射电镜检测髓鞘超微结构病理改变注:与空白组相比,###P<0.001;与模型组相比,*P<0.05,***P<0.001Fig.5 Ultrastructural changes of myelin sheath were detected by transmission electron microscopyNote: Compared with the control group,###P<0.001; Compared with the model group,*P<0.05, ***P<0.001
透射电子显微镜检测发现相较空白组具有结构完整的髓鞘包覆的神经元,模型组神经纤维排列无序,髓鞘松散、空泡化甚至脱落。量化分析显示髓鞘厚度及髓鞘数目均显著降低。而hUC-MSC移植后可见有新的髓鞘形成。随着时间的推移,髓鞘厚度及数目均有增加,且髓鞘厚度增加显著。
2.5 细胞凋亡检测结果
结果如图6所示。Tunnel凋亡检测显示,PVL造模7 d和14 d时,模型组海马齿状回部位凋亡细胞数目相较空白组显著增加。而hUC-MSC移植后,凋亡细胞较模型组显著减少。而蛋白质免疫印迹检测也发现皮层部位的Caspase-3、Bcl-2等凋亡相关蛋白也会由于缺氧造模而显著升高,hUC-MSC的移植则能够显著降低这些蛋白的表达水平。
3 讨论
脑室周围白质软化症(PVL)是新生儿脑损伤的主要形式,也是早产儿脑瘫和认知障碍的主要已知原因[5]。大脑缺血缺氧或炎症往往会对发育中的新生儿的中枢神经系统造成严重损伤[6]。在足月儿中,此类损伤主要影响大脑皮层中的神经元,产生卒中样损伤。而在早产儿中,大脑白质中的未成熟少突胶质细胞和紧接在新皮层下方的神经元特别脆弱,因此损伤会进一步导致PVL[7]。因此,在构建脑室周围白质损伤的动物模型时,通常是通过结合单侧颈动脉闭塞和降低环境氧,或者通过细菌脂多糖(LPS)激活先天免疫系统诱导中枢神经系统缺氧缺血。两种方法均可引起弥漫性小胶质细胞活化,促炎性细胞因子和活性氧的大量产生以及脑室周围促髓鞘形成的少突胶质细胞的损耗[8]。
在本研究中,我们采用脐带间充质干细胞移植来治疗缺血缺氧所致的新生SD大鼠脑室周围白质软化损伤模型。通过单侧颈总动脉结扎和三气培养箱中低氧气氛的培养,实验动物空间认知功能严重损伤,脑室周胼胝体部位髓鞘脱失显著,邻近脑室的躯体感觉皮层部位神经元损伤显著,同时海马齿状回部位细胞发生凋亡。上述病理皆与PVL患儿的临床表现一致。
成体多能干细胞间充质干细胞具有在特定条件下分化形成神经元、少突胶质细胞等中枢系统中多种细胞的潜能,为中枢系统疾病的靶向治疗提供了启示[9]。而人脐带间充质干细胞(hUC-MSC)由于具有易于获取,免疫原性低和免疫抑制等优点,因此在干细胞研究领域越来越受到重视[10]。动物实验及临床研究均发现脐带间充质干细胞能减轻和改善脑部病变,提高患者的运动和认知功能。而在hUC-MSC对脑瘫儿童的治疗中,相较对照组不良事件的发生率无显著性差异[11]。通过对hUC-MSC治疗青光眼的研究发现其能减轻星形胶质细胞的A1极化,降低炎症因子水平[12],进而减轻LPS对视网膜神经节细胞的炎症损伤[13]。
基于以上事实,我们针对hUC-MSC对脑室周围白质软化损伤的改善作用进行研究。hUC-MSC移植后,皮层神经元损伤显著减轻,胼胝体部位髓鞘数量及厚度均增加,海马部位的凋亡细胞数目均有所减少,同时除hUC-MSC以外,进行增殖细胞数量也显著增多。水迷宫行为学实验也显示hUC-MSC移植后,大鼠的空间学习记忆功能显著改善。上述结果均说明hUC-MSC的在脑内的增殖能够促进内源性神经干细胞的增殖和分化,进而对PVL模型所致的脑损伤具有一定治疗作用。
综上所述,我们的研究确定了hUC-MSC对PVL所致脑损伤的干预作用,为hUC-MSC在脑脱髓鞘损伤及相关领域的应用提供了理论依据。
