正交试验设计探索小鼠不同组织冰冻切片的优化制备方法*
2021-06-07房彬彬罗俊一宁李艳红杨毅宁
房彬彬 孙 立 刘 芬 罗俊一 杨 宁李艳红 王 黎 田 婷 杨毅宁
(1.新疆医科大学第一附属医院临床医学研究院,省部共建中亚高发病成因与防治国家重点实验室,乌鲁木齐 830054)(2.新疆医科大学第一附属医院冠心病一科,乌鲁木齐 830054)(3.新疆医科大学第一附属医院医学检验中心,乌鲁木齐 830054)
冰冻切片因其快速、简便、较好的保存抗原活性及酶类等优点[1],在病毒转染效率分析、油红O染色、免疫荧光等实验中具有不可替代的优势,目前被广泛应用于临床病理快速诊断和科学研究中[2-4]。在医学科研工作中,实验标本多来自于动物模型,如小鼠、大鼠、兔、犬等,其中尤以小鼠最为普遍[5]。但是在制片过程中,由于各种组织中所含水分的不同、质地软硬的差异以及组织中形态结构和成分的多样性等因素[6-7],如运用相同的固定、脱水、包埋等方法,常出现组织过度收缩或肿胀、过脆无法制片、冰晶形成过多、脱片等问题[8],导致组织细胞形态发生明显改变[9],严重影响冰冻切片的质量及结果的判读。为此,本研究选择小鼠常规器官组织,探索各组织在冰冻切片制备过程中的最佳固定、脱水方法,切片温度以及切片厚度,为高质量冰冻切片的制备提供参考依据。
1 材料与方法
1.1 实验材料
1.1.1实验动物取材:昆明小鼠,雌性,3只,购自新疆医科大学实验动物中心,实验动物使用许可证号:SYXK(新)2018-0003,分别取心、肝、脾、肾、大脑、主动脉及腓肠肌。
1.1.2仪器设备:Leica CM1950冰冻切片机和Leica DM 3000显微镜。
1.1.3试剂及耗材:OCT冷冻切片包埋剂美国樱花SAKURA、苏木素染色液(ZLI-9610)及伊红染色液(ZLI-9613)均购自北京中杉金桥公司;环保透明脱蜡液(YA0031)购自北京索莱宝科技有限公司;4%多聚甲醛通用型组织固定液购自Biosharp Life sciences;蔗糖、75%乙醇、95%乙醇与无水乙醇均购自天津永晟精细化工公司;包埋模具购自美国Fisherbrand;切片机刀片徕卡819一次性刀片购自德国莱卡;防脱载玻片购自江苏世泰实验器材有限公司。
1.2 实验方法
1.2.1正交实验优化冰冻切片方法:根据三个影响冰冻切片质量的主要因素,即固定、脱水程序(A),切片厚度(B)和冷冻温度(C),选择SPSS 21.0软件进行正交实验设计。参考冰冻切片质量标准作为评价标准[10]。①组织完整性:细胞形态完整,细胞染色境界清楚(4分);形态完整,境界欠清晰(3 分);非关键部位缺失小于20%(2分);关键部位缺失或非关键部位缺失大于20%(1分)。②组织开裂:无开裂(4分);1条轻微裂隙不影响观察(2分);大于1条裂隙,但开裂不明显(2分);开裂明显(1分)。③冰晶伪迹: 无伪迹(4分);伪迹轻微不影响观察(3分);伪迹明显不影响观察(2分);伪迹明显影响观察(1分)。④核浆对比度:核浆着色均匀,红蓝对比鲜明(4分);核浆着色欠佳,红蓝对比较好(3分);核浆着色浅,红蓝对比不明显(2分);核浆着色一致,无法分辨(1分)。正交实验设计表见表1所列。
1.2.2固定、脱水程序:三种。不固定、不脱水:组织取材后,OCT包埋入模具中,液氮表面预冷15 s;固定、不脱水:组织取材后,4%多聚甲醛固定过夜,OCT包埋入模具中,液氮表面预冷15 s;固定、脱水:组织取材后,4%多聚甲醛固定过夜,依次浸入20%和30%蔗糖溶液脱水至沉底,OCT包埋入模具中,液氮表面预冷15 s。
1.2.3冰冻切片制备:将组织修整为5 mm×0.5 mm,厚度为2~3 mm。OCT包埋入模具中,液氮表面预冷15 s。冰冻切片机切片,防脱载玻片贴片,室温风干,进行HE染色。
1.2.4HE染色:将冰冻切片用4%多聚甲醛固定15 min,PBS洗涤3次,5 min/次,入苏木素溶液染色1.5 min,取出后自来水充分洗涤;盐酸乙醇分化1 s,自来水终止,PBS返蓝2 min,伊红染色1 min,取出后自来水充分洗涤,入梯度乙醇脱水,环保透明脱蜡液透明,中性树胶固封。使用Leica DM 3000显微镜进行图像采集和分析。
1.3 统计学处理
使用SPSS 21.0软件进行统计分析,不同组间均值比较采用主效应方差分析。P<0.05认为差异有统计学意义。
2 结果
2.1 正交实验结果
按照切片质量评价标准对各组织切片进行评分结果,见表2所列。主效应方差分析结果显示,不同组织对于固定步骤、温度、切片厚度的要求不同,但结果显示,仅有固定脱水程序的差异有统计学意义,且对于肝脏组织,最合适的步骤为固定后脱水;对于主动脉,不同的固定脱水程序、温度、切片厚度间差异无统计学意义;而对于其他组织而言,不固定、不脱水的组织冰冻切片效果较好。由此可知,A因素对实验结果影响显著,而B因素、C因素对实验结果影响较弱。由表3可知,对于肝脏组织,A3标准可以获得较优质切片;对于肌肉、心、脾、脑、肾组织,A1标准可以获得较优质切片;对于主动脉组织,由于A因素对切片质量影响不大,但不固定、不脱水可提高组织抗原呈递性,所以选择A1标准。对于各个组织B因素与C因素对切片质量影响不大,综合各组织情况,建议选择B2C2标准。综上所述,肝脏组织最佳切片条件为A3B2C2,即固定后脱水,切片厚度控制在5 μm,-18 ℃切片;肌肉、心、脾、脑、肾、主动脉组织最佳切片条件为A1B2C2,即不固定、不脱水,切片厚度控制在5 μm,-18 ℃切片。
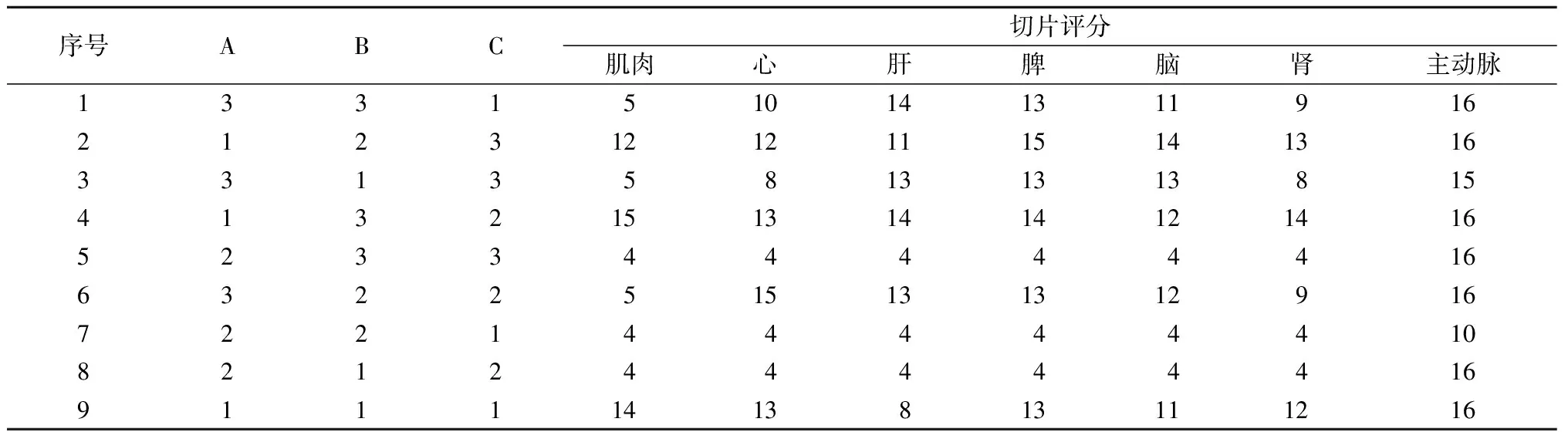
表2 L9(34)正交实验设计Table 2 Orthogonal design L9(34)
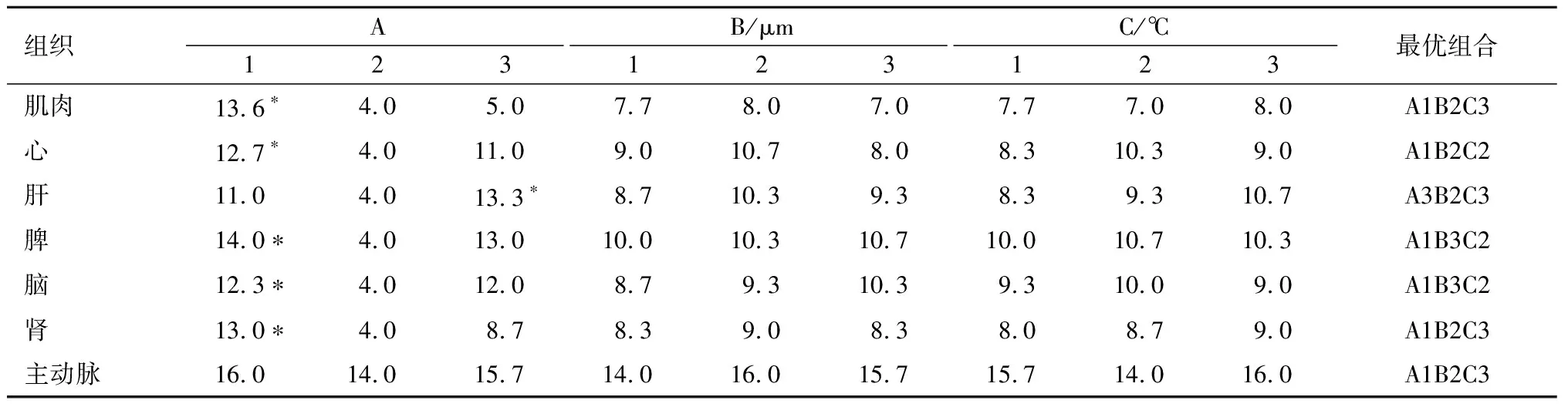
表3 单因素统计表Table 3 Statistics of single factor
2.2 部分代表性组织切片
主动脉组织经不同固定脱水程序后,将HE染色结果进行比较,可见不固定、不脱水(图1A),固定、不脱水(图1B)以及固定、脱水(图1C)三种步骤,组织结构均完整、无皱折及冰晶、核质分明。
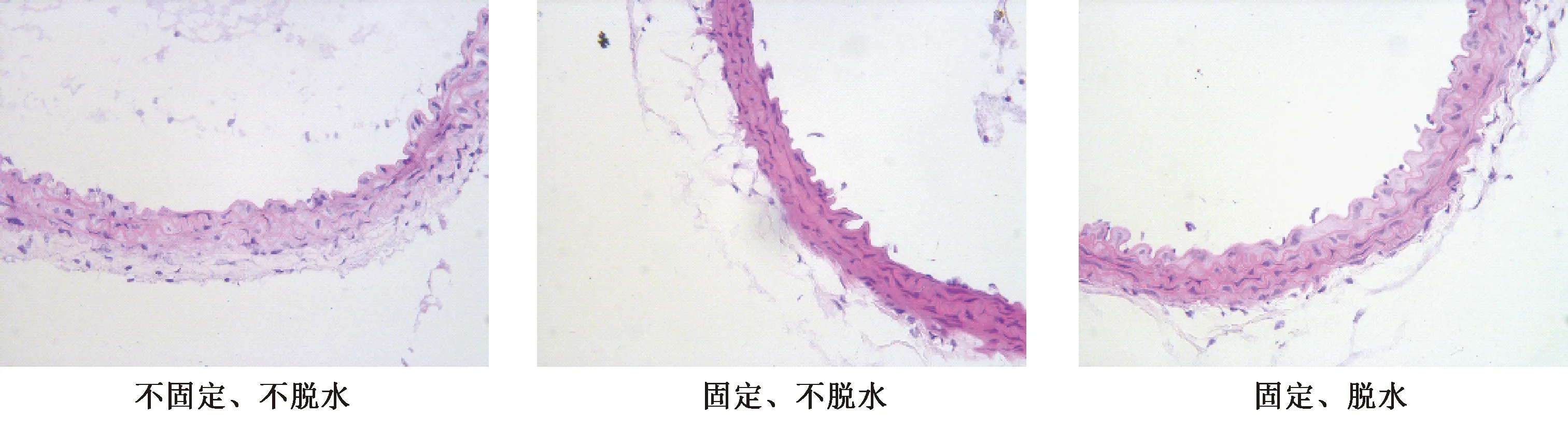
图1 各组小鼠主动脉HE染色结果(×400)Fig.1 HE staining results of aorta in mice of each group (×400)
除主动脉以外的其他组织,以小鼠腓肠肌和大脑组织为例,不固定、不脱水(图2A、图3A)方法冰冻切片完整、贴片平整、不易产生皱褶及冰晶,核浆对比度好,色彩鲜艳。固定、不脱水(图2B、图3B)组织细胞碎裂,核质无法分辨。固定、脱水(图2C、图3C)贴片较平整、组织细胞有不同程度的碎裂及冰晶形成,核浆对比度一般。
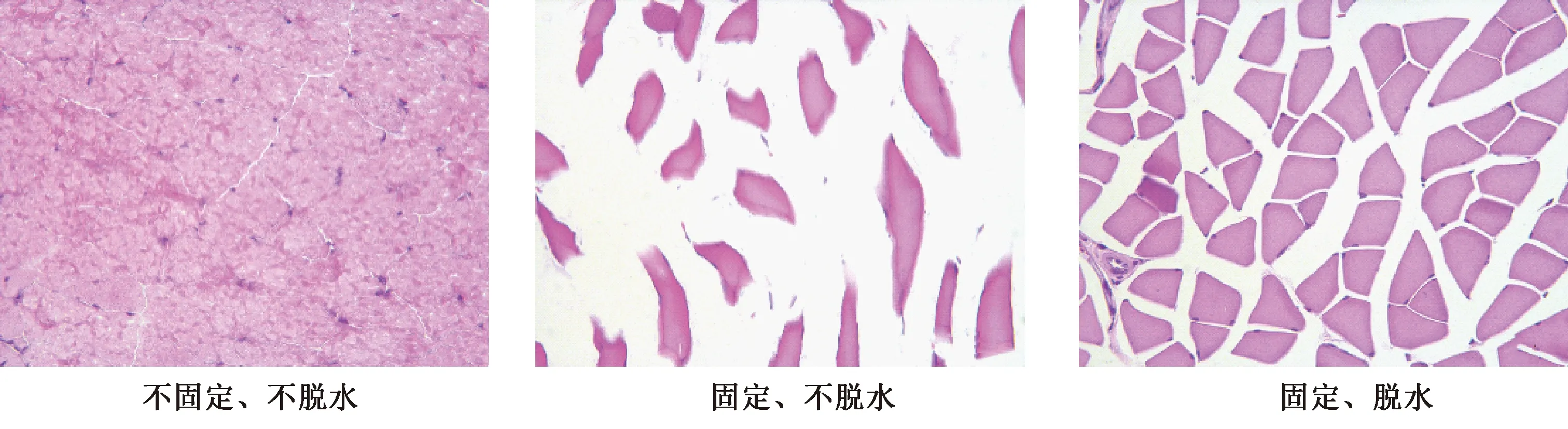
图2 各组小鼠腓肠肌HE染色结果(×400)Fig.2 HE staining results of gastrocnemius muscle in mice of each group(×400)

图3 各组小鼠大脑HE染色结果(×400)Fig.3 HE staining results of brain in mice of each group(×400)
3 讨论
冰冻切片技术在病理诊断中具有举足轻重的作用[11-12],常用于临床手术科室快速组织病理学诊断,而在基础研究中,冰冻切片除了观察病理形态结构变化以外,还要进行细胞蛋白定位、组织脂质定位及含量测定、转染效率分析等深入的研究,对冰冻切片技术及样本的质量要求很高,但冰冻切片的制备方法在文献报道中差别较大,不同组织器官适宜的切片制备条件也有所不同[13]。本研究采用正交实验设计,选择三个影响冰冻切片质量的主要因素,重点筛选小鼠常规组织冰冻切片的最优方案,解决基础研究中的具体技术问题,确保实验结果的真实性和科学性。
冰冻切片的固定、脱水程序,由于各组织之间的形态结构和组成成分上的差异,一直以来没有一个确定的流程。张頔等[6]研究采用新鲜组织直接液氮速冻法处理皮肤、肝脏、肾脏等组织,伍刚等[10]使用4%多聚甲醛溶液灌注固定大鼠大脑前动脉-嗅动脉24 h,30%蔗糖脱水24 h 至标本沉底。金云涛等[14]经流水冲洗猪肺24 h,浸泡于20%蔗糖24 h,30%蔗糖3 d。本研究在总结了多个研究结果的基础之上,选择了三种程序,确定了不同组织最佳的固定和脱水方法。
切片温度是保证切片质量的关键因素,温度过低,组织硬度大,可能导致组织破碎,切片产生裂痕,温度过高组织硬度不够,造成黏片、OCT与组织脱离、切片褶皱等情况[15];厚度的调整也是必须的,以适应各种类型的组织,切片过厚,组织特征变得模糊影响观察,而过薄将造成切片残缺不完整[16]。因此,不同组织标本冰冻切片时,需要调整到适宜的切片温度及厚度。
如果将三因素、三种水平分别实验,观察对切片的影响,实验成本大且周期长。而通过正交试验设计和分析方法,能够实现以最少的试验次数达到与大量全面试验等效的结果,提高了实验效率,减少实验动物数量,节约实验成本[17]。通过正交试验法,优化了切片条件,各组织有其不同的固定、脱水程序,切片温度以及切片厚度,提高了常用组织的冰冻切片制备的质量及效率。
