茶树花多糖研究进展
2021-06-07生吉萍宿文凡
生吉萍,宿文凡
(中国人民大学 农业与农村发展学院, 北京 100872)
茶树花(tea blossom或tea flower)与茶叶同根共生、一母同胞,是茶树的生殖器官。由于茶树花的生长会与第二年萌发的新芽争夺营养,从而降低新茶的质量,故茶树花往往作为茶树的废弃物被茶农采用各种方法除去。这不仅耗费了人力,还造成了茶树花资源的严重浪费。实际上,茶树花作为茶树生长过程中的重要产物,同茶叶一样拥有丰富的营养成分和活性物质。
山茶科山茶属茶树[Camelliasinensis(L.) O.Kuntze]的花早在2013年就被原国家卫生部批准为新资源食品(卫生部公告2013年第1号)。茶树花蕴含着丰富的营养物质,主要包括茶多酚、茶多糖、茶皂素、超氧化物歧化酶(superoxide dismutase,SOD)、黄酮类物质、氨基酸等有益成分和活性物质[1-2]。茶多糖(tea polysaccharides,TPS)是一类与蛋白质结合的酸性多糖或酸性糖蛋白,具有防辐射、抗凝血、降血糖、增强免疫功能、降血压、耐缺氧、增加冠状动脉血流量和降血等多种作用[3]。而茶树花多糖(tea flower polysaccharides,TFPS)是从茶树花中提取出来的多糖成分,与茶多糖比较,茶树花多糖高于新茶叶中多糖的含量。相关研究发现[4],茶树花中的多糖成分与茶叶中含有的多糖成分基本相同。茶树花中多糖质量分数为1.04%~1.84%,高于新茶叶中多糖的含量。将茶树花树多糖进行有效分离,发现茶树花多糖由葡萄糖、阿拉伯糖、半乳糖、半乳糖醛酸、甘露糖、木糖、岩藻糖、鼠李糖等聚合而成,其中以葡萄糖、半乳糖、阿拉伯糖、半乳糖醛酸、甘露糖为主,占70%以上。
目前,围绕茶树花的研究方兴未艾,针对茶树花多糖的研究报道也相对较少。但茶树花可利用价值高,可制作的食品种类多样,在未来的茶产业发展中,深入开发茶树花产业,将对丰富茶相关产业、延长茶产业链,以至促进农民增收、实现乡村振兴发挥重要的作用。本文围绕茶树花多糖的功效、提取方法、分离纯化方法等方面进行阐述,以期为茶树花及其多糖活性物质的开发和利用提供新的思路。
1 茶树花多糖生物活性研究
由于茶树花多糖的成分与茶多糖相似,故本节整合了茶树花多糖和茶多糖的生物活性研究报道。
1.1 降血糖
在我国和日本的民间,常利用粗老茶叶来治疗糖尿病,其主要的有效成分就是茶多糖。茶树花中的茶多糖含量高于茶叶,可为茶多糖的生产利用提供较好的材料。茶多糖降血糖作用随着世界范围内糖尿病发病率的持续增高而得到了日益广泛的关注,目前关于其降血糖作用的机理主要有4个方面的解释。1)茶多糖可保护胰岛细胞,促进了胰岛素分泌。丁仁凤等[5]将茶多糖拌入饲料喂糖尿病大鼠3周,发现茶多糖有显著抑制糖尿病大鼠血糖升高的作用,与对照组相比,茶多糖组大鼠血胰岛素水平有显著提高(P<0.05),其作用机制可能是促进了胰岛细胞损伤的恢复。茶多糖可通过提高机体抗氧化能力和细胞免疫功能保护胰岛β细胞,从而促进胰岛素分泌[6]。2)提高胰岛素敏感性。胰岛β细胞功能异常和胰岛素抵抗是II型糖尿病发病的基本环节,持续高血糖可直接损伤β细胞功能和胰岛素敏感性,使得血糖进一步升高,形成恶性循环[7]。PPAR-γ激动剂有提高胰岛素敏感性的作用,是某些抗糖尿病药物如噻唑烷二酮的主要作用机理。许多研究表明:茶多糖降血糖的作用机制可能是通过激活PPAR-γ而使其介导的胰岛素敏感性增高所致[8]。3)调节糖代谢有关酶的活性。这些调节作用包括增强葡萄糖激酶活性和抑制糖降解酶活性。增强葡萄糖激酶活性可以促进糖的合成代谢从而降低血糖,抑制糖降解酶活性可以抑制葡萄糖转运活性、延缓小肠对糖的消化吸收。4)提高肝糖原含量,降低血糖。有研究表明:茶多糖可通过改善糖尿病小鼠肝脏糖代谢过程增加肝糖原的累计,从而使输出到血液中的葡萄糖减少,使血糖水平降低。
茶多糖降血糖功效是肯定的,它具有多种降糖机制,但其作用机制比较复杂,可能是多途径、多因素的综合作用。若需进一步搞清楚多糖的构效关系,还需进行更加深入的研究。
1.2 抗氧化
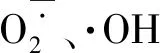
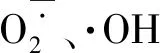
茶多糖的抗氧化活性可能是其预防心脑血管疾病和延缓衰老的作用机制之一。全吉淑等[14]研究了茶多糖体外清除自由基与抗脂蛋白氧化作用。结果表明:在食用茶多糖后受试者血浆及极低密度脂蛋白、低密度脂蛋白和高密度脂蛋白过氧化脂质水平明显降低,说明茶多糖可增强血浆及脂蛋白的抗氧化能力。
1.3 免疫调节及抗肿瘤
茶多糖可以通过增强免疫细胞活性从而抑制肿瘤细胞的增殖。而茶多糖的抗氧化活性可能是其具有增强免疫调节作用的机制之一。韩铨[15]建立小鼠S180肉瘤移植模型,进行抑瘤率计算和免疫调节活性的研究。将茶树花多糖以灌胃形式注入患瘤小鼠体内发现,茶树花多糖低、中、高剂量组的抑瘤率分别为45.5%、60.9%和64.5%;第20天的存活率分别为40%、60%和90%,对照组小鼠则全部死亡。对于脾脏和胸腺等免疫器官,茶树花多糖使胸腺指数有所上升对胸腺起到的保护作用,但是对脾脏指数没有显著影响。对于具防御和免疫调节功能的巨噬细胞,使用低中高剂量的茶树花多糖后小鼠体内巨噬细胞的吞噬指数有显著的提高,表明其对小鼠免疫功能的增强作用。
Wang等[16]水提法提取茶树花多糖后分别用体积分数为10%~90%的9个不同梯度浓度的乙醇分别沉淀茶多糖,从而得到九种不同组分的茶多糖并研究其相关生物活性,结果表明:不同组分茶树花多糖对α-葡萄糖苷酶及淋巴细胞增殖均有很强的抑制效果。魏楠等[17]将茶叶提取物茶多糖与阿霉素联用,研究了茶多糖对阿霉素抑制肺癌A549细胞增殖作用的影响,发现茶多糖和阿霉素联用后能够使具有毒副作用的阿霉素在减少用量的同时不改变对肺癌细胞A549细胞的增殖抑制作用。但实验所用的为粗茶多糖并不是提纯后的茶多糖,所以具体的作用机制还需要进一步的研究。
1.4 肝脏保护
茶树花粗多糖可有效地保护肝脏,有学者认为其作用机理可能是(至少部分是)通过内源性抗氧化酶(SOD和GSH- Px)活性的增强以及MDA含量的减少来发挥作用的。徐人杰[10]利用四氯化碳建立了肝损伤模型,肝损伤模型组能显著降低肝脏中SOD和GSH- Px活性,增加MDA含量;而茶树花粗多糖组可以显著提高SOD和GSH- Px活性,降低MDA含量,这表明茶树花粗多糖能从抑制脂质过氧化的角度保护肝脏。值得注意的是,在茶树花多糖处理组中,中剂量组表现出最好的效果,而高剂量组的效果比中剂量组低,暗示茶树花粗多糖在高浓度下反而产生了一定的反作用,其机理有待进一步研究。
另外,黄思茂等[18]研究金花茶多糖对肝损伤的保护作用机制时认为茶多糖对肝的保护作用除了与抗氧化应激密切相关,可能与抗炎机制也有关系。研究发现,金花茶多糖能较好地抑制NF-κB、IL-1β、IL-6及TNF-α的表达。NF-κB是重要的炎症转录因子,被激活后可以导致各种促炎细胞因子如IL-1β、IL-6及TNF-α的大量产生并参与炎症反应,而促炎细胞因子大量增多又可以反过来激活NF-κB,形成正反馈调节。这种正反馈调节会加重炎症反应的产生进而加重肝组织的损伤,而金花茶多糖抑制相关因子的表达便可达到保肝的效果。这也可以成为茶树花多糖肝保护作用的一个研究方向。
1.5 抗凝血
有关茶树花多糖抗凝血的研究文章几乎没有,但是关于从茶叶中提取出的茶多糖抗凝血作用的研究在这几年间已经有所发展。实验证明,茶多糖可以明显抑制血小板的黏附作用并降低血液黏度因而具有抗血凝可抗血栓作用。王淑如等[19]报道,茶多糖在体内、体外均有显著的抗凝作用,茶多糖体外可显著延长混合人血浆的凝血时间和凝血酶原时间。研究发现,茶多糖是通过内源性系统来影响抗凝血过程[20-21]。随着茶多糖浓度的增加,活化部分凝血活酶时间(activated partial thromboplastin time,APTT)不断延长,但凝血酶原时间基本没有变化,这都显示茶多糖不是通过外源性途径来影响凝血途径。谢亮亮将茶叶中的茶多糖提取分离后得到4个组分TPS-1、TPS-2、TPS-3和TPS-4,其中粗多糖、TPS-2、TPS-3与凝血酶时间不存在剂量关系,但是TPS-4和TPS-1存在一定的剂量依赖关系,其中TPS-4比TPS-1对凝血酶时间更有显著性影响,延长了46.9%,实验结果显示TPS-4是通过把纤维蛋白原转化为纤维蛋白影响凝血过程。
1.6 其他作用
茶多糖还有调节肠道健康、抗辐射作用、抗病毒、降血脂等作用,但这些作用研究较少,且大都以茶叶为研究原料,故关于茶树花多糖的生理活性有待进一步研究。
2 茶树花多糖提取方法研究
根据多糖的提取部位和存在形式的差异,决定是否需要做预处理并确定预处理的方法。根据近些年茶树花多糖的提取工艺研究,主要的提取方法包括溶剂提取法、酶法提取、微波辅助提取和超声辅助提取法。
2.1 溶剂提取法
多糖是极性大分子化合物,故在选择溶剂时,根据相似相容的原理,应选择水、醇或极性较强的酸碱溶剂。采用热水进行粗提时一般要把水温加热到快沸的温度,因此提取成本较高。热水浸提要消耗的时间长提取出来的组分较复杂后续的进一步提纯难度大因此提取效率也较低。相对乙醇和水,酸碱提取能获得更高的提取效率,并且酸、碱提取液经迅速中和、透析、浓缩与醇析后,能获得更多的多糖沉淀。但是,酸碱提取有一个明显的缺点就是容易破坏多糖的活性及空间结构。
2.2 热水浸提法
有关热水浸提茶树花多糖的报道较多,但是研究结果中料液比、时间、温度等影响因素的数值有所不同。
杨玉明等[22]用水浴浸提茶树花多糖,关注料液比、提取次数、提取时间、提取温度等因素对多糖得率的影响。经过正交试验表明:各因素对茶树花多糖浸提的得率影响大小顺序为料液比、时间、温度,得到较佳的浸提工艺为料液比1∶40(g/mL)、浸提温度90 ℃、提取时间120 min,在此工艺条件下茶树花多糖提取得率为2.13%。
称取100 g的茶树花将其研磨粉碎,在茶树花粉末中加入V(氯仿)∶V(甲醇)=2∶1的混合液900 mL,剧烈摇晃,重复4~5次,直到有机层基本无色为止,将提取渣取出,晾晒挥发有机溶剂。再加入一定体积的蒸馏水加热浸提数小时,连续提取3次,合并滤液后60 ℃旋转蒸发浓缩至1/5体积,在浓缩液中加入5倍体积的无水乙醇沉淀多糖,静置过夜沉淀,5 000 r/min,20 min离心收集沉淀,从茶树花多糖中提取得到的总多糖,湿态下接触空气会氧化变色,因此水提醇沉得到茶树花多糖,应依次用无水乙醇、丙酮、乙醚洗涤,尽可能保留较少的水分,真空干燥或冻干,可一定程度上避免氧化发生。
在单因素试验的基础上,应用响应面法优化茶树花多糖的提取工艺,确定出茶树花多糖热水浸提的提取较佳条件为21.75倍质量的水,90 ℃提取1.89 h[15]。
将茶树花多糖粗品用蒸馏水溶解后,运用Sevage法脱蛋白,重复3~4次,直至无变性蛋白层产生。加入5%的活性炭脱色,3 000 r/min离心后过滤活性炭,冷冻干燥后得到茶树花粗多糖。
2.3 乙醇回流提取法
张星海[23]利用乙醇回流提取茶树花中的茶多糖,发现不同来源的茶树花其总糖质量分数一般在16.15%~23.25%。提取方法为称取磨碎茶样10 g,加体积分数为80%乙醇400 mL,95 ℃水浴回流1 h,趁热抽滤,滤渣用体积分数为80%热乙醇50 mL重复洗涤2次,以除去单糖等干扰性成分,加水1 L,沸水浸提60 min,滤渣用热蒸馏水50 mL重复洗涤2次,合并滤液,10 000 r/min离心分离10 min,去除杂质,浓缩后用3倍体积的体积分数为95%的乙醇沉淀,7 000 r/min离心10 min得到沉淀物,冻干后得茶树花粗多糖。
2.4 酶解提取法
通过酶的作用分解原料组织,加快有效成分溶出细胞,这样能够大大缩短提取时间,提高了提取效率。为了分解破坏具有纤维素、半纤维素、果胶等这些物质组成的植物细胞壁及细胞间质,在应用时多采用复合酶,这种提取方法的工艺条件温和、容易提纯、提取得率高和成本低等优点。
俞兰[24]研究了酶法提取对多糖得率的影响。在按表1中的条件下加入戊聚糖复合酶、纤维素酶、葡聚糖酶、中性蛋白酶及果胶酶,90 ℃灭酶10 min,过滤,滤渣继续用水提取[水提工艺条件为料液比1∶8(g/mL)、浸提温度55 ℃、提取时间1 h],再过滤、离心,然后两次清液合并浓缩,醇沉、冻干,制得多糖样品。
研究结果表明:添加中性蛋白酶、纤维素酶戊聚糖复合酶对多糖得率有明显的提高。其中添加中性蛋白酶后多糖得率为33.41%,添加纤维素酶后多糖得率为17.93%,添加戊聚糖复合酶后多糖得率为18.32%,但是戊聚糖复合酶提取得到的茶多糖的蛋白质含量较低,茶多糖中的酸性糖含量较高,因此提取茶树花多糖一般选择戊聚糖复合酶。

表1 不同酶制剂提取茶树花多糖的最适参考条件Tab.1 Optimum reference conditions for extraction of polysaccharides from tea blossom by different enzymes
2.5 超声波辅助提取法
超声波技术是一种非常有效的提取生物功能因子的方法和手段。在大破坏应力作用下,液体内产生空化作用,产生很强的冲击波和微声流,使细胞壁瞬间破裂。植物细胞内的有效成分能够很快进入溶剂从而提高提取效率。但是超声可能会降解部分可溶性多糖,使其容易溶解于乙醇溶液中,但并不影响水溶性多糖的生物性能。张玲等[25]研究了茶树花多糖的提取方法,通过正交试验确定了较佳提取工艺条件。结果表明:影响茶树花多糖提取各因素的主次顺序为超声波功率、浸提温度、料液比,较佳提取工艺条件为料液比1∶20(g/mL),超声波功率90 W,浸提温度为70 ℃,在此工艺条件下茶树花多糖提取得率1.324%。该文献报道没有研究超声波辅助提取时间因素,茶树花多糖得率较低;而秦德利等[26]利用响应曲面法优化的较佳工艺条件为超声时间12 min,超声功率540 W,料液比1∶30(g/mL),茶树花多糖提取率为7.69%。
2.6 微波辅助提取法
微波萃取就是利用高频电磁波穿透提取溶剂,造成细胞结构破损,胞外溶剂容易进入细胞内,有效成分也自由流出到溶剂中。应用微波辅助提取手段能够显著缩短提取时间,提高多糖的提取效率。余锐[27]利用微波辅助提取技术研究茶树花多糖的提取工艺。通过单因素试验比较了时间温度和溶媒添加量等3个因素对茶树花多糖得率的影响得到较佳的提取工艺条件,在较佳条件下多糖得率为(5.08±0.09)%。韩艳丽等[28]利用微波辅助提取技术研究茶树花多糖的提取工艺,正交试验优化较佳工艺为时间60 min,料液比1∶15(g/mL),提取温度50 ℃,醇沉纯化后提取率为2.61%。
韩艳丽等[29]将酶法提取和微波法提取工艺进行了综合,研究了果胶酶- 微波法综合提取茶树花多糖的工艺。通过单因素和正交实验,在加酶质量分数1.0%、酶解pH值5.5、酶解时间2.5 h、酶解温度50 ℃的条件下,茶树花多糖的提取率最高;茶树花经酶解后,在700 W微波强度下,微波时间60 s,茶树花多糖提取率达4.82%。由此可知,果胶酶- 微波法明显提高了茶树花多糖的提取率。
2.7 超临界CO2萃取法
利用压力和温度对超临界流体溶解能力的影响,在超临界下,将超临界流体与目标物接触,有选择性地将极性、分子质量和沸点不同的成分依次萃取。有研究利用超临界萃取茶树花中的茶多糖,利用响应面法对萃取工艺进行优化:在萃取时间170 min、萃取压力45 MPa、萃取温度75 ℃、夹带剂乙醇体积分数为50%条件下,茶树花多糖的实际平均得率为(6.56±0.37)%[23]。但该项技术设备昂贵,而且实验重复性、稳定性较差,不利于推广应用。
3 茶树花多糖分离纯化方法研究
提取出的茶树花粗多糖,一般需要经过脱蛋白、脱色、色谱柱分离等纯化工艺。
3.1 脱蛋白
陈小萍等[30]总结了茶树花脱蛋白的方法,主要有Sevage法、蛋白酶法与Sevage法联用法、鞣酸法、三氯乙酸法。这4种方法的机理不尽相同,蛋白酶法是将茶树花多糖中的蛋白质水解,Sevage法是用有机溶剂使蛋白质变性,鞣酸和三氯乙酸是使蛋白质带正电荷的酸根离子结合变性。研究发现以上4种方法中酶法和Sevage法联用脱蛋白效果最好。但酶解强度不宜过大、时间不宜过长,因为茶树花多糖中有多糖- 蛋白质复合物,酶解强度大则会使这部分复合物的生理活性降低。顾亚萍[31]采用了Sevage法,较佳操作条件为:先用分液漏斗分离,再使用离心的方法去除蛋白,这样可以尽可能减少多糖的损失。Sevage处理的较佳次数为3次。
3.2 脱色
常用的脱色方法有3种:活性炭脱色法、H2O2脱色法、大孔树脂脱色法。H2O2氧化脱色效果差,原因可能是H2O2不适合应用于酚氧化酶活性高的茶树花多糖样品。活性炭脱色不易洗脱,会造成多糖成分的损失,故对于茶树花多糖最常用的方法就是树脂脱色。
陈小萍等[30]采用D- 315型大孔树脂脱色效果较好。顾亚萍[31]采用DEAE- 阴离子纤维素DE52柱材料脱色,脱色的较佳条件:缓冲液为pH6.0的磷酸盐,流速为0.8 mL/min,每6 min收集一管。经DEAE初分离,可以得到纯度为87%的TPS-1和另一多糖TPS-2。俞兰[24]采用树脂静态脱色,筛选后RJA型号树脂脱色效果较好,经过离子交换树脂 RJA 脱色处理后,茶花水提液总糖保留率为70%,酸性糖保留率为41%。
3.3 色谱柱纯化
多糖的纯化主要采用色谱法,通常有纤维素阴离子交换剂柱色谱法和凝胶排阻柱色谱法两种。纤维素离子交换剂柱色谱法是利用连接在纤维素上的离子交换基团的静电键合作用对所带电荷大小不同的物质进行分离的一种方法。常见的纤维素阴离子交换剂为二乙基氨基乙基(dicthylaminoethyl, DEAE)、羧甲基(carboxymethyl, CM)等,适用于分离各种酸性多糖、中性多糖和黏多糖。凝胶排阻柱色谱法是利用凝胶微孔的分子筛作用对分子大小不同的物质进行分离的一种方法。通常选作填料(固定相)用的微孔凝胶有葡聚糖凝胶(Sephadex G-75、Sephadex G-100和Sephadex G-200)、琼脂糖凝胶(Sepharose 2B、Sepharose 4B和Sepharose 6B)等。
顾亚萍[31]采用Sephacryl S-300进行分离,将树脂脱色过的TPS-2上已经预处理的Sephacryl S- 300柱,使用pH=6.0的磷酸缓冲溶液洗脱,洗脱速度0.8 mL/min。徐人杰[10]将经过DEAE- 纤维素- 52层析柱得到的3个洗脱组分TFPS-1、TFPS-2、TFPS-3 50 ℃减压蒸发浓缩,浓缩液去离子水透析48 h,透析液真空冷冻干燥得到初步纯化产品,然后将3个组分用葡聚糖凝胶G- 100进行进一步分离纯化,可知TFPS-1、TFPS-2可洗脱出两个组分,而TFPS-3只洗脱出一个组分,这说明TFPS-3是均一多糖。
4 总结与展望
茶树花内含有丰富的茶树花多糖,具有降血糖、抗氧化、免疫调节及抗肿瘤、肝保护、抗凝血等多种作用,具有较大的开发利用价值。目前已开发出多种方法对其进行提取、分离、纯化,为后续茶树花多糖的加工利用奠定了基础。未来,需继续加大茶树花多糖的开发利用,将其应用于食品、医药、化工等领域,这将对丰富茶相关产业、延长茶产业链、促进农民增收、实现乡村振兴发挥重要的作用。
