RBP4、Hcy、血脂与动脉粥样硬化的关系
2021-06-07孔凡斌吴晓明
孔凡斌, 袁 勇, 吉 永, 李 铮, 陈 琪, 吴晓明, 高 辉
(昆明医科大学附属延安医院检验科,云南 昆明 650051)
视黄醇结合蛋白4(retinol binding protein 4,RBP4)是一种具有多重生物学活性的脂肪因子[1],可通过促进胰岛素抵抗、引起向心性肥胖、影响糖脂代谢和参与慢性炎症反应等作用导致动脉粥样硬化[2-3]。同型半胱氨酸(homocysteine,Hcy)也可通过多种途径引起动脉粥样硬化[4]。因此,RBP4、Hcy和血脂在动脉粥样硬化的形成和发展过程中可能有相互作用和协同作用[5]。目前,有关动脉粥样硬化的发生机制及其各因子在其中所起的作用尚未被完全阐明,特别是关于Hcy与RBP4相关关系的研究很少。为此,本研究拟通过颈动脉内膜中层厚度(intima-medium thickness,IMT)这一动脉粥样硬化早期指标分析RBP4、Hcy、血脂与动脉粥样硬化的关系,为动脉粥样硬化发生机制的研究提供相关依据。
1 材料和方法
1.1 研究对象
选取2017年7月—2018年11月在昆明医科大学附属延安医院进行颈动脉IMT测量的门诊、住院和体检患者236例,其中男123例、女113例,年龄(63.14±9.23)岁,包括高血压70例、冠心病35例、脑梗死22例、其他疾病(支气管炎、心悸待查、头晕待查等)109例。排除患2型糖尿病、肾功能不全、甲状腺功能减退患者,以及服用氨甲喋呤、抗癫痫药物的患者。根据超声测量结果,将IMT<1 mm的患者纳入IMT正常组(39例),将IMT≥1 mm的患者纳入IMT增厚组(197例)[6]。2个组之间年龄和性别差异均无统计学意义(P>0.05)。
1.2 方法
1.2.1 样本采集 采集所有患者测定IMT当日空腹静脉血3~5 mL,625×g 离心10 min,分离血清,于-70 ℃保存待用。
1.2.2 IMT测量 采用550型B超机(探头频率7~12 MHz,美国惠普公司)分别检查患者颈总动脉和分叉部、颈内、颈外动脉颅外段,舒张末期测量颈总动脉分叉处近端 1 cm后壁的IMT,测量 3 次,取平均值。
1.2.3 RBP4、Hcy和血脂相关指标检测 Hcy采用循环酶法检测,载脂蛋白A1(apolipoprotein A1,apo A1)和载脂蛋白B(apolipoprotein B,apo B)均采用免疫透射比浊法检测,试剂盒(批号分别为18-0302、18-0421、18-0416)均购自北京九强公司。总胆固醇(total cholesterol,TC)采用胆固醇氧化酶法检测,三酰甘油(triglyceride,TG)采用磷酸甘油氧化酶-过氧化物酶法检测,试剂盒(批号分别为20180312、20180411)均购自上海科华公司。高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)采用选择性抑制法检测,低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)采用表面活性剂清除法检测,试剂盒(批号分别为811RFM、831RDP)均购自日本积水公司。生化复合室内质控血清购自美国赛默飞世尔公司。检测仪器为AU5421全自动生化分析仪(美国贝克曼库尔特公司)。RBP4采用酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)测定,试剂盒(批号201711)购自美国R&D公司,检测仪器为iMark酶标仪(美国伯乐公司)。所有项目均在室内质控在控的情况下测定。
1.3 统计学方法
采用SPSS 22.0软件进行统计分析。呈正态分布的数据以±s表示,2个组之间比较采用t检验。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Mann-Whitney U检验。采用Spearman相关分析评估各项目之间的相关性。采用Logistic回归分析评估各项指标之间的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 IMT正常组与IMT增厚组各项指标的比较
IMT增厚组TG、LDL-C、Hcy和RBP4水平均高于IMT正常组(P=0.000),HDL-C和apo A1水平均低于IMT正常组(P=0.000)。TC和apo B水平2个组之间差异无统计学意义(P>0.05)。见表1。

表1 IMT正常组和IMT增厚组各项指标的比较
2.2 各项目之间的相关性分析
对IMT正常组与IMT增厚组之间差异有统计学意义的项目(TG、LDL-C、Hcy、RBP4、HDL-C和apo A1)进行Spearman相关分析。结果显示,R B P 4与T G呈正相关(r=0.745,P<0.05),与HDL-C和apo A1呈负相关(r值分别为-0.727、-0.512,P<0.05);TC与LDL-C、apo B呈正相关(r值分别为0.881、0.852,P<0.05);TG与HDL-C、apo A1呈负相关(r值分别为-0.682、-0.353,P<0.05)。其他各项目之间均无相关性(P>0.05)。见表2。
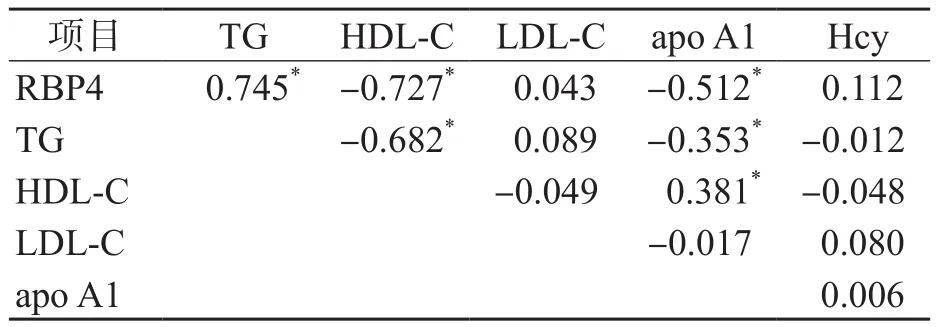
表2 各项目之间的r值
2.3 RBP4与其他项目的线性回归分析
以RBP4为因变量,TG、HDL-C、apo A1为自变量,进行线性回归分析。
RBP4(Y)与TG(X)的回归方程为Y=32.07X-15.30(r=0.745,P<0.05)。TG在3.5 mmol/L处有1个折点,部分TG>3.5 mmol/L的患者RBP4水平急剧升高,部分患者RBP4水平升高不明显。见图1。
RBP4(Y)与HDL-C(X)的回归方程为Y=-77.62X+129.3(r=0.452,P<0.05)。因方程得出的r值较小,进行曲线拟合。结果显示,RBP4与HDL-C的三次方程得出的相关性最好,回归方程为Y=-190.84X3+963.61X2-1 493.03X+746.06(r=0.861,P=0.000)。见图1。
RBP4(Y)与apo A1(X)的回归方程为Y=-92.739X+166.40(r=0.420,P<0.05)。因方程得出的r值较小,进行曲线拟合。结果显示,RBP4与apo A1的三次方程得出的相关性最好,回归方程为Y=-342.66X3+1 571.76X2-2 372.02X+1 212.93(r=0.670,P=0.000)。见图1。

图1 RBP4与TG、HDL-C、apo A1的回归分析
以RBP4为因变量,血脂相关指标和Hcy作为自变量,用逐步法进行多重回归分析,得出的回归方程为RBP4=40.27+29.43×TG-40.18×apo A1(P<0.05)。
3 讨论
目前,我国心脑血管疾病的发病率逐年升高,且发病年龄有年轻化的趋势[7]。颈动脉内膜中层增厚是颈动脉粥样硬化的早期征象。血脂是最早被发现和研究的与动脉粥样硬化相关的因素,其代谢异常是导致动脉粥样硬化的主要原因,主要机制包括血管内皮损伤、脂质沉积导致最终斑块形成和破裂[8]。Hcy是近年来发现的心血管疾病的风险因子,其导致动脉粥样硬化的机制有:(1)对血管内皮细胞的毒性作用;(2)干扰脂代谢正常途径;(3)促进血管平滑肌细胞增生[9];(4)影响凝血机制;(5)蛋白质Hcy化[10-11]。脂质代谢异常是动脉粥样硬化发生的前提。有研究结果显示,在多种疾病中,RBP4与一些发生异常代谢的脂质或脂蛋白,如TG、TC、LDL-C呈正相关,与HDL-C呈负相关[12],与本研究部分结果一致。RBP4与脂代谢相关的机制可能是:RBP4能活化维甲酸受体(retinoic acid receptor,RAR)/维甲类X受体(retinoid X receptor,RXR)信号途径,使脂蛋白酯酶的激动剂血清载脂蛋白CⅢ表达上调,抑制极低密度脂蛋白(very low-density lipoprotein,VLDL)分解,从而间接使VLDL升高,HDL-C降低[13];潴留的VLDL通过胆固醇酯化转运蛋白途径转化为TG和TC,导致血清TC和TG水平升高[14]。本研究结果显示,RBP4与TG呈正相关(r=0.745,P<0.05),但与TC无相关性(r=0.046,P>0.05)。具体原因有待进一步研究。
Hcy一直被认为是动脉粥样硬化和心脑血管疾病发生的独立危险因素,其导致动脉粥样硬化的机制可能是干扰脂质代谢,导致脂质代谢紊乱[15]。对于高Hcy水平的患者,长期服用B族维生素和叶酸可有效降低Hcy水平[16],但通过上述治疗并不能显著改变动脉粥样硬化的进程和降低心脑血管事件的发生率[17]。这也使学者们推测Hcy可能不是导致动脉粥样硬化的因素,只是动脉粥样硬化代谢过程中的一个产物[18],但这个观点目前还没有被明确的证据证明。本研究结果显示,Hcy与RBP4和血脂相关指标之间均无相关性(P>0.05)。
本研究在课题设计之初考虑到样本留取的难度,未局限于某一种单一疾病,而选择了动脉粥样硬化这一多种疾病共有的病变,这可能会引入一些混杂因素。然而,在动脉粥样硬化的发生、发展过程中,血脂、Hcy、RBP4等仍是目前公认的危险因素,分析这些指标之间的关系可为研究动脉粥样硬化的致病机制及各种因素在其中所起的作用提供一定的参考。
