慢性丙型肝炎患者血浆IRF-3水平的变化及临床意义
2021-06-07叶松道陈允国叶宣梅
叶松道, 陈允国, 叶宣梅
(温州医科大学附属第二医院临床检验中心,浙江 温州 325027)
丙型肝炎是由丙型肝炎病毒(hepatitis C virus,HCV)感染引起的以肝脏疾病和肝外疾病为特征的进展性疾病,全球范围内HCV感染者超过1.85亿[1]。HCV感染后如不能及时清除病毒,易发展为慢性丙型肝炎(chronic hepatitis C,CHC),而CHC是肝硬化、肝细胞癌的主要病因之一,因此对丙型肝炎慢性化机制的研究以及如何提高治疗应答率是目前临床关注的热点[2]。干扰素调节因子(interferon regulatory factor,IRF)是一类能对干扰素的基因表达进行调控的转录因子,与病原体的免疫应答、细胞因子的信号转导及细胞的增殖调控等关系密切。IRF-3作为IRF家族中的重要成员,在抗病毒反应过程中起非常重要的作用[3]。本研究拟探讨CHC患者血浆IRF-3水平在CHC诊断、治疗及发病机制中的意义。
1 材料和方法
1.1 研究对象
1.1.1 CHC组 选取2017年9月—2018年8月温州医科大学附属第二医院感染内科就诊的CHC患者57例,其中男32例、女25例,年龄10~76岁,均符合《丙型肝炎防治指南(2015年更新版)》[4]中的诊断标准。入选标准:HCV感染超过6个月,或有6个月前的流行病学史,抗HCV抗体及HCV RNA阳性,肝脏组织病理学检查符合慢性肝炎的特征,3个月内未接受抗病毒治疗、未使用免疫调节剂,能接受PR方案[聚乙二醇干扰素α(每次180 μg,每周1次,皮下注射)+利巴韦林(800~1 000 mg/d)]治疗并签署知情同意书。排除标准:合并慢性乙型肝炎等其他病毒性肝炎者,合并酒精性肝病、药物性肝损伤、自身免疫性肝炎等其他肝病以及人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染、恶性肿瘤、严重心脑血管疾病、血液系统疾病、甲状腺疾病、糖尿病者,病历资料不全导致影响疗效和安全性判断者。本研究经温州医科大学附属第二医院伦理委员会批准,所有研究对象均为浙江地区非血缘汉族个体。
1.1.2 正常对照组 选取温州医科大学附属第二医院体检中心健康体检者26名,其中男15名、女11名,年龄13~74岁,肝功能正常,无肝病、肾病、血液病、自身免疫性疾病和心脑血管疾病的病史,排除甲、乙、丙、丁、戊型肝炎病毒和巨细胞病毒等感染。
1.1.3 疗效判断 所有CHC患者均采用PR方案治疗,基本疗程为48周。治疗前及治疗第4、12、24、48周检测其HCV RNA载量,评估病毒应答情况,并据此调整药物剂量。疗效判断[4]:(1)快速病毒学应答,治疗第4周HCV RNA载量<5.0×102拷贝/mL;(2)早期病毒学应答,治疗第12周HCV RNA载量较治疗前下降>2log;(3)无应答:治疗第12周 HCV RNA载量较治疗前下降<2log;(4)持续病毒学应答,治疗结束后第12周和第24周HCV RNA<5.0×102拷贝/mL。
1.2 方法
1.2.1 样本采集 采集所有对象空腹静脉血3~4 mL,置于乙二胺四乙酸二钾抗凝管中,立刻上下颠倒混匀10次,1 500×g离心5 min,分离血浆,置于-40 ℃保存,用于检测IRF-3、β-干扰素(beta-interferon,IFN-β)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、Ⅳ型胶原(type Ⅳ collagen,CⅣ)水平及HCV RNA载量。
1.2.2 血浆IRF-3、IFN-β水平测定 采用双抗体夹心酶联免疫吸附试验检测血浆IRF-3、IFN-β水平,试剂盒购自江苏晶美生物科技有限公司,检测仪器为Anthos 2010型酶标仪(上海博赛思科技有限公司)。严格按仪器和试剂盒说明书进行操作。
1.2.3 HCV RNA定量分析 采用逆转录荧光定量聚合酶链反应定量检测HCV RNA载量,试剂盒购自深圳匹基生物工程公司,检测仪器为ABI 7500荧光定量PCR仪(美国ABI公司)。严格按仪器和试剂盒说明书进行操作。以HCV RNA≥5×102拷贝/mL为异常。参考《丙型肝炎防治指南(2015年更新版)》[4],根据血浆HCV RNA载量将CHC患者分为HCV RNA高载量组(HCV RNA≥4×105拷贝/mL)和HCV RNA低载量组(HCV RNA<4×105拷贝/mL)。
1.2.4 血浆CⅣ水平测定 采用MAGLUMI 2000全自动化学发光免疫分析仪(深圳新产业生物有限公司)及配套试剂(化学发光法)检测血浆CⅣ水平,参考区间为0~30 ng/mL。根据血浆CⅣ检测结果,将CHC患者分为CⅣ升高组(CⅣ>30 ng/mL)和CⅣ正常组(CⅣ≤30 ng/mL)。
1.2.5 血浆ALT水平测定 采用ADVIA2400全自动生化分析仪(德国西门子公司)及配套试剂(速率法)、校准品检测血浆ALT水平,参考区间为10~49 U/L。根据血浆ALT检测结果,将CHC患者分为ALT升高组(ALT>49 U/L)和ALT正常组(ALT≤49 U/L)。
1.3 统计学方法
采用SPSS 23.0软件进行统计分析。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用两独立样本的秩和检验。采用Spearman秩相关分析评估各项目之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 CHC组与正常对照组血浆IRF-3、IFN-β水平的比较
CHC组血浆IRF-3 、IFN-β水平明显低于正常对照组(P<0.01)。见表1。
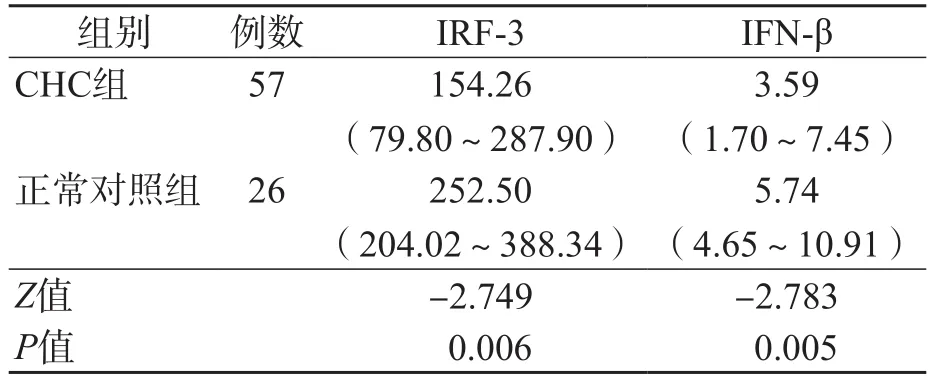
表1 CHC组与正常对照组血浆IRF-3、IFN-β水平的比较 M(P25~P75),pg/mL
2.2 CHC患者血浆IRF-3水平与血浆ALT、CⅣ水平及HCV RNA载量的关系
ALT升高组与ALT正常组之间、CⅣ升高组与CⅣ正常组之间、HCV RNA高载量组与HCV RNA低载量组之间血浆IRF-3水平差异均有统计学意义(P<0.05)。见表2~表4。
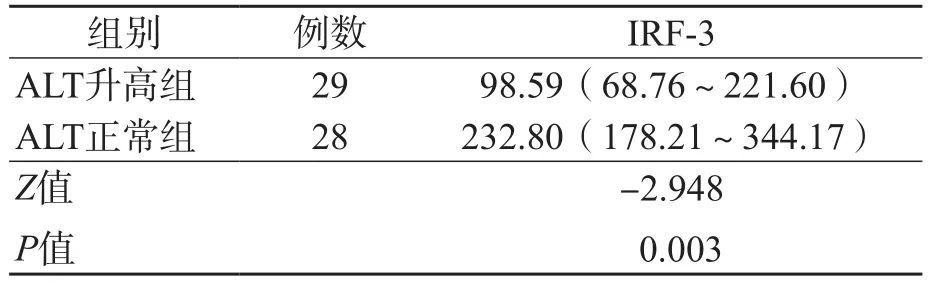
表2 ALT升高组与ALT正常组血浆IRF-3水平的比较 M(P25~P75),pg/mL
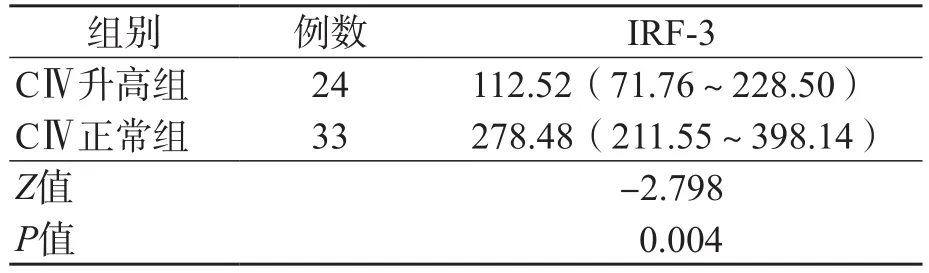
表3 CⅣ升高组与CⅣ正常组血浆IRF-3水平的比较 M(P25~P75),pg/mL
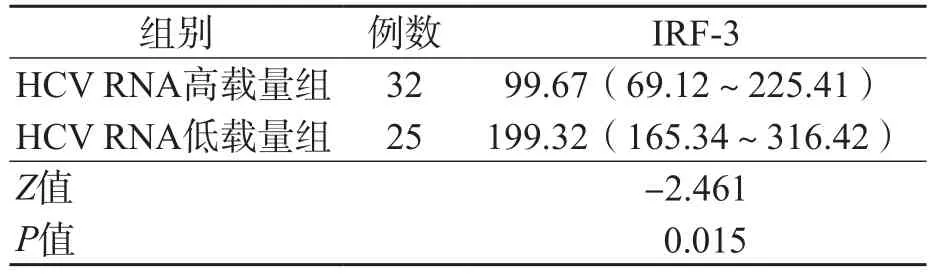
表4 HCV RNA高载量组与低载量组血浆IRF-3水平的比较 M(P25~P75),pg/mL
Spearman秩相关分析结果显示,CHC患者IRF-3与IFN-β呈正相关(r=0.930,P<0.01),与HCV RNA、ALT、CⅣ均呈负相关(r值分别为-0.321、-0.290、-0.345,P<0.05)。IFN-β与HCV RNA、ALT、CⅣ均呈负相关(r值分别为-0.297、-0.294、-0.302,P<0.05)。
2.3 CHC患者血浆IRF-3、IFN-β水平与干扰素疗效的关系
57例CHC患者中失访7例。根据疗效将完成随访的50例患者分为应答组(27例,包括早期应答、延迟应答、部分应答)、无应答组(23例)。应答组血浆IRF-3水平低于无应答组(P<0.05),血浆IFN-β水平2个组之间差异无统计学意义(P>0.05)。见表5。
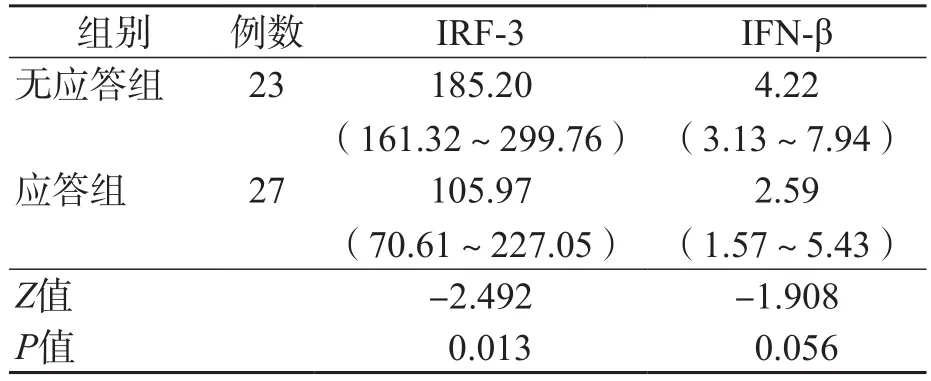
表5 无应答组与应答组IRF-3、IFN-β水平的比较 M(P25~P75),pg/mL
3 讨论
HCV是引发慢性肝炎的主要病原体之一,由于HCV感染分布广、慢性率高,且缺乏有效的HCV疫苗,因此已成为威胁人类健康的重大公共卫生问题。据统计,仅有20%~30%的HCV感染者可自发清除病毒,而70%~80%的感染者会持续感染,约有30%的CHC最终发展成肝硬化和肝细胞肝癌[1]。丙型肝炎患者肝脏损伤的主要原因是HCV感染后引起的免疫学应答,其中细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)起重要作用[5]。丙型肝炎慢性化的机制尚未被阐明,一般认为是宿主免疫、遗传易感性和HCV共同作用的结果。
IRF在病原体的免疫应答、细胞因子的信号转导、细胞的增殖调控、造血干细胞的发育分化和肿瘤的免疫应答等方面起重要作用。IRF-3作为IRF家族中的重要成员,在病毒感染早期与IFN基因表达的高低有关[6]。IRF-3主要的功能是诱导Ⅰ型干扰素、干扰素刺激基因(interferonstimulated gene,ISG)和促炎细胞因子的生成。有研究发现,乙型肝炎病毒、HCV、HIV等多种病毒能与细胞表面受体结合,导致细胞质内的IRF-3迅速活化,启动ISG转录,促进细胞因子生成,阻止病毒的复制和扩散[7]。当病毒进入宿主细胞开始复制后,病毒成分能够通过多种途径抑制IRF-3的表达、磷酸化和核转移,这是病毒逃避固有免疫应答的方式之一[8]。
本研究结果显示,CHC患者血浆IRF-3、IFN-β水平明显低于正常对照者,且IRF-3与IFN-β呈正相关(r=0.930,P<0.01),与HCV RNA、ALT及CⅣ均呈负相关(r值分别为-0.321、-0.290、-0.345,P<0.05)。血浆ALT水平的高低与患者肝细胞的损伤程度有关,在一定程度上可以反映病情的严重程度。CⅣ是基底膜的主要成分,是反映肝纤维化进程的良好指标,对肝硬化的诊断有重要的临床价值[9]。HCV RNA载量不仅是判断HCV感染的主要依据,也是CHC患者干扰素疗效判断的重要参数[10]。IRF-3可能通过调控Ⅰ型干扰素(α-干扰素和IFN-β)的表达参与HCV复制、肝细胞损伤及肝纤维化过程。因此,血浆IRF-3水平或可作为HCV感染潜在的诊断标志物。丙型肝炎直接抗病毒(direct-acting antiviral agent,DAA)药物具有很多优势,有部分药物已在我国上市,但其使用尚处于临床初始阶段,针对不同人群的用药经验相对不足,而且DAA药物的费用较高,因此PR方案仍是我国现阶段治疗丙型肝炎的主要方法[11]。然而,CHC患者对PR方案标准疗程的持续应答率仅为50%~60%[12],原因除与HCV的数量、毒力及基因结构等有关[13-14]外,还与患者的性别、年龄及机体免疫状态密切相关[15]。本研究发现,应答组基线IRF-3水平明显低于无应答组(P<0.05),表明血浆IRF-3水平可能有助于干扰素疗效的判断。
总之,血浆IRF-3水平和CHC患者的HCV RNA载量、病情及干扰素疗效均有较密切的关系,或可作为炎症活动性和肝脏损伤程度的评价指标,对干扰素疗效的判定也有一定的价值。
