骨髓血管内皮生长因子水平在弥漫性大B细胞淋巴瘤疗效监测中的价值
2021-06-07郭娟荪
李 斌, 赵 冬, 黄 蓉, 郭娟荪
(1.安康市中医医院血液风湿科,陕西 安康 725000;2.延安大学附属医院检验科,陕西 延安 716000;3.安康市中心医院感染性疾病科,陕西 安康 725000)
在我国,非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)占恶性淋巴瘤的比例远高于霍奇金病(Hodgkin disease,HD)[1]。由于骨髓受累预示着NHL患者的治疗效果较差,且骨髓受累也会阻碍造血干细胞的生成,因此对NHL患者骨髓受累的评估至关重要。目前,NHL骨髓受累的临床诊断多采用骨髓穿刺活检,但穿刺所取的小片骨髓不能完整反映整个骨髓的病理状态,因此骨髓穿刺活检有一定的局限性[2]。更重要的是,骨髓检查只显示NHL患者骨髓受累的结果,并不能反映肿瘤细胞入侵骨髓的情况。为了更好地预测NHL患者肿瘤细胞入侵骨髓的风险,临床亟需寻找一种新的生物标志物。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种促血管生成的细胞因子,可通过增加血管通透性刺激新生血管的形成,促进肿瘤生长,在血管生成中起重要作用[3]。弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是NHL的常见类型之一,有研究结果显示,VEGF有望成为新的DLBCL临床诊断标志物[4]。目前,大部分研究在检测DLBCL患者VEGF水平时所用的样本为血清,由于在收集患者外周血时会发生凝血现象,此时血小板(platelet,PLT)会释放VEGF,导致血清VEGF水平升高。为此,本研究拟探讨骨髓VEGF水平在DLBCL疗效监测中的价值。
1 材料和方法
1.1 研究对象
选取2012年1月—2016年1月来安康市中医医院接受治疗的DLBCL患者40例(男22例、女18例,年龄26~80岁),其中临床分期Ⅰ期4例、Ⅱ期10例、Ⅲ期7例、Ⅳ期19例。40例DLBCL患者中有8例发生骨髓侵入,32例未发生骨髓侵入;有18例发生结外侵入,22例未发生结外侵入。美国东部肿瘤协作组(the Eastern Cooperative Oncology Group,ECOG)评分0分15例、1分22例、≥2分3例;国际预后指数(international prognosis index,IPI)评分0~1分10例、2分11例、3分12例、4分7例。所有患者均采用利妥昔单抗联合CHOP方案(环磷酰胺、吡柔比星、长春新碱和泼尼松)治疗6个疗程。本研究获得安康市中医医院医学伦理学委员会批准,所有研究对象均知情同意。
1.2 纳入和排除标准
1.2.1 纳入标准 经骨髓穿刺活检和全血细胞计数确诊为DLBCL,无其他脏器衰竭,无相关恶性肿瘤、自身免疫疾病及器官移植病史,由患者本人或直系亲属签署知情同意书,同意提供患者的详细资料。
1.2.2 排除标准 合并心、肝、脾、肺、肾等器官损伤者,既往存在乙醇依赖或毒品依赖者,未签署科研研究知情同意书者。
1.3 疗效评价
采用Cheson标准评价疗效[5]。(1)完全缓解(complete response,CR):所有的病灶证据均消失;(2)部分缓解(partial response,PR):可测量病灶缩小,无新病灶;(3)疾病稳定(stable disease,SD):未达CR、PR或疾病进展(progressive disease,PD);(4)PD:出现任何新增加的病灶或原病灶直径增大≥50%。根据疗效将所有患者分为治疗有效组(28例)和治疗无效组(12例)。CR和PR为治疗有效,SD和PD为治疗无效。
1.4 方法
参照文献[6]采集患者治疗后骨髓样本,1 006×g离心10 min,分离骨髓中的血浆,-80 ℃保存待检。采用酶联免疫吸附试验检测骨髓VEGF水平,试剂盒购自美国R&D公司。采用RT7200全自动血液分析仪(深圳雷杜公司)及配套试剂检测骨髓PLT。采用速率法检测乳酸脱氢酶(lactate dehydrogenase,LDH),试剂盒购自上海经科化学科技有限公司,检测仪器为AU2700全自动生化分析仪(日本奥林巴斯公司)。计算VEGF/PLT比值。
1.5 随访
临床医师通过门诊复查病例资料和电话随访获取相关信息,随访至患者死亡或2019年1月31日。患者从开始接受治疗到观察到疾病发生进展或任何原因导致的死亡之间的时间为无进展生存时间(progression free survival,PFS),治疗开始至死亡或末次随访日期为总生存时间(overall survival time,OS)。本研究随访时间为13~58个月,中位随访时间为36.2个月。
1.6 统计学方法
采用SPSS 19.0软件进行统计分析。呈正态分布的数据以x±s表示,2个组之间比较采用t检验。计数资料以率表示,组间比较采用χ2检验,当1<理论数<5时采用χ2校正检验,当理论数<1时采用Fisher确切概率法。采用Spearman相关分析评估各参数间的相关性,采用非线性相关性分析评估非等级相关资料的相关性。绘制Kaplan-Meier生存曲线。采用Cox比例风险回归模型进行多因素分析,确定影响患者OS和PFS的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 不同临床病理参数DLBCL患者之间VEGF、PLT计数及VEGF/PLT比值的比较
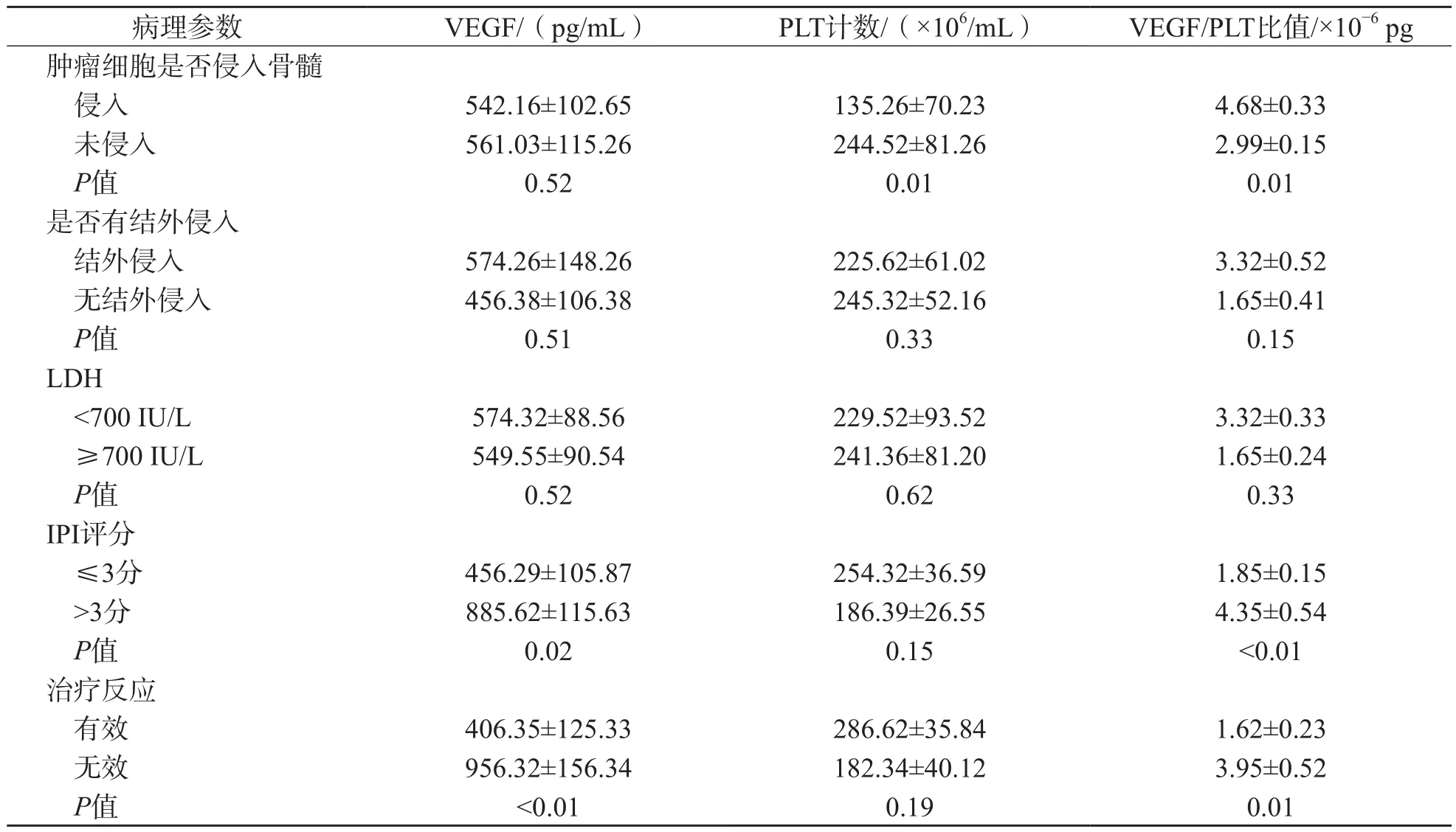
年龄≥65岁、ECOG评分≥2分、IPI评分>3分、治疗无效的DLBCL患者骨髓VEGF水平分别高于年龄<65岁、ECOG评分<2分、IPI评分≤3分、治疗有效的DLBCL患者(P<0.05),PLT计数差异无统计学意义(P>0.05)。肿瘤细胞未侵犯骨髓的DLBCL患者PLT计数高于肿瘤细胞侵犯骨髓的DLBCL患者(P<0.05),骨髓VEGF水平差异无统计学意义(P>0.05)。年龄≥65岁、肿瘤细胞侵入骨髓、IPI评分>3分、治疗无效的DLBCL患者VEGF/PLT比值分别高于年龄<65岁、肿瘤细胞未侵入骨髓、IPI评分≤3分、治疗有效的DLBCL患者(P<0.05)。见表1。
表1 不同临床病理参数DLBCL患者之间骨髓VEGF、PLT计数及VEGF/PLT比值的比较 ±s

表1 不同临床病理参数DLBCL患者之间骨髓VEGF、PLT计数及VEGF/PLT比值的比较 ±s
病理参数 VEGF/(pg/mL) PLT计数/(×106/mL) VEGF/PLT比值/×10−6 pg性别男性 542.25±125.23 225.65±22.56 2.74±0.16女性 559.65±124.62 256.52±22.59 2.21±0.12 P值 0.85 0.16 0.55年龄<65岁 335.65±56.59 254.62±26.36 1.62±0.15≥65岁 652.38±57.52 209.61±65.25 3.55±0.12 P值 0.03 0.33 <0.01临床分期Ⅰ~Ⅱ 586.62±102.36 235.62±63.23 1.95±0.06Ⅲ~Ⅳ 526.34±112.63 240.11±66.59 3.05±0.14 P值 0.59 0.09 0.26 ECOG评分0~1分 552.64±128.62 236.52±36.58 2.26±0.08≥2分 1025.81±142.95 255.47±55.26 4.06±0.21 P值 0.03 0.52 0.16
续表1 ±s
续表1 ±s
病理参数 VEGF/(pg/mL) PLT计数/(×106/mL) VEGF/PLT比值/×10−6 pg肿瘤细胞是否侵入骨髓侵入 542.16±102.65 135.26±70.23 4.68±0.33未侵入 561.03±115.26 244.52±81.26 2.99±0.15 P值 0.52 0.01 0.01是否有结外侵入结外侵入 574.26±148.26 225.62±61.02 3.32±0.52无结外侵入 456.38±106.38 245.32±52.16 1.65±0.41 P值 0.51 0.33 0.15 LDH<700 IU/L 574.32±88.56 229.52±93.52 3.32±0.33≥700 IU/L 549.55±90.54 241.36±81.20 1.65±0.24 P值 0.52 0.62 0.33 IPI评分≤3分 456.29±105.87 254.32±36.59 1.85±0.15>3分 885.62±115.63 186.39±26.55 4.35±0.54 P值 0.02 0.15 <0.01治疗反应有效 406.35±125.33 286.62±35.84 1.62±0.23无效 956.32±156.34 182.34±40.12 3.95±0.52 P值 <0.01 0.19 0.01
2.2 DLBCL患者骨髓VEGF水平与PLT计数的相关性
DLBCL患者骨髓VEGF水平与PLT计数呈正相关(r=0.33,P<0.05),见图1。

图1 DLBCL患者骨髓VEGF水平与PLT计数的相关性
2.3 治疗有效与治疗无效DLBCL患者骨髓VEGF水平、PLT计数及VEGF/PLT比值的比较
治疗有效组VEGF/PLT比值低于治疗无效组(P<0.05),而骨髓VEGF水平、PLT计数2个组之间差异均无统计学意义(P>0.05)。见表2。
表2 治疗有效组与治疗无效组骨髓VEGF水平、PLT计数及VEGF/PLT比值的比较 ±s
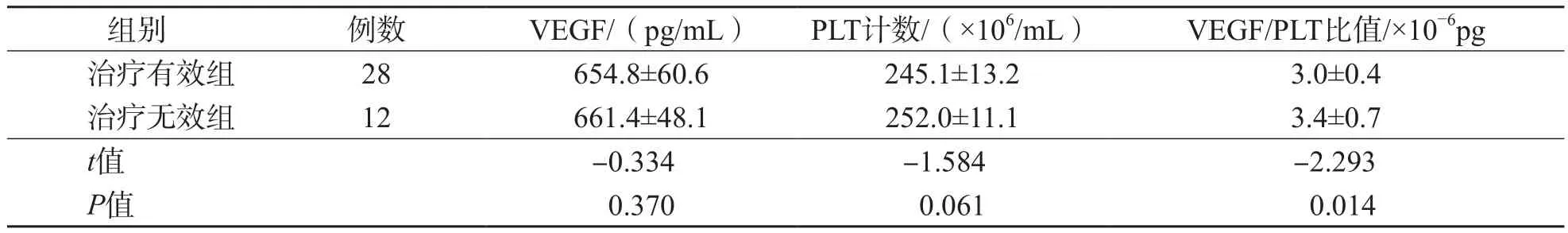
表2 治疗有效组与治疗无效组骨髓VEGF水平、PLT计数及VEGF/PLT比值的比较 ±s
注:空白表示无此项。
组别 例数 VEGF/(pg/mL) PLT计数/(×106/mL) VEGF/PLT比值/×10−6pg治疗有效组 28 654.8±60.6 245.1±13.2 3.0±0.4治疗无效组 12 661.4±48.1 252.0±11.1 3.4±0.7 t值 -0.334 -1.584 -2.293 P值 0.370 0.061 0.014
2.4 DLBCL患者的Kaplan-Meier生存曲线
按VEGF/PLT比值的均值分为<3×10-6pg组和≥3×10-6pg组。Kaplan-Meier生存曲线结果显示,VEGF/PLT比值<3×10-6pg组的PFS、OS高于VEGF/PLT比值≥3×10-6pg组(P<0.05)。见图2。
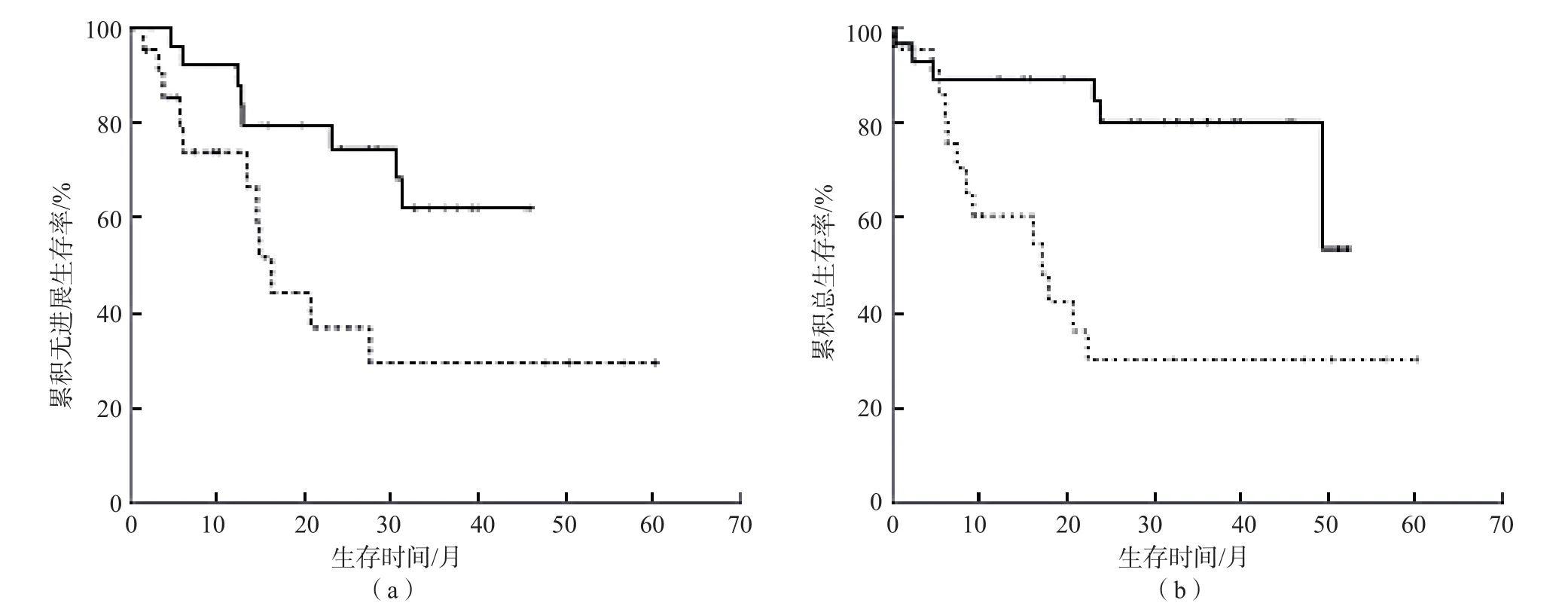
图2 不同VEGF/PLT比值DLBCL患者的Kaplan-Meier生存曲线
2.5 影响DLBCL患者PFS和OS的多因素分析
Cox比例风险回归分析结果显示,VEGF/PLT比值是影响DLBCL患者PFS的危险因素[风险比(hazard ratio,HR)=3.277,95%可信区间(confidence interval,CI)为2.276~5.901];ECOG评分、IPI评分、骨髓VEGF水平是影响DLBCL患者OS的危险因素(HR值分别为4.26、3.33、3.52,95%CI分别为3.102~5.466、2.257~5.009、2.620~4.104)。VEGF/PLT比值越大、ECOG评分越高、IPI评分越高、骨髓VEGF水平越高,DLBCL患者预后越差。见表3。

表3 DLBCL患者PFS和OS影响因素的多因素分析
3 讨论
目前,临床上治疗DLBCL的主要方法是抑制肿瘤血管再生[6]。近几年来,关于血管再生与造血系统肿瘤关系的研究取得了一定的进展,有学者发现血管再生对多种血液系统疾病都有重要的预后判断价值[7-8]。VEGF是重要的促血管生成因子,能够维持正常血管再生及成熟,促进内皮细胞活化及迁移[9]。当肿瘤细胞发生癌基因活化、血管内皮细胞增殖和巨噬细胞增殖时,VEGF均可通过自/旁分泌方式特异作用于血管内皮细胞受体,促进内皮细胞增殖,促进肿瘤生长[10]。有研究结果显示,VEGF水平高表达与肿瘤细胞侵袭转移有关[11-13]。VEGF在淋巴瘤、白血病、多发性骨髓瘤的发生、发展及转移中具有重要的临床价值[14]。柳晓雷[15]检测了急性白血病患者和无骨髓浸润淋巴瘤患者的血浆及骨髓中的VEGF水平,发现急性白血病患者骨髓VEGF水平显著高于血浆VEGF水平(P<0.05),而无骨髓浸润的淋巴瘤患者血浆VEGF水平高于骨髓VEGF水平(P<0.05),提示在不同肿瘤及血液系统疾病中,VEGF的作用机制不同。因此,有必要对VEGF在不同疾病中的价值进行研究。
本研究除检测骨髓VEGF水平外,还选择PLT计数和VEGF/PLT比值作为骨髓VEGF表达的参照。主要原因在于骨髓富含造血细胞,骨髓中VEGF的来源不仅是肿瘤细胞,还可能包括血细胞,尤其是PLT。采用PLT计数校准的VEGF水平比VEGF水平本身与肿瘤发生的相关性更强[16]。在研究DLBCL患者的VEGF水平时引入PLT计数,可以从另一方面反映骨髓VEGF水平检测的临床价值。
本研究结果显示,VEGF水平与PLT计数呈正相关(r=0.33,P<0.05),但r值较低。这是因为在正常情况下,人体内的VEGF主要由PLT分泌,但当存在肿瘤时,肿瘤细胞也会分泌大量的VEGF,促进血管生长,以支持肿瘤的快速增殖。本研究结果显示,年龄≥65岁、ECOG评分≥2分、IPI评分>3分以及治疗无效的DLBCL患者骨髓VEGF水平较高,肿瘤细胞未侵入骨髓的DLBCL患者PLT计数较高,年龄≥65岁、肿瘤细胞侵入骨髓、IPI评分>3分以及治疗无效的DLBCL患者VEGF/PLT比值较高,与KIM等[17]的研究结果一致。本研究结果还显示,VEGF/PLT比值<3×10-6pg组的PFS、OS高于VEGF/PLT比值≥3×10-6pg组(P<0.05)。表明可将骨髓VEGF、VEGF/PLT比值判断DLBCL预后的临界值设为655 pg/mL、3×10-6pg,当骨髓VEGF<655 pg/mL、VEGF/PLT比值<3×10-6pg时,DLBCL患者的预后相对较好。VEGF水平过高,可刺激内皮细胞增生,增加肿瘤高血源性和高淋巴源性扩散的风险;VEGF/PLT比值偏大,提示VEGF水平过高或PLT数量偏少,不利于抗炎、止血、修复破损血管,有利于肿瘤细胞扩散。
总之,骨髓VEGF水平与DLBCL患者预后有关。随着研究的深入,关于VEGF在肿瘤中的作用机制以及VEGF基因和蛋白深层次的调控网络将被一一揭示,骨髓VEGF水平或可为血管形成相关疾病的诊断和治疗提供依据。
