无胆附子炮制工艺开发及其抗氧化活性研究
2021-06-07曹静静汪梦雯刘志超崔浪军
夏 飞, 曹静静, 冯 婕, 汪梦雯, 刘志超, 崔浪军
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.汉中市药材总公司, 陕西 汉中 723000; 3.陕西师范大学 生命科学学院 西北濒危药材资源开发国家工程试验室, 陕西 西安 710119)
0 引言
附子为毛茛科乌头属植物乌头Aconitum carmichaeli Debx.的子根,是临床治疗常用的中药材,具有回阳救逆,助阳补气,驱寒散湿的功效.现代研究表明,附子在心血管疾病、抗炎镇痛、免疫调节、抗肿瘤、抗衰老等方面具有显著治疗效果[1].附子药效成分中双酯型生物碱,属于附子所含生物碱中有较强毒性的一类[2];而单酯型生物碱则是附子的药效物质基础[3].因此,附子的临床应用需经过加工炮制,将毒性成分双酯型生物碱转换为有效成分单酯型生物碱,从而保证临床安全应用.
目前,附子加工炮制工艺多以胆巴炮制为主,胆巴本身具有一定毒性,经胆巴炮制后的附子易引入其它杂质[4],目前黑顺片的炮制过程中采用胆巴作为炮制辅料,胆巴中所含大量钙、镁等金属离子,具有较高的毒性[5,6].胆巴残留对人体消化系统、心血管系统和泌尿系统均有一定毒性和刺激作用[7].采用胆巴炮制附子过程中,后期为去除胆巴残留,使用清水冲洗也会使附子的有效成分流失[8].现代研究提出附子无胆炮制方式,以达到减毒增效目的[9].双酯型生物碱受热会进行水解,转换成毒性较小的单酯型生物碱[10],使毒性降低,增强附子临床应用效果.已有研究证实,无胆炒附片中单酯型生物碱含量明显高于黑顺片[11],同时,无胆炮制所得白附片中总生物碱、单酯型生物碱、双酯型生物碱含有量均高于传统胆巴炮制的白附片,且工艺简单、不易引入杂质[12].
中药往往具有良好的抗氧化活性,可作为潜在天然抗氧化剂[13],减少各种因素引起的自由基升高导致对细胞和组织的损伤[14].有关附子药理活性研究表明,附子可减少自由基的生成,并且加快其清除,具有一定抗氧化作用[15].目前,附子药理作用研究重点主要集中在对心血管、免疫、抗肿瘤方面的作用,其抗氧化作用及机制需要进一步研究确定.自由基清除力通常作为抗氧化能力关键指标,但自由基清除法会受待测物质成分组成、结构等因素影响,因此需同时测定被测物与多种自由基的清除效果,综合比较,以便更准确的分析其清除效果[16,17].因此,本文中进一步对附子浸提物的体外抗氧化活性开展研究,为附子的生产加工和进一步安全、有效的应用及推广奠定一定基础.
1 材料与方法
1.1 材料与试剂
生附片;乌头碱、次乌头碱、新乌头碱、苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱等标准品,均为色谱级;乙酸铵(分析纯);甲醇(色谱纯);盐酸(分析纯);乙腈(色谱纯);DPPH乙醇溶液;双氧水;邻苯三酚.
1.2 仪器设备
LS-C50L立式压力蒸汽灭菌锅(上海博迅医疗生物仪器股份有限公司);101-2型电热鼓风干燥箱(北京科伟永兴仪器有限公司);高速万能粉碎机(天津市泰斯特仪器有限公司);岛津LC-2030高效液相色谱仪(日本岛津株式会社);紫外分光光度计.
1.3 实验方法
1.3.1 单因素考察实验
以附子中单酯型生物碱和双酯型生物碱含量为考察指标,分别考察浸润水量、浸润时间、蒸制温度、蒸制时间、干燥温度5个因素对附子生物碱含量的影响.分别以干燥生附片与加入浸润清水量的定量比例(1∶0.4、1∶0.6、1∶0.8、1∶1.0、1∶1.2),喷淋润湿饮片,浸润5 h、10 h、15 h、20 h、25 h,蒸制温度为100 ℃、105 ℃、110 ℃、115 ℃、120 ℃,分别蒸制20 min、30 min、40 min、50 min、60 min取出,烘干,干燥考察温度为60 ℃、70 ℃、80 ℃、90 ℃、100 ℃,分别得到无胆蒸制后的附子炮制饮片.粉碎过100目筛,测定样品中双酯型生物碱类及单酯型生物碱类成分的含量.
1.3.2 生物碱含量测定
(1)标准溶液的配制:称取乌头碱、次乌头碱、新乌头碱、苯甲酰乌头碱、苯甲酰次乌头碱、苯甲酰新乌头碱标准品各10 mg,用甲醇溶解并定容至10 mL容量瓶中,配制成质量浓度均为1.0 mg/mL的储备液,冰箱4 ℃保存.使用时,用流动相逐级稀释配制成系列工作溶液.所有样品经过分散液微萃取后所得提取液进样前均需用0.22μm的滤膜过滤.
(2)高效液相色谱条件:使用色谱柱规格采用Venusil XBP CI8(L) 色谱柱(4.6 mm*250 mm,5μm),柱温35 ℃,流动相A :2 mmol/L 乙酸铵溶液(含0.1%甲酸),流动相B:乙腈;洗脱程序:0~3 min,B为0%~8%;3~10 min,B为8%~20%;10~15 min,B为20%~35%;15~35 min,B为35%~50%.流速1 mL/min,进样量均为10μL.
(3)供试溶液配制:精确称取附子粉末1.000 g于50 mL试管中,加入5 mL 0.05 mol/L盐酸,充分混匀,超声30 min.6 000 r/min离心10 min,吸取上清液0.5 mL,与2 mL甲醇混匀,将混合液通过0.22μm微孔有机滤膜过滤,制成供试样品液.测定其单酯型生物碱和双酯型生物碱含量.
(4)标准曲线绘制:称取乌头碱、次乌头碱、新乌头碱、苯甲酰乌头碱、苯甲酰次乌头碱、苯甲酰新乌头碱标准品各10 mg,用甲醇溶解并定容至10 mL容量瓶中,配制成质量浓度均为1.0 mg/mL的储备液,用流动相逐级稀释配制成系列工作溶液.以峰面积(Y)为纵坐标,对照品浓度(X)为横坐标,进行线性回归分析,计算回归方程和相关系数.
(5)方法学验证:精密度试验测定新乌头碱、乌头碱、次乌头碱、苯甲酰新乌头原碱、苯甲酰乌头原碱和苯甲酰次乌头原碱的RSD值;稳定性试验测定 6 种生物碱的峰面积RSD.重复性试验测定6 种生物碱的RSD;加样回收率试验测定回收率.
1.3.3 正交试验设计
在单因素实验基础上,根据单因素测定结果选择4个主要因素进行4因素3水平的正交设计,展开正交试验,分别测定各条件下无胆蒸制附片的单酯生物碱和双酯生物碱含量,根据正交试验结果优选最佳无胆蒸制附片的炮制工艺.
1.3.4 附子体外抗氧化活性
将附子生附片、无胆蒸附片粉碎,准确称取粉末2 g,加入200 mL蒸馏水,沸水浴煎煮30 min,离心,取上清液,浓度记为10 mg/mL,并稀释至8 mg/mL,6 mg/mL,4 mg/mL,2 mg/mL,分别测定各浓度样品溶液DPPH清除率[18]、羟基自由基的清除率[19]、超氧阴离子清除率[20].每个样品重复测定三次,取平均值.以Vc作为对照进行测定.
2 结果与讨论
2.1 单因素筛选结果
2.1.1 加入浸润水量对附子单酯型生物碱含量的影响
无胆蒸附片有效成分单酯生物碱含量随加入浸润清水量的增加呈降低趋势,浸润干燥生附片,加入清水量为1∶0.4时,单酯生物碱含量值显示为最大值0.033 7%,当浸润水量为1∶1时,单酯生物碱含量降至0.015 2%,如图1所示.浸润过程中,单酯生物碱成分可能会随浸润液存在一定程度的流失[8],为避免有效成分过多流失,因此选择加入浸润水量比例为1∶(0.4~0.8)范围进行正交试验考察.

图1 浸润水量对附子单酯生物碱含量的影响
浸润时间对无胆蒸附片单酯型生物碱成分的含量影响总体呈降低趋势,浸润时间5 h,单酯型生物碱含量为0.025 3%,当浸润时间延长至15 h,单酯生物碱含量为0.025 5%,随着浸润时间的增加,20 h时,单酯型生物碱含量降低至0.019 3%(图2),综合考虑炮制工艺时长及成本,故而正交试验中选定浸润时间为5 h,进行实验考察.

图2 浸润时间对附子单酯生物碱含量的影响
2.1.3 蒸制温度对附子单酯型生物碱含量的影响
无胆蒸附片有效成分单酯生物碱含量随着蒸制温度的升高呈增加趋势,当温度为100 ℃时,单酯生物碱含量为0.017 1%,温度升高至110 ℃时,单酯生物碱含量随之升高至0.020 8%,120 ℃时,单酯生物碱含量高达0.025 7%(图3).因附子炮制过程中,毒性成分双酯型生物碱受热会水解为有效成分单酯型生物碱,从而使得单酯型生物碱含量增加,以发挥减毒增效的作用[21],同时,考虑工业生产条件的可控性及经济成本等因素,选择110 ℃~120 ℃的蒸制温度范围进行正交实验考察.

图3 蒸制温度对附子单酯生物碱含量的影响
2.1.4 蒸制时间对附子单酯型生物碱含量的影响
无胆蒸附片有效成分单酯生物碱含量随蒸制时间的延长,整体呈下降趋势,蒸制时间为30~50 min时,单酯生物碱含量变化趋于稳定为0.017 4%~0.017 8%,但在蒸制时长达60 min时,含量有所下降,为0.014 2%(图4).由于附子炮制过程中,单酯型生物碱会在温度影响下,随时间的延长进而水解成醇胺类乌头原碱类生物碱,导致单酯生物碱含量测定结果降低[22],综合考虑减毒效果及炮制时长和有效成分的保留,选择40~60 min的蒸制时间范围进行正交实验考察.

图4 蒸制时间对附子单酯生物碱含量的影响
2.1.5 干燥温度对附子单酯型生物碱含量的影响
随着干燥温度的升高,无胆蒸制附片单酯生物碱含量呈增加趋势(图5),干燥温度为60 ℃时,单酯生物碱含量为0.024 5%,90 ℃时含量升高为0.025 7%,100 ℃干燥时,单酯生物碱含量升高至0.030 5%,考虑药材饮片储存要求以及加工生产成本,选择80 ℃~100 ℃的干燥温度范围进行正交实验考察.

图5 干燥温度对附子单酯生物碱含量的影响
基于单因素筛选的结果,加入浸润水量,蒸制温度,蒸制时间、干燥温度四个因素为正交实验主要考察因素,采用四因素三水平L9(34)正交设计,进行实验考察.
2.2 正交优化附子炮制条件结果
基于单因素筛选的结果,选择蒸制温度(A)、蒸制时间(B)、浸润水量(C)、干燥温度(D)为正交实验主要考察因素,采用四因素三水平L9(34)正交设计,正交设计如表1所示.
成虫、幼虫均为害小麦,以幼虫为害为主。成虫沿叶脉啃食叶肉,成白条状,不食下表皮,幼虫钻入新叶内舔食叶肉,叶面出现宽白条状食痕,造成叶面枯焦。

表1 正交设计各因素和水平表
根据正交设计四因素三水平L9(34)试验方案,共得到9组实验结果(表2),根据2020年版《中国药典》标准[23],附子单酯型生物碱含量不少于0.01%,双酯生物碱含量不得超过0.02%.从表2可得到,蒸制优选炮制条件为∶浸润水量1∶0.4,蒸制温度120 ℃,蒸制时间50 min,干燥温度100 ℃时,此时单酯生物碱含量为0.350 6%,结果可达到药典对2种生物碱含量的要求.

表2 正交试验方案及结果
由表2分析可知∶蒸制温度(A)、蒸制时间(B)、浸润水量(C)、干燥温度(D)4个因素极差R大小依次为:A>D>C>B;对正交实验结果进行方差分析(表3),蒸制温度因素结果差异显著,说明蒸制温度对单酯生物碱含量具有显著影响(P<0.05).

表3 方差分析
综合优选附子无胆蒸制最优条件组合为,即浸润水量1∶0.4、蒸制温度120 ℃、蒸制时间50 min、干燥温度100 ℃.所得蒸制附片中单酯类生物碱含量达0.308 5%,双酯生物碱含量减少至0.014 8%.该结果符合2020年版 《中国药典》 中有关要求.经高温无胆蒸制,可使毒性成分双酯生物碱快速转化为无毒单酯型生物碱,而且蒸制时间不宜过长,长时间蒸制可能会造成生物碱类成分流失[12].
2.3 生物碱含量检测方法学验证结果
本研究以附子6中生物碱成分为指标,采用高效液相方法测定附子炮制品的生物碱含量,以对照品进样量为横坐标(X),以峰面积为纵坐标(Y)绘制标准曲线,得到线性方程;并对液相方法的精密度、稳定性、重复性、加样回收率进行测定,结果如表4所示,线性关系、精密度、稳定性、重复性良好,加样回收率均97%以上.
2.4 生附片和无胆蒸附片生物碱含量测定结果
无胆蒸制附片与生附片中生物碱含量对比显示(图6),无胆蒸附片的有效成分单酯型生物碱含量为0.350 6%,生附片单酯型生物碱含量为0.075%,无胆蒸制工艺下附片的有效成分单酯生物碱含量高于生附片.同时蒸附片双酯生物碱含量为0.014 8%,生附片双酯生物碱含量为0.818 2%,生附片毒性成分远高于无胆蒸附片,无胆蒸制炮制工艺具有显著的减毒效果(P<0.01).
生附子生物碱成分主要为双酯型生物碱,且该类化合物可能导致严重急性毒性事件[24],同时双酯型生物碱稳定性也较差,经炮制可水解成药效活性强且毒性低的单酯型生物碱及原碱[10].随着附子炮制方式的持续研究,现代科学技术被普遍利用,利用双酯型生物碱受热易水解特性进一步研究附子炮制工艺,邓文伟等[25]采用烘箱烘烤加热法进一步探索质量合格的附子炮制工艺;贺亚男等[26]采用微波加热炮制法研究附子微波炮制工艺.本研究主要采取高温蒸制方式,进一步研究降低毒性,保留附子药效的炮制工艺,结果证明,高温蒸制方式简单、便捷、可推广.

表4 生物碱回归方程方法学验证
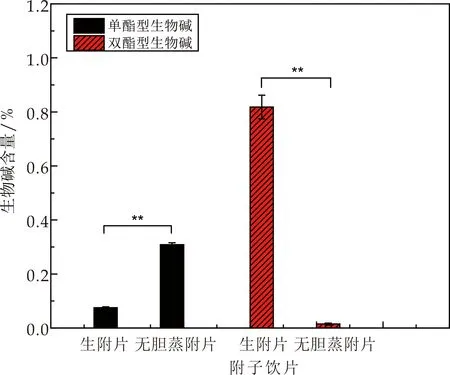
图6 无胆附子与生附片生物碱含量(“**”表示差异显著(P<0.01))
2.5 无胆蒸附片体外抗氧化活性
2.5.1 DPPH自由基清除能力
无胆蒸附片和生附片对DPPH自由基的清除率均存在一定量效关系(图7),当浓度在2 mg/mL时,无胆蒸附片清除率为71.8%,生附片为48.9%,同浓度的Vc对照清除率为96.4%,该浓度下无胆蒸附片DPPH自由基清除率高于生附片.当浓度升高至8 mg/mL时,无胆蒸附片清除率升高至89.0%,生附片也随之升高至86.9%.随着浓度增加,无胆蒸附片对DPPH自由基的清除率均呈上升趋势,具有较好清除效果.

图7 蒸附片对DPPH自由基清除率
2.5.2 超氧阴离子清除能力
测定生附片及无胆蒸附片对超氧阴离子清除率,结果如图8所示.无胆蒸附片对超氧阴离子的清除率随着浓度的增加,总体呈上升趋势.当浓度在4 mg/mL时,Vc对照清除率为56.5%,无胆蒸附片清除率为3.5%,生附片清除率为10.5%,当浓度在8 mg/mL时,无胆蒸附片清除率升高为11.7%,生附片清除率为15.6%,总体结果显示无胆蒸附片和生附片均对超氧阴离子具有一定清除效果.

图8 蒸附片对超氧阴离子清除率
2.5.3 羟基自由基清除能力
生附片及无胆蒸附片对羟基自由基的清除率随着浓度的增加,有一定升高趋势,如图9所示.当浓度为4 mg/mL时,无胆蒸附片清除率为16.027%,生附片在该浓度时清除率为10.745%,当浓度增加为8 mg/mL时,无胆蒸附片清除率升高为30.016%,大于生附片在该浓度时清除率值16.025%,无胆蒸附片清除率升高趋势大于生附片.
综合分析无胆蒸附片与生附片的抗氧化活性,两者对DPPH自由基、羟基自由基和超氧阴离子的清除效果差异不显著.此外,无胆蒸附片和生附片对羟基自由基和超氧阴离子清除效果相似,但对DPPH自由基清除能力略有升高,其可能与自由基的性质有关,DPPH自由基抗氧化效果更有助于抗氧化结果分析[27].
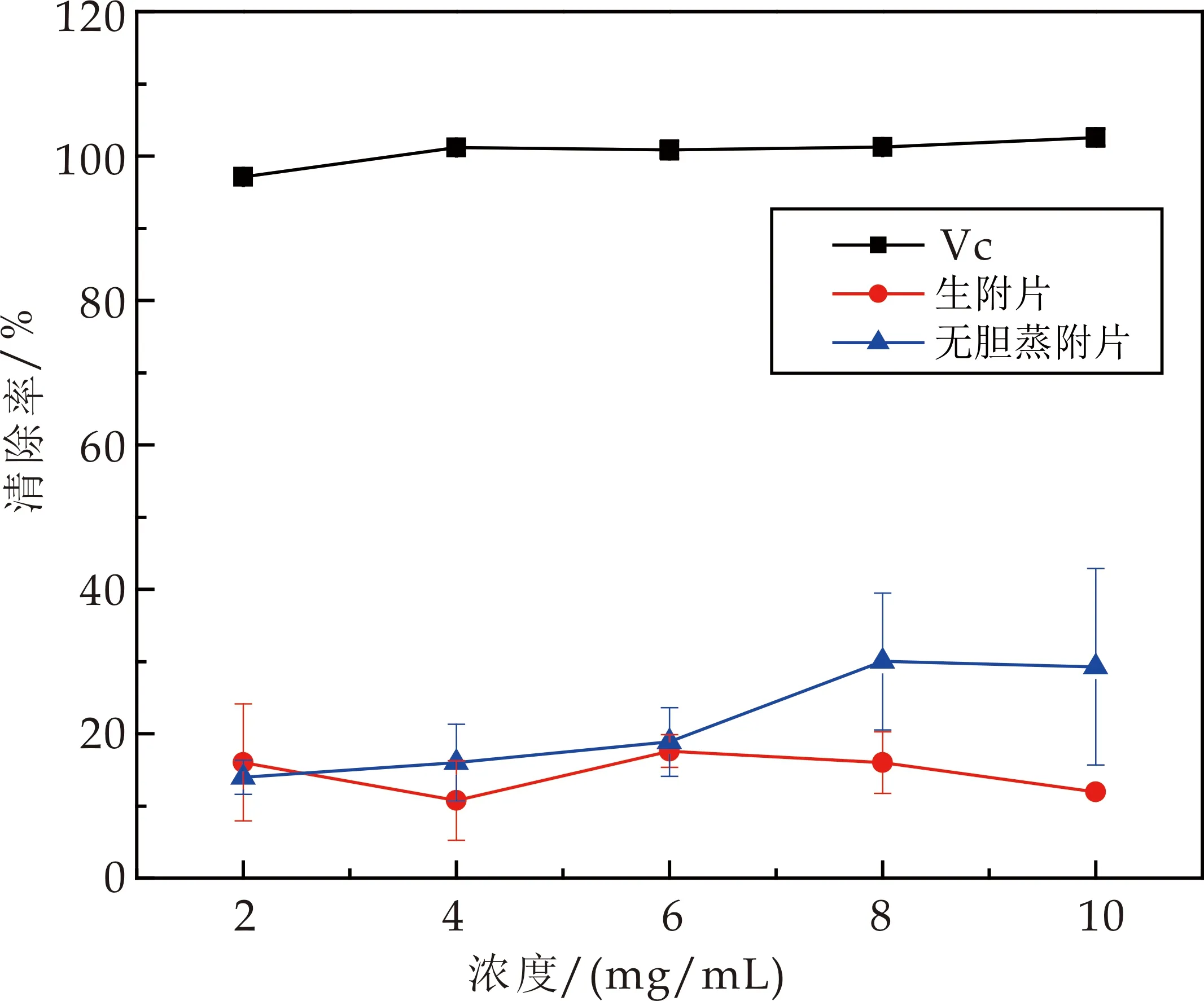
图9 蒸附片对羟基自由基清除率
3 结论
本研究采用正交试验分析得出最佳无胆蒸制工艺为:浸润干燥生附片、浸润水量为1∶0.4、蒸制温度120 ℃、蒸制时间50 min、干燥温度100 ℃.在该条件下所得无胆蒸附片单酯生物碱含量达0.350 6%,高于生附片单酯生物碱含量0.075 5%;同时,测定两者毒性成分双酯生物碱含量,无胆蒸附片双酯生物碱含量为0.014 8%,结果符合2020年版《中国药典》中对附子饮片单酯生物碱含量不得低于0.010%,双酯型生物碱含量不得超过0.020%的要求;无胆蒸附片对DPPH、羟基自由基以及超氧阴离子清除率具有一定的效果.
本研究炮制工艺方法简捷,能够缩短药材的炮制时间.同时,通过温度、时间的控制,避免过度炮制的倾向,降低附子毒性并保留有效成分,适合大规模的工业化生产应用,并为附子临床应用和选择提供参考价值.
