超声条件下蔗糖-6-月桂酸单酯及蔗糖-6’-月桂酸单酯的合成、纯化与结构鉴定
2013-09-04逯与运晏日安
逯与运,晏日安,马 祥
(暨南大学食品科学与工程系,广东广州510632)
蔗糖脂肪酸酯是一种重要的非离子型的表面活性剂,具有优良的增溶性、渗透性、乳化性、分散性、起泡性、防止淀粉老化及抗菌等性能,同时还具备无臭、无毒、无味、易被生物降解、无刺激性等优良特性,被广泛的应用于食品、药品、化妆品、洗涤剂及纺织行业中[1-6]。蔗糖与月桂酸酯的酯化反应复杂,产物种类多样,尽管单酯、二酯及多酯的混合物能应用于实际的生产生活中,但因单酯化度高的蔗糖脂肪酸酯的亲油亲水平衡值(HLB)较高,乳化性较好,另外不同位置的蔗糖脂肪酸单酯因其结构的差异而表现出不同的性质,比较得知蔗糖脂肪酸单酯具有更加广泛的用途。因此研究高效经济的蔗糖脂肪酸单酯的合成方法及不同单酯的分离纯化具有十分重要的意义。近年来超声产生的空化作用已经应用于诸多化学合成领域,超声波的高频振动不仅可以促进底物蔗糖的快速溶解,而且可以使底物均匀分散在溶剂中,提高底物与催化剂的有效碰撞次数,加速反应的进行[7]。现有的蔗糖脂肪酸酯的合成方法较多,提高单酯化度的方法也主要集中在催化剂的选择、酶催化反应过程中的酶种类的选择及反应条件的控制上,而在机械(电磁)波如微波、超声波等作用下探究提高单酯化合成方法的研究以及对合成的单酯进一步分离纯化的研究国内外均鲜有报道[8]。本文探讨了超声波处理条件下蔗糖月桂酸单酯的合成、薄层层析法分离蔗糖月桂酸单酯同分异构体的条件,进一步应用于硅胶柱层析分离,实现酯化产物的定量分析。采用IR、MS、1H-NMR、13C-NMR[9]等方法对两种蔗糖单酯同分异构体进行了结构鉴定。
1 材料与方法
1.1 材料与仪器
蔗糖、无水碳酸钾、无水硫酸镁、磷钼酸、氯仿、氯化钠 天津市福晨化学试剂厂;乙酸乙酯、正丁醇、冰醋酸、甲醇、二甲基亚砜(DMSO)天津市富宇精细化工有限公司;柱层析硅胶(200~300目)、薄层层析板 青岛海洋化工厂;月桂酸甲酯(阿拉丁)上海晶纯实业有限公司;以上材料 均为分析纯。
SB25-12DTDN型超声波处理机 宁波新芝生物科技有限公司;RE-52AAB型旋转蒸发器 上海嘉鹏科技有限公司;SHZ-DIII型循环水式真空泵 巩义宁于华仪器有限责任公司;DZF-6030A型真空干燥箱 上海一恒科学技术有限公司;2XZ型旋片式真空泵 上海仪器供销公司;EL104型电子天平 梅特勒-托利多仪器上海有限公司;B-260型恒温水浴锅上海亚荣生化仪器厂;DHG-9070A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;LC-20A型高效液相色谱仪 日本岛津公司;EQUINOX-55型红外光谱仪 布鲁克光谱仪器公司;4000Q Trap质谱仪 AB SCIEX公司;AVANCEIII型核磁共振波谱仪(500MHz)瑞士布鲁克公司。
1.2 实验方法
1.2.1 蔗糖酯的合成 称取蔗糖3.42g(10mmol)溶解于10mL DMSO中,后加入1.23mL(5mmol)月桂酸甲酯及催化剂无水碳酸钾0.10g(以蔗糖质量的3%计),置于超声处理器中,开始反应,2h后结束反应,抽滤除去催化剂,油浴减压蒸出DMSO,之后加25%NaCl溶液和正丁醇(V∶V=1∶1)混合液萃取三次,用少量水洗涤分液两次,用无水硫酸镁除水,抽滤,旋蒸除去溶剂,残余物用热的乙酸乙酯溶解,热抽滤,减压蒸馏除去乙酸乙酯,室温下真空干燥至恒重。
1.2.2 蔗糖月桂酸单酯的薄层层析(TLC)分离方法将购置的薄层层析板切割成20mm×120mm大小的薄板,于105℃的烘箱中活化2h,置于干燥器中备用,用0.05mm的毛细管在薄板的低端约10mm处完成点样,展开25min,后用事先配制的10%的磷钼酸乙醇溶液(m/v)均匀喷雾在薄层层析板上,105℃下显色10min。
1.2.3 蔗糖单酯的柱层析分离提纯方法 蔗糖酯反应原产物3.0g,溶于10mL氯仿-甲醇混合液中(V∶V,5∶1),上硅胶层析柱(硅胶200~300目,35mm×700mm玻璃柱)分离,用氯仿/甲醇/冰乙酸/水(V∶V∶V∶V,75∶15∶7∶3)的混合溶剂为洗脱液,恒定流速条件下洗脱,当点板出现斑点时开始接样,每20~25mL收集一份,洗脱终点为与反应原产物薄层层析板斑点对照薄板最上端无斑点出现。洗出液经TLC检测后归类,旋蒸除去溶剂,得到较为纯净的单体物质。
1.2.4 蔗糖月桂酸单酯的HPLC检测 HPLC(shimadzu LC-20A,Japan),检测器RID(shimadzu,Japan),ECOSILC18(5μm,4.6mm×250mm)色谱柱,流动相为甲醇∶水(V∶V,88∶20),流速1mL/min,柱温40℃,进样量30μL。
1.2.5 蔗糖单酯的红外光谱检测 柱层析获得的分离物白色蜡状固体直接涂抹在红外测定仪的透光镜上测量,扫描范围4000~500cm-1。
1.2.6 蔗糖单酯的质谱测定条件 柱层析分离物采用色谱级甲醇溶解,溶液浓度为20mg/mL。质谱条件:电喷雾ESI离子源,电子能量70eV,传输线温度275℃,离子源温度200℃,采用负离子模式,母粒子m/z330,激活电压1.5V,质量扫描范围0~1000m/z。
1.2.7 蔗糖单酯的1H-NMR及13C-NMR测定条件 以四甲基硅为内标、氘代二甲基亚砜(DMSO-d)为溶剂,1H-NMR和13C-NMR在30℃采用500MHz频率分别对分离纯化的单酯进行扫描。
2 结果与讨论
2.1 展开剂组成对蔗糖单月桂酸酯混合物(TLC)分离效果的影响

表1 展开剂组成对蔗糖单月桂酸酯混合物(TLC)分离效果的影响Table 1 Effect of mobile phase composition on separation of lauroylsucrose mixture
因混合物中各组分在展开剂中的溶解性能及吸附剂硅胶对各组分吸附性能的差异,故各组分在层析板上的Rf值不同,因此,决定薄层层析分析效果好坏的关键是选择恰当的展开剂。实验尝试了多种不同的展开剂:a.氯仿/甲醇=7/1;b.氯仿/甲醇=6/1;c.氯仿/甲醇/冰乙酸=75/15/8;d.氯仿/甲醇/水=75/15/2;e.氯仿/甲醇/冰乙酸/水=75/15/5/5。五种展开剂的比例均为体积比,实验发现以上各种展开剂均能分离单双酯,但只有e能较好的分离两种单酯,但两单酯的Rf值相差较小,分离效果非最佳。故在此展开剂的基础上,进一步调整各组分的比例,得到了最佳的展开剂配比:氯仿/甲醇/冰乙酸/水=75/15/7/3,在此最佳配比条件下,TLC图谱如图1所示,其中蔗糖单酯a为蔗糖-6-月桂酸酯,蔗糖单酯b为蔗糖-6’-月桂酸酯。

图1 蔗糖月桂酸酯TLC图谱结果Fig.1 TLC of lauroylsucrose
2.2 蔗糖月桂酸酯的硅胶柱层析分离
为获得大量的两种蔗糖月桂酸单酯,将优化的最佳TLC分离条件应用于硅胶柱层析。柱层析分离后的蔗糖酯的情况如图2所示。图2表明,硅胶柱层析能将物料分离成4个组分,根据物质在TLC板(见图1)上所表现出的极性差异,可确定,c、d两组分为目标组分。旋蒸除去溶剂后,获得相对大量的单体物质。
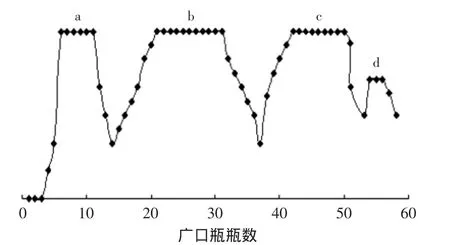
图2 超声波处理下合成的蔗糖月桂酸酯的硅胶柱层析Fig.2 Silica gel column chromatography of lauroylsucrose synthesis under ultrasonic condition
2.3 蔗糖月桂酸单酯同分异构体的HPLC分析
对分离纯化得到的蔗糖月桂酸单酯同分异构体需进一步的分析鉴定。糖酯的分析方法较多,主要有TLC、气相色谱(GC)和气质联用(GC-MS)等,但GC和GC-MS需对糖酯衍生化,过程较繁琐;HPLC示差检测也被用于糖酯的分析,可以很好的检测到单组分样品。

图3 蔗糖月桂酸单酯同分异构体的HPLC分析图谱Fig.3 HPLC of lauroylsucrose isomeride
蔗糖月桂酸单酯同分异构体的HPLC分析图谱见图3(a~c)。图3(a)中表示的是两种单酯同分异构体混合物的HPLC谱图,图3(b~c)两图分别为两种单酯单体的HPLC谱图。图3(a)图谱中除前面的溶剂峰外只有两个峰出现,保留时间分别为10.75、11.70min,十分接近,推测为蔗糖单酯的两同分异构体;图3(b~c)图谱中除前面的溶剂峰外,均只有一个单峰出现,且单峰的保留时间与(a)图中的相互对应,推测为单体物质。
2.4 蔗糖月桂酸单酯IR分析
组分c的红外扫描图谱如图4(a)所示,3375.75cm-1处的强宽峰为缔合-OH的伸缩振动吸收(γO-H);2924.10cm-1及2854.27cm-1处的吸收峰为烷烃饱和CH伸缩振动的特征吸收(γc-H);1720.83cm-1处的强吸收峰为γC=O吸收,是酯的特征吸收峰;1261.42cm-1处有酯基中C-O伸缩振动吸收峰(γc-o);1052.81~1112.53cm-1处为-CH2OH中C-O伸缩振动的特征吸收峰(γc-o),其中1052.81cm-1和995.20cm-1处的强吸收峰为糖环特征吸收,另外930.10cm-1处的吸收峰为α-糖苷键的特征吸收。组分d的红外扫描图谱如图4(b)所示,图中的各个吸收峰位均与图(a)中的谱图基本相对应。可确定两种物质的结构相似,综合红外图谱的分析,符合蔗糖单酯的结构特征。
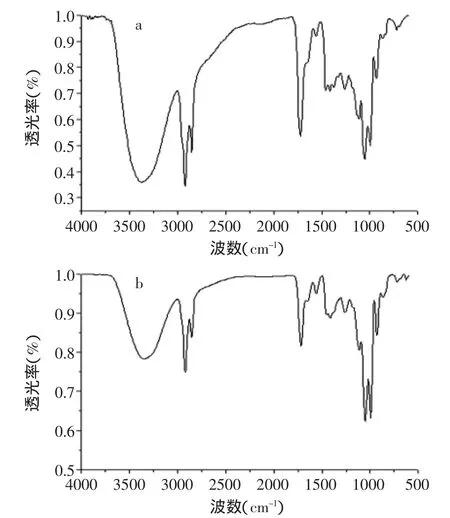
图4 蔗糖月桂酸单酯同分异构体红外谱图Fig.4 IR of lauroylsucrose isomeride
2.5 蔗糖月桂酸酯MS分析
将柱层析分离组分c和d进行MS分析,结果见图5和图6。图5(a)中出现的[M-H]-、[M+Cl]-、[M+HCOO]-质谱信号峰分别为523.8、559.8、569.9峰。所对应的M值与蔗糖月桂酸单酯的分子量524.5相符合,组分c应为蔗糖月桂酸单酯,为进一步验证,对样品c做二级质谱。图5(b)中出现的质谱信号峰能证明其为单酯。图6中的一级质谱(a)与二级质谱(b)均与图5中的质谱数据相互对应,可以确定两种物质为蔗糖月桂酸单酯同分异构体。
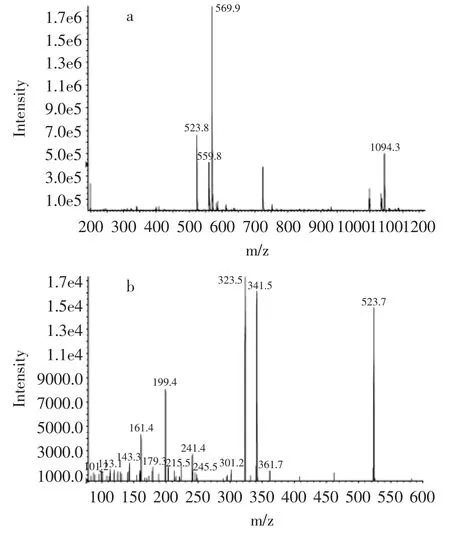
图5 蔗糖-6-月桂酸单酯一级与二级质谱图Fig.5 MS spectra of 6-O-lauroylsucrose

图6 蔗糖-6’-月桂酸单酯一级与二级质谱图Fig.6 MS spectra of 6’-O-lauroylsucrose
2.6 蔗糖月桂酸酯的1H-NMR及13C-NMR分析
为进一步表征并区分两种蔗糖月桂酸单酯的结构,将纯化后的单酯溶于氘代二甲基亚砜(DMSO-d),核磁共振仪扫描谱图。由谱图知两种蔗糖月桂酸单酯的1H-NMR和13C-NMR的化学位移如下:
由NMR数据分析可知,两物质为蔗糖月桂酸单酯;蔗糖脂肪酸酯的13C-NMR的碳原子信号遵循如下规律[10]:与蔗糖相比,蔗糖酯的酰基碳的化学位移移向低场,与其相邻的碳移向高场。从表2的13C-NMR数据可知,蔗糖月桂酸单酯的C-6的化学位移由60.93下降到62.64,而相邻的C-5由73.19上升到71.99,符合文献规律,说明该化合物为蔗糖-6-月桂酸酯。蔗糖月桂酸单酯的C-6’化学位移从63.13下降到66.07,而相邻的C-5’由82.14上升到79.60,也符合文献规律,说明该化合物为蔗糖-6’-月桂酸酯。

表2 蔗糖、蔗糖-6-月桂酸单酯和蔗糖-6’-月桂酸单酯的13C-NMR中的化学位移Table 2 Chemical shifts(ppm)of13C-NMR of 6-O-lauroylsucrose,6’-O-lauroylsucrose in DMSO-d
综合以上各种分析,可确定柱层析分离组分c和d分别是蔗糖-6-月桂酸酯及蔗糖-6’-月桂酸酯。
3 结论
以无水碳酸钾为催化剂,在超声波处理条件下合成了高酯化度的蔗糖月桂酸单酯。采用薄层层析(TLC)和硅胶柱层析对超声处理条件下合成的蔗糖月桂酸酯进行了分离纯化。获得了TLC和硅胶柱层析分离蔗糖月桂酸单酯的理想条件,经IR、HPLC、MS、NMR鉴定,确定两种分离组分分别为蔗糖-6-月桂酸酯和蔗糖-6’-月桂酸酯。
[1]Maja Habulin,Sǎsǎ Sabeder,Zeljko Knez.Enzymatic synthesis of sugar fatty acid esters in organic solvent and in supercritical carbon dioxide and their antimicrobial activity[J].Journal of Supercritical Fluids,2008,45:338-345.
[2]T Polat,R J Linhardt.Syntheses and applications of sucrosebased esters[J].Surfactants Deterg,2001,4:415-421.
[3]T Watanabe,S Katayama,M Matsubara,et al.Antibacterial carbohydrate monoesters suppressing cell growth of Streptococcus mutans in the presence of sucrose[J].Curr Microbiol,2000,41:210-213.
[4]K S Devulapalle, A G Segura, M Ferrer, et al.Effect of carbohydrate fatty acid esters on Streptococcus sobrinus and glucosyltransferase activity[J].Carbohyd Res,2004,339:1029-1034.
[5]M Ferrer,J Soliveri,F J Plou,et al.Synthesis of sugar esters in solvent mixtures by lipases from Thermomyces lanuginosus and Candida antarctica B,and their antimicrobial properties[J].Enzyme Microb Technol,2005,36:391-398.
[6]C L McKenzie,A A Weathersbee III,G J Puterka.Toxicity of sucrose octanoate to egg,nymphal,and adult Bemisia tabaci(Hemiptera:Aleyrodidae)using a novel plant-based bioassay[J].J Econ Entomol,2005,98(4):1242-1247.
[7]Huang Dan,Jiang Xue,Zhu Hao,et al.Improved synthesis of sucrose fatty acid monoesters under ultrasonic irradiation[J].Ultrasonics Sonochemistry,2010,17:352-355.
[8]Xiao Yong-mei,Wu Qi,Cai Ying,et al.Ultrasound-accelerated enzymatic synthesis of sugar esters in nonaqueous solvents[J].Carbohydrate Research,2005,340:2097-2103.
[9]刘巧瑜,贾承胜,蒋平平,等.麦芽糖月桂酸酯的分离纯化与结构鉴定[J].食品科学,2007,28(10):464-467.
[10]K Yoshimoto, Y Itatani, Y Tsuda.13C-nuclear magnetic resonance spectra of O-acylglucose.Additivity of shift parameters and its application to structure elucidations[J].Chem Pharm Bull,1980,28:2065-2074.
