不同碳源调控辅酶I 对聚磷菌胞内多聚物代谢的影响
2021-06-07李丽张华张文超
李丽,张华,张文超
(1.安徽建筑大学环境与能源工程学院,安徽 合肥 230601;2.水污染控制与废水资源化安徽省重点实验室,安徽 合肥 230601)
辅酶Ι 是最重要的脱氢酶的辅酶,是生物氧化过程中氢和电子的携带者,是所有物质能量代谢所必需的辅酶,它包括NAD(氧化型辅酶Ι)和NADH(还原型辅酶Ι)。生物除磷的厌氧阶段,微生物经过三羧酸循环和糖酵解途径分解脱氢传递给NAD合成NADH。NADH 是聚磷菌厌氧阶段实现PHB(聚-β-羟基丁酸)合成的关键推动力,在生物除磷过程中发挥着重要的作用。因此,厌氧阶段充足的NADH 对聚磷菌胞内PHB合成乃至生物除磷系统的除磷效果具有重要的影响。
碳源作为生物除磷过程中聚磷菌重要的影响因素,对聚磷菌胞内NADH 的代谢途径具有重要影响。Pereira 研究表明,聚磷菌以乙酸钠为碳源时,乙酸钠经乙酰化转化为乙酰辅酶A,乙酰辅酶A 经三羧酸循环生成还原力NADH,同时聚磷菌胞内糖原通过糖酵解途径产生NADH 和丙酮酸,一部分丙酮酸转化成乙酰辅酶A 进入三羧酸循环并再次生成NADH。葡萄糖为碳源时,葡萄糖先转化为6-磷酸葡萄糖,一部分6-磷酸葡萄糖转化为糖原,糖原经过EMP(糖酵解)途径和ED(2-酮-3-脱氧-6-磷酸葡萄糖酸)途径生成NADH,一部分6-磷酸葡萄糖直接经过EMP 或ED 途径生成NADH。
在污水生物除磷过程中,乙酸钠和葡萄糖因无毒无害、价格便宜,且分子结构简单,易被微生物分解吸收利用,通常被作为传统的外加碳源。然而,不同的碳源对生物除磷过程中聚磷菌的生长代谢产生不同的影响,胞内辅酶Ι 对聚磷菌的胞内物质的代谢发挥着重要的作用,但关于不同碳源对聚磷菌胞内NAD和NADH 水平的影响及其对聚磷菌胞内多聚物代谢的影响的研究较少。
因此,该研究通过厌氧/好氧交替的平板迭代培养法进行聚磷菌菌株的分离筛选,并通过高通量测序法鉴别聚磷菌类别。然后以乙酸钠和葡萄糖分别调控聚磷菌胞内NAD、NADH 含量,研究不同碳源调控聚磷菌胞内NAD、NADH 含量后胞内PHB、poly-P(多聚磷酸盐)、糖原代谢的变化,进一步分析聚磷菌胞内NAD、NADH 含量对胞内PHB、poly-P、糖原代谢的影响,揭示不同碳源调控辅酶Ι 对聚磷菌胞内PHB、poly-P、糖原代谢的影响,为强化生物除磷提供一种新思路。
1 材料和方法
1.1 菌株来源
采集合肥市某污水处理厂中的活性污泥,然后采用序批式活性污泥反应器进行聚磷菌的富集,通过厌氧/好氧交替的平板迭代培养法分离筛选获得聚磷菌菌株,再通过高通量测序法鉴别聚磷菌类别。
1.2 培养基
LB 培养基:胰化蛋白胨10 g/L、酵母提取物5 g/L、NaCl 5 g/L、pH 7.0-7.2。乙酸钠为碳源的含磷培养基:乙酸钠0.5 g/L、牛肉膏0.22 g/L、MgSO·7HO 0.4 g/L、FeSO·7HO 0.002 g/L、 磷酸二氢钾10 mg/L、氯化铵0.2 g/L。葡萄糖为碳源的含磷培养基:葡萄糖0.5 g/L、牛肉膏0.22 g/L、MgSO·7HO 0.4 g/L、FeSO·7HO 0.002 g/L、磷酸二氢钾10 mg/L、氯化铵0.2 g/L。
1.3 试验运行方式
用1 升LB 培养基作为初始培养基,接种菌株在30 ℃、140 r/min 条件下进行初始培养24 h,再分别将接种菌液以10%的接种量接种于1 L 的乙酸钠、葡萄糖为碳源的含磷培养基的锥形瓶中。将两只锥形瓶放入恒温摇床中30 ℃、140 r/min 振荡培养12 h,使菌株得到繁殖生长。然后厌氧/好氧交替培养,厌氧阶段在厌氧培养箱30 ℃厌氧静置培养1 h,好氧阶段在恒温摇床中140 r/min、30 ℃振荡好氧培养3 h。检测聚磷菌在不同阶段胞内NAD、NADH、PHB、糖原、poly-P 含量。
1.4 分析指标及检测方法
聚磷菌胞内NAD和NADH 含量采用辅酶Ⅰ检测试剂盒测定,该试剂盒采用酶循环法并利用分光光度法测定微生物胞内NAD和NADH 含量;PHB 含量采用浓硫酸消解法测定;poly-P 含量采用过硫酸钾消解法测定;糖原含量采用蒽酮-硫酸比色法测定。

图1 基于16S rDNA 基因序列构建的B-PAO 系统发育树
2 结果与讨论
2.1 聚磷菌的鉴定
采用高通量测序法对聚磷菌进行16S rDNA测序,将获得的序列在NCBI Genbank 中使用Nucleotide Blast 程序进行序列比对。再用MEGA7.0 软件的Alignment 程序,选用ClustalW 法进行多序列比对分析,然后采用近邻法构建系统发育树如图1 所示,鉴定该菌株为Acinetobacter oleivorans,并将其命名为B-PAO。
2.2 不同碳源对聚磷菌胞内NAD+和NADH 含量的影响
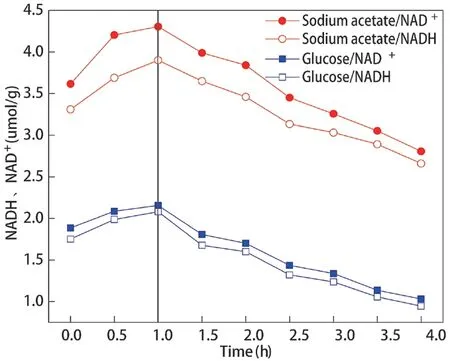
图2 聚磷菌胞内NAD+、NADH 含量变化
以乙酸钠和葡萄糖分别为碳源时,聚磷菌胞内NAD、NADH 含量如图2 所示。由图2 可知,以乙酸钠为碳源时,聚磷菌胞内NAD、NADH 含量均高于以葡萄糖为碳源时的含量。乙酸钠为碳源时,胞内NAD和NADH 平均含量分别为3.547 μmol/g 和3.255 μmol/g;葡萄糖为碳源时,胞内NAD和NADH 平均含量分别为1.592 μmol/g 和1.495 μmol/g。碳源不同,聚磷菌胞内NADH 代谢模型不同。因此,不同碳源产生的胞内NAD和NADH 量不同,故可通过碳源来调控聚磷菌胞内NAD和NADH 含量实现高效生物除磷。
2.3 不同碳源调控辅酶Ι 对聚磷菌胞内PHB 含量影响
乙酸钠和葡萄糖分别调控辅酶Ι后,聚磷菌胞内PHB 含量的变化如图3 所示,PHB 合成、分解速率如图4、图5 所示。乙酸钠和葡萄糖分别为碳源时,聚磷菌胞内PHB 的合成量分别为7.072 mg/g、2.670 mg/g,合成速率分别为7.072 mg/(g·h)、2.670 mg/(g·h)。好氧阶段聚磷菌胞内PHB 的分解量分别为7.071 mg/g、2.565 mg/g,分解速率分别为2.357 mg/(g·h)、0.855 mg/(g·h)。乙酸钠为碳源时,聚磷菌胞内PHB 的合成量、分解量相对以葡萄糖为碳源时更高。乙酸钠为碳源调控聚磷菌代谢时,聚磷菌胞内NAD和NADH 含量更高,越高的NADH为胞内PHB的合成提供更高的推动力。因此,以乙酸钠为碳源时,厌氧阶段胞内PHB 合成量及合成速率更高,好氧阶段胞内PHB 的分解量及分解速率更高。
2.4 不同碳源调控辅酶Ι 对聚磷菌胞内poly-P含量影响
不同碳源调控辅酶Ι 后,聚磷菌胞内poly-P 含量的变化如图6 所示,poly-P 合成、水解速率如图7、图8 所示。乙酸钠和葡萄糖分别为碳源时,厌氧阶段聚磷菌胞内poly-P 的水解量分别为1.509 mg/g 和1.282 mg/g,水解速率分别为1.509 mg/(g·h)、1.282 mg/(g·h);好氧阶段聚磷菌胞内poly-P 的合成量分别为1.561 mg/g 和1.304 mg/g,合成速率分为0.520 mg/(g·h)、0.435 mg/(g·h)。以乙酸钠为碳源时,聚磷菌胞内poly-P 的水解量、合成量更高。
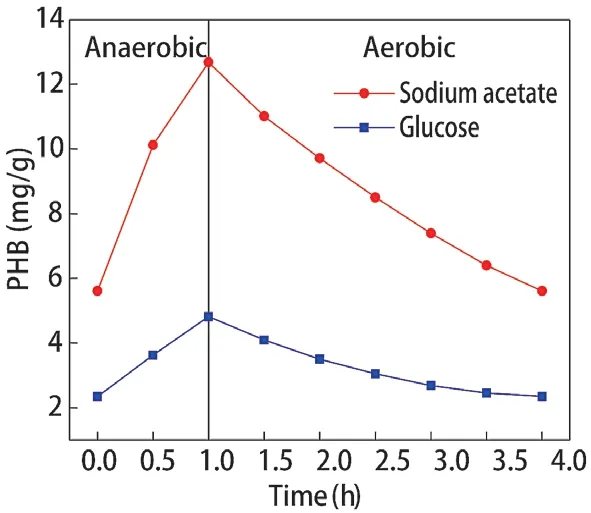
图3 胞内PHB 含量变化
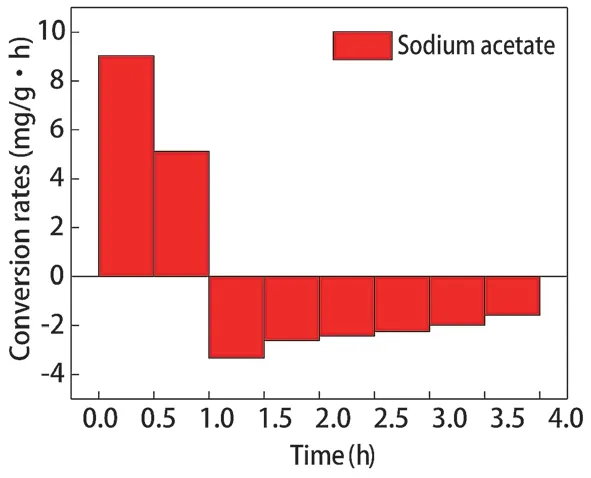
图4 乙酸钠为碳源胞内PHB 合成、分解速率
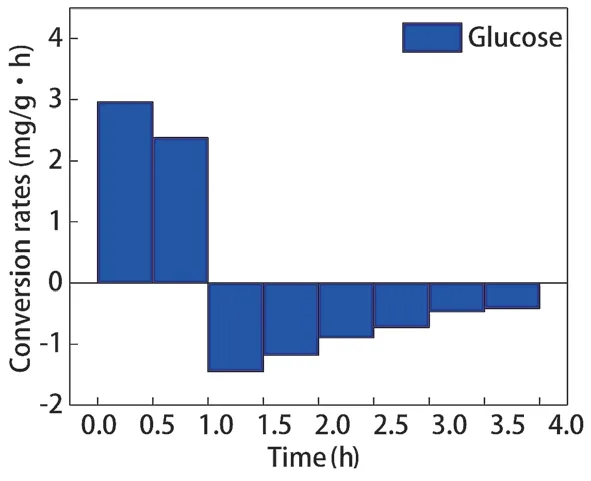
图5 葡萄糖为碳源胞内PHB 合成、分解速率
好氧阶段胞内poly-P 的合成量与胞内PHB水解量紧密相关。当以乙酸钠为碳源调控聚磷菌胞内NAD和NADH 时,厌氧阶段胞内PHB 的大量合成需要更多的胞内poly-P 水解提供能量,好氧阶段胞内PHB 的大量分解,为胞内poly-P 合成提供更多能量。因此,乙酸钠为碳源时聚磷菌胞内poly-P 的合成量、分解量更高。
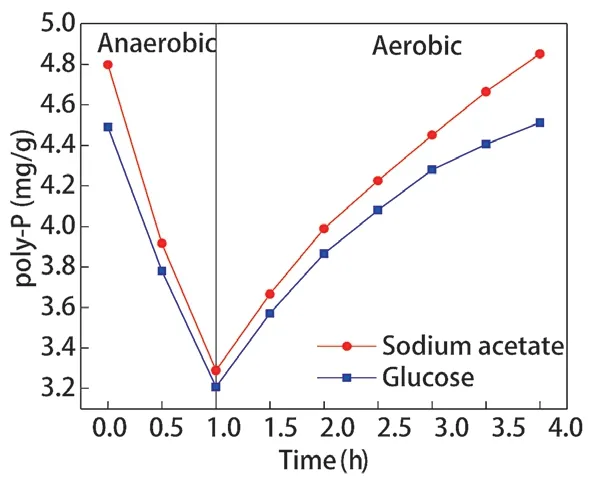
图6 胞内poly-P 含量变化
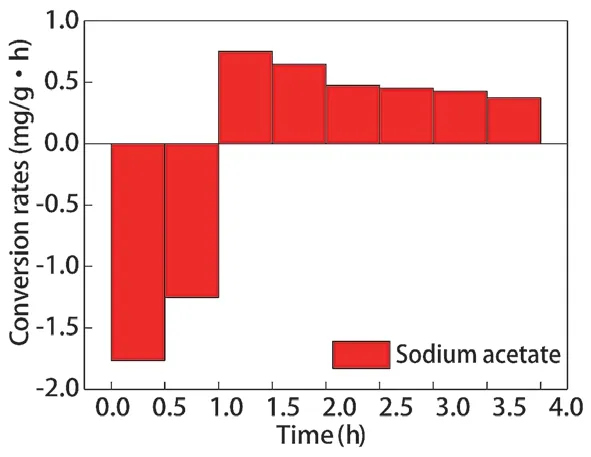
图7 乙酸钠为碳源胞内poly-P 合成、分解速率
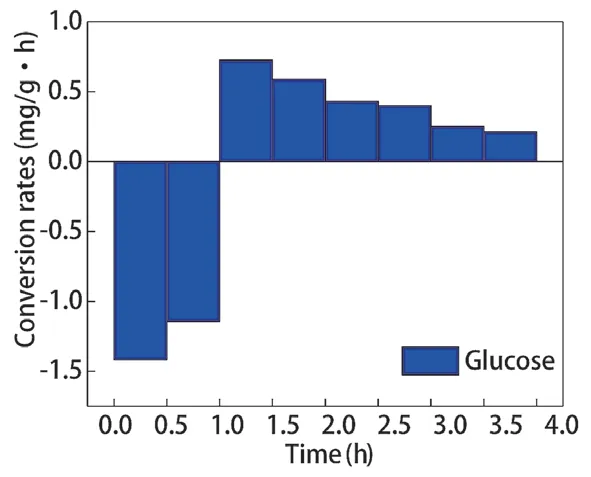
图8 葡萄糖为碳源胞内poly-P 合成、分解速率
2.5 不同碳源调控辅酶Ι 对聚磷菌胞内糖原含量影响
不同碳源调控辅酶Ι 后,聚磷菌胞内糖原含量变化如图9 所示,糖原合成、降解速率如图10、图11 所示。乙酸钠和葡萄糖分别为碳源时,厌氧阶段聚磷菌胞内糖原的降解量分别为2.833 mg/g和3.134 mg/g,降解速率分别为2.833 mg/(g·h)、3.134 mg/(g·h);好氧阶段聚磷菌胞内糖原的合成量分别为2.843 mg/g 和3.266 mg/g,合成速率分别为0.946 mg/(g·h)、1.089 mg/(g·h)。以葡萄糖为碳源时,聚磷菌胞内糖原的降解量、合成量更高。
乙酸钠和葡萄糖为碳源时聚磷菌在好氧阶段均产生了大量ATP,但是以葡萄糖为碳源时,ATP除了供给微生物的生长,还可通过磷酸葡萄糖形成糖原。因此,以葡萄糖为碳源时,虽然聚磷菌胞内NAD和NADH 含量偏低,但聚磷菌胞内糖原的降解量、合成量更高。
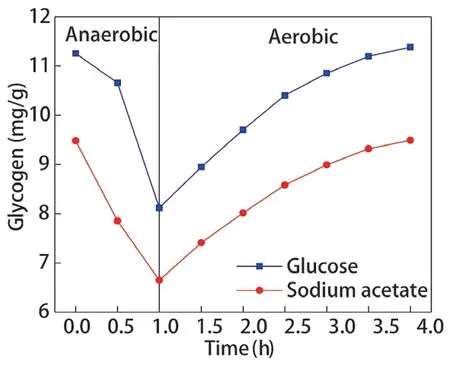
图9 胞内糖原变化
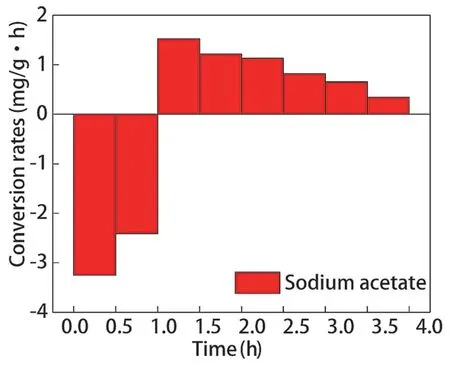
图10 乙酸钠为碳源胞内糖原合成、分解速率
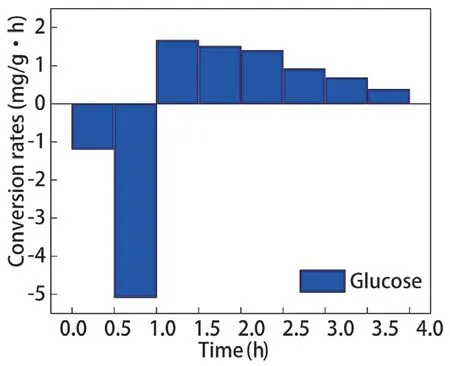
图11 葡萄糖为碳源胞内糖原合成、分解速率
3 结论
采用乙酸钠和葡萄糖分别作为碳源调控聚磷菌胞内辅酶Ι 的含量,结果表明,乙酸钠为碳源时,聚磷菌胞内NAD和NADH 含量较高,而以葡萄糖为碳源时,聚磷菌胞内NAD和NADH 含量则较低。因此,以乙酸钠为碳源时,厌氧阶段聚磷菌胞内PHB 合成量、poly-P 分解量和好氧阶段聚磷菌胞内PHB 分解量、poly-P 合成量均更高。因此,乙酸钠为碳源调控聚磷菌胞内辅酶Ι 的含量更有利于聚磷菌胞内多聚物的代谢,生物除磷更好。该研究通过碳源调控聚磷菌胞内辅酶Ι 的含量从而提高生物除磷的效率,为强化污水生物除磷提供了新思路。
