外源氮素形态对植烟土壤酸解有机态氮组分的影响
2021-06-05邓建强任晓红左梅樊俊夏鹏亮黄勇向必坤
邓建强,任晓红,左梅,樊俊,夏鹏亮,黄勇,向必坤
湖北省烟草公司恩施州公司,湖北省恩施市施州大道119号 445000
土壤有机氮库约占土壤氮库的90%,是土壤供氮的主体[1-4]。自Bremner将土壤有机氮分为酸解有机态氮(AON)和非酸解态氮,AON进一步划分为酸解铵态氮(AN)、氨基酸态氮(AAN)、氨基糖态氮(ASN)和酸解未知态氮(UAN)以来[5],众多学者以此分类方法为基础,研究土壤有机氮组分的环境生态功能,证实了AON对植物氮素营养具有重要作用,特别是AAN和AN是土壤可矿化氮的主要来源[6-7]。同时,较多研究人员也通过长期定位试验探讨了不同施肥类型对土壤有机氮组分的影响,基本确定了有机肥和化肥配施可提高耕层AON含量[8-13],但不同外源氮素形态在AON中转化有所差异,无机态氮主要转化为AN和AAN,而有机态氮则主要转化为AAN 或UAN[14-16],暗示出外源不同氮素形态可能对土壤氮库组分转化过程产生不同的影响。然而,目前研究主要集中在有机氮和无机氮的比较,对更为细化的外源氮素形态研究甚少,且不同氮源形态输入后是通过直接作用还是间接作用对土壤氮库组分及其转化过程产生影响还未明确。此外,烟叶碳氮代谢对烟叶品质可产生重大影响[17],通过什么方法能有效调控土壤供氮规律,缓解我国植烟土壤后期供氮偏旺问题,全面提升中上部烟叶质量是我国烟草行业有待攻克的重大生产难题[18-20]。为此,本文利用15N示踪技术,以湖北恩施植烟土壤为研究对象,采取土壤培养实验,研究外源氮素形态对植烟土壤AON及其组分转化的影响,旨在为提高中上部烟叶质量的土壤定向保育技术开发提供理论依据。
1 材料与方法
1.1 供试土样及试剂
2018年,在湖北省恩施州宣恩县椒园烟叶种植区(E 29.9751°,N 109.3915°,海拔1 050 m)采用5点取样混合样品法采集耕作层(0~30 cm)土壤5 kg,自然风干后过2 mm筛备用。该区域土壤类型为山地黄棕壤,土壤pH 6.20,全氮1.85 g/kg,有机质27.65 g/kg,碱解氮149.36 mg/kg,速效磷30.08 mg/kg,速效钾224.96 mg/kg。
标记试剂:(15NH4)2SO4丰度为99%,Na15NO3丰度为99%,C5H815NO4丰度为98%,试剂均购自阿拉丁试剂上海有限公司。
1.2 试验设计
试验设4个处理:T1氨态氮-(15NH4) 2SO4,T2硝态氮-Na15NO3,T3氨基酸态氮- C5H815NO4和CK。称10 g过2 mm筛风干土装入100 mL培养瓶,除CK外加入对应形态的15N示踪剂0.02 mmol,用称重法维持土壤含水率为田间持水量的70%,培养瓶用打孔的塑料膜封盖,放入25℃恒温培养箱中培养30 d。在培养1 d、3 d、7 d、14 d、30 d取样,每处理3次重复,测定AON组分含量及其15N丰度。AON组分测定采用Bremner酸水解-蒸馏法[21],相应15N样品制备参见相关文献[22],通过MAT-251型质谱仪测定样品15N丰度。
1.3 数据处理
常规统计在EXCEL 2007、SPSS 16.0和AMOS 23.0平台上进行。多重比较差异性采用LSD法,显著水平设为P=0.05。土壤AON各组分15N含量,15N转化率(R值),各组分14N变化值和培养时期加权均值的计算如下:

式中,C15N为AON各组分15N含量(mg/kg),C和C015N分别为15N各处理和对应取样时间的CK处理的AON各组分含量(mg/kg),P和P015N分别为15N各处理和对应取样时间的CK处理的AON各组分15N占比(%),A为某外源氮素15N丰度(%)。

式中,R为15N转化率,M为培养土壤质量(g),F为外源氮添加量(g)。

式中,C14N为AON各组分14N变化值,C0为对应取样时间的CK处理AON各组分含量(mg/kg)。

式中,C14N和C15N分别为C14N和C15N培养时期的加权变化值,i为培养天数,Di为当前培养天数与前一取样培养天数之差。
2 结果与分析
2.1 对15N转化率的影响
从图1可知:(1)在0~10 d,T1处理AON的R值最高,为50%~70 %,其次为T3(45%~55%),T2最低,只约为27%~31 %;在10~30 d,T1和T3迅速下降至30%左右,而T2在整个时期比较平稳,与0~10 d的基本无差异;(2)各处理的AN的R值变化规律与AON相似,在0~10 d,T1和T3的R值较高,后迅速降至20%左右,T2在整个时期维持在15%~25%;(3)在0~10 d,T1处理AAN的R值逐步降低,T2和T3的先下降后上升,随后均逐步降低3%~7%,且T3处理在30 d时又逐步升高;(4)对于ASN而言,T1和T3在1 d时的R值高达17 %左右,而T2只为6%左右,随后R值均降低至0%~5%;(5)T3在培养3 d后UAN的R值上升至6%左右,而T1和T2的却基本为0%,即基本无15N转入。

图1 外源氮素形态对15N转化率的影响(a AON,b AN,c AAN,d ASN和e UAN)Fig. 1 Effects of external nitrogen forms on 15N conversion rate(a AON,b AN,c AAN、d ASN and e UAN)
2.2 对AON组分中15N和14N转化的影响
相比外源15N带入的氮素量,不同外源氮素形态对AON组分的14N变化值影响明显(图2),主要表现为:(1)T1的AON加权平均15N和14N的变化值分别为9.84 mg/kg和-116.71 mg/kg,14N降低幅度较大,与该处理的AN和UAN的14N变化值分别为-70.75 mg/kg和-33.17 mg/kg有关,T1主要通过降低AN和UAN进而降低了AON;(2)T2的AON加权平均15N和14N的变化值为8.40 mg/kg和28.05 mg/kg,其中,AN和UAN的14N的变化值分别为-3.23 mg/kg和-19.48 mg/kg,而AAN和ASN的分别为18.53 mg/kg和32.23 mg/kg,T2更容易提高AAN和ASN;(3)除1 d外,T3的AON的14N变化为正值,其加权平均15N和14N的变化值分别为10.46 mg/kg和69.84 mg/kg,AN、AAN和ASN加权平均14N的变化值分别为13.68 mg/kg、30.42 mg/kg和28.29 mg/kg,UAN的为-2.55 mg/kg,说明T3更容易提高AON。综上可知,外源氮输入15N对AON组分的直接作用较小,不同外源氮形态主要影响其土壤本身14N转化,进而影响了AON组分含量,且不同外源氮形态对其影响方向不同,T1对AON组分的14N具有降低作用,T2和 T3却具有提高作用,但T2提高作用强度低于T3。
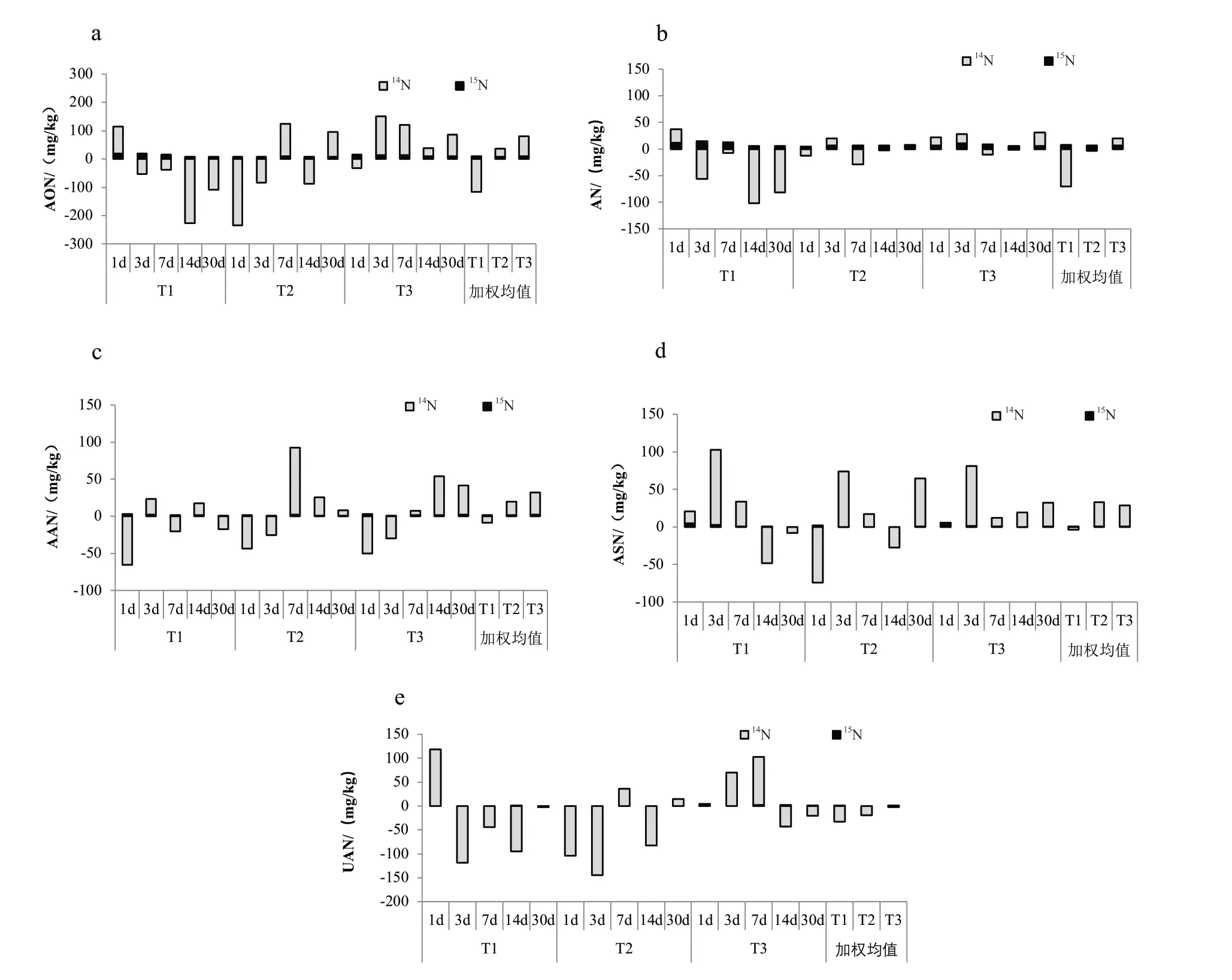
图2 外源氮素形态对15N和AON组分14N转化的影响(a AON,b AN,c AAN,d ASN和e UAN)Fig. 2 Effects of external nitrogen forms on 15N and 14N transformation of AON fractions (a AON,b AN,c AAN,d ASN and e UAN)
2.3 对AON组分间转化的影响
采取结构方程模型(SEM)的路径分析方法研究外源氮形态对AON组分内部转化关系的影响,在AMOS 23.0中采取最大似然估算法进行建模分析。AON组分间的转化模式基于如下假说:氮素转化过程遵循简单到复杂原则,即AN和UAN分别为模型的起点和终点,AN与UAN无直接联系,只能经过AAN或ASN进行转化。通过表1可知,各处理的结构方程模型的评价指数均符合评判标准,所建模型合理可靠。
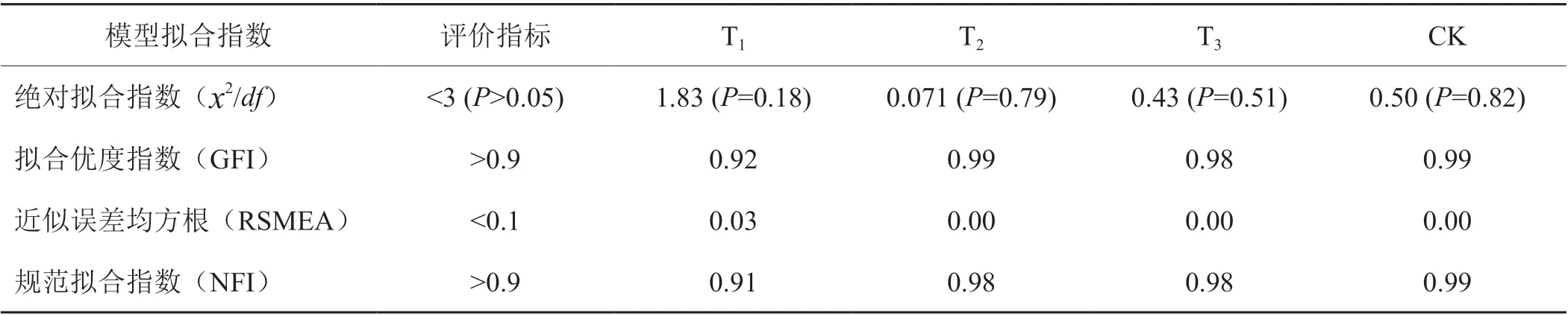
表1 结构方程模型拟合指数统计Tab. 1 Fitting indices of structural equation model (SEM)
在未添加外源氮源条件下(CK),只有ASN与AAN间的标准化路径系数(r)通过检验,N素转化过程主要集中在模型的中心位置,但模型的起点AN与其他组分间的r均未通过检验,结构方程模型较为稳定(图3d)。但在外源氮输入条件下,原始结构方程模型中间稳定状态被打破,即ASN与AAN的r值均未通过显著性检验,而边际间的某些转化过程被激活。T1的AN-ASN和ASN-UAN的r值均为正值,极显著地通过检验,ASN加速了AN向UAN的转化。T3的AN-AAN和ANN-UAN的r值均为负值,且显著地通过检验,AAN抑制了AN向UAN的转化,且ASN-UAN的r值也通过检验,增强了ASN-UAN的转化过程;T2的增强路径与T3相似,如AN-AAN,ASN-UAN的转化过程被增强,但T2的r值均未通过检验(图3a-c)。

图3 外源氮素形态对AON组分间转化的影响(a T1,b T2,c T3和d CK)Fig.3 Effects of external nitrogen forms on transformation of AON fractions (a T1, b T2, c T3 and d CK)
2.4 对AON组分含量的影响
通过图4可知:(1)10 d前,不同形态外源氮素对AON的影响呈现上下波动状态,随后,T1大幅下降,在14 d时显著低于T3和CK,30 d时显著低于T2和T3;(2)对AN来讲,T1在1 d显著高于T2和CK,但随后,其值逐渐较低,14 d时显著低于其它处理,30 d显著低于T3;(3)10 d前各处理的AAN均在上下波动阶段,且无显著差异,但之后,T3显著高于其它处理;(4)在整个时期ASN均不稳定,呈现上下波动状态,T1在培养3 d和7 d显著高于CK,但随后迅速下降,显著低于T2或T3处理;(5)在1 d时,T1的UAN显著高于T2,3 d时,T3显著高于T1和T2,但与CK无显著差异,7 d至30 d,各处理均无显著差异。

图4 外源氮素形态对AON组分含量的影响(a AON,b AN,c AAN,d ASN和e UAN)Fig. 4 Effects of external nitrogen forms on AON fractions (a AON,b AN,c AAN,d ASN and e UAN)
3 讨论
本研究表明不同外源氮素形态对植烟土壤AON组分的影响不同,氨基酸态氮更有利于提高AON,但氨态氮则相反(图4a),这主要归因于氨基酸态氮可显著提高了占比达65%~75%的AN和AAN含量(图4b-c)。从土壤氮素转化量来看,在整个培养期内,氨态氮、硝态氮和氨基酸态氮15N进入AON组分的数量差别不大,加权均值分别为9.84 mg/kg、8.40 mg/kg和10.49 mg/kg;但14N变化值差别较大,氨态氮加权平均值为-116.71 mg/kg,而硝态氮和氨基酸态氮却为28.05 mg/kg和69.84 mg/kg。从土壤氮素转化过程来看,氨态氮主要增强了AN-ASN和ASNUAN间的连续转化过程,其r值均为正,可能提高了AN转化概率,进而大幅降低了AN含量;而氨基酸态氮激活了AN-AAN和ANN-UAN间的连通性,但其r值均为负,AAN可能抑制了AN向UAN连续性转化过程,使得AON的积累量显著增强;硝态氮虽然降低了ASN-AAN的转化过程,但边际的激活效应未有明显增强,模型较为平稳,是其AON-14N变化值介于氨态氮和氨基酸态氮之间的主要原因。以上说明,不同外源氮素形态诱导土壤本身氮素转化量和转化方向的差异是影响AON组分变化的主要因素,而外源氮素本身带入量对其直接影响较少,其中硝态氮和氨基酸态氮更有利于AON-14N的累积,而氨态氮则相反。上述结论与相关研究结果基本一致。长期定位试验发现,外源有机态氮更有利于提高AON含量[9-13],在棕壤常规施用有机肥可增加11.68%[9],在黑土中倍施有机肥可增加9.11%[11],在黄棕壤配施有机肥可增加11.69%[23]。这主要与无机氮和有机氮对土壤氮素积累和转化影响不同有关:(1)有机氮可促使土壤残留氮向AON转化[24];(2)化肥氮主要转化为AN和ANN,进入土壤0~2 μm的粘粒,而有机氮则主要转化为ANN或UAN,同化进入各粒级中的ASN及2 μm以上各粒级的ANN[14-16,23,25],有机氮更利于土壤形成良好结构、培肥土壤。同时,本文中氨态氮处理的AON-14N降低可能还与氨态氮对土壤氮素的其它循环作用影响有关,如氨态氮肥更容易在非饱和田间持水量条件下提高N2O的排放量[26-27],在一定程度上提高AON-14N的转出量,但该类方式的14N转出比例还有待于进一步探讨。
同时,值得关注的是,不同形态外源氮素对反映土壤微生物的氮素同化吸收利用过程的重要指标ASN[8]的影响结果不同。其中,氨态氮处理的15N进入ASN的加权均值为0.60 mg/kg,略高于硝态氮(0.54 mg/kg)和氨基酸态氮(0.56 mg/kg),且氨态氮和氨基酸态氮10天前的15N转化率均高于硝态氮(图1d)。这主要与微生物对氮素的选择性同化有关,氨态氮和氨基酸态氮因其被微生物利用时消耗能量较少容易被微生物快速同化,而硝态氮则因需消耗一定量的能量转化为氨态氮后方可再利用,降低了微生物对其同化的能力[28-29]。同时,不同外源氮形态对ASN-14N变化值差别较大,硝态氮和氨基酸态氮分别增加了32.23 mg/kg和28.29 mg/kg,而氨态氮却使之降低了3.94 mg/kg,这可能与不同氮素形态对土壤微生物群落结构的影响差异有关[30-31],如氨态氮可降低真菌的丰度,而硝态氮对细菌的生长速率产生影响[32-34],使得添加硝态氮可加速由细菌向真菌占主导地位的微生物群落结构转变[28,35-36],进而可能最终影响到土壤氮素的转化过程,但其主要机理机制仍需深入探究。
4 结论
外源氮形态对土壤AON有一定影响,氨基酸态氮更有利于提高AON,硝态氮的提高作用低于氨基酸态氮,而氨态氮则不利于AON的积累。从转化过程来看,不同外源氮形态15N转入量差别不明显,但对土壤本身14N的转化过程影响较大,氨基酸态氮和硝态氮可通过增加其它来源14N转入量提高AON,而氨态氮则更有利于AON-14N的转出。这主要可能与外源不同氮素形态影响了AON组分间的转化过程有关,如氨态氮增强了AN向UAN转化过程中ASN的促进作用,而氨基酸态氮则提高了AAN对上述此转化过程的抑制作用。
