佐夫色绿藻高产虾青素的诱导条件及发酵工艺优化
2021-06-04何健泽陈俊辉姜雪亚魏东
何健泽,陈俊辉,姜雪亚,魏东
(华南理工大学食品科学与工程学院,广东广州 510640)
虾青素(Astaxanthin),化学名称3,3’-二羟基-4,4’-二酮基-β’β-胡萝卜素,是一种脂溶性紫红色的类胡萝卜素,普遍存在于多种微生物和虾蟹等海洋生物中[1]。虾青素独特的结构使其具有超强的抗氧化性,是β-胡萝卜素的10倍,维生素E的500倍,可延缓皮肤衰老、提高机体免疫力,在食品、医药和化妆品行业具有广阔市场前景和应用价值[2,3]。微生物发酵法是天然虾青素生产的重要生产方式,常用的微生物有红发夫酵母、雨生红球藻等,但红发夫酵母生产的虾青素为全反构型,主要作为三文鱼类等的饵料着色剂[4]。目前天然虾青素工业生产的藻种主要是利用雨生红球藻进行的,但是培养过程中细胞密度低、培养时间长、易污染,并且需要高光照等诱导胁迫条件,这制约了天然虾青素的生产[5,6]。
佐夫色绿藻(Chromochloris zofingiensis)是一种淡水单细胞圆形绿藻,直径范围为2~15 μm,通过产生孢子细胞进行繁殖[5]。佐夫色绿藻能够进行自养、异养和混养的多营养方式生长,积累多种高价值代谢产物,并且可以在现有微生物发酵装置中进行高密度培养。因此,目前色绿藻被认为是大规模生产虾青素的潜在替代藻种,相对于雨生红球藻,佐夫色绿藻具有生长速率快、细胞产率高、不易污染、细胞壁易破碎从而易于提取虾青素等优势,有望进一步降低天然虾青素的生产成本[7]。
佐夫色绿藻虽然具有诸多优点,但现阶段胞内虾青素含量仍达不到雨生红球藻的积累水平。如何显著提高佐夫色绿藻胞内虾青素的生产水平,就成为当前研究的难点和技术瓶颈。近年来研究表明佐夫色绿藻在特定诱导条件(包括高光诱导、过氧化氢和乙醇等氧化诱导[5,8])的作用下可以显著提高胞内虾青素含量。这主要是由于在这些诱导方式下,藻细胞内氧化压力增强,诱导产生的活性氧(ROS)和自由基与蛋白质、脂质和DNA等发生反应,对细胞造成氧化损伤,而藻细胞则会诱导合成虾青素等抗氧化物质来消除ROS和自由基,以保护细胞免受损伤以抵抗逆境[9]。因此,通过不同诱导胁迫条件来提高细胞ROS水平,就可以间接提高佐夫色绿藻生产积累虾青素的水平[10]。目前文献中报道的佐夫色绿藻培养的最高生物量可以达到98.40 g/L,虾青素产量最高为73.30 mg/L[11],基本达到雨生红球藻的生产效率,但是虾青素含量还较低。因此,进行多诱导条件和发酵工艺的优化,进一步提高虾青素含量,将有助于推动利用佐夫色绿藻商业化生产制备虾青素的进程,因而具有重要的研究价值和广阔的应用前景。
本研究以佐夫色绿藻为研究对象,采用葡萄糖和醋酸钠为混合碳源进行混合培养,研究了混养条件下混合碳源和过氧化氢诱导剂对佐夫色绿藻生长和虾青素积累的影响,从中获得最佳培养条件,并在5 L光发酵罐中进行了放大验证和发酵工艺优化,为佐夫色绿藻商业化生产天然虾青素提供了实验基础。本研究强化了佐夫色绿藻积累虾青素能力并且验证了利用光发酵罐培养色绿藻生产虾青素的可行性,为佐夫色绿藻生产制备天然虾青素提供关键技术和实验依据。
1 材料与方法
1.1 实验藻种与培养基
佐夫色绿藻(Chromochloris zofingiensisATCC 30412)购自美国American Type Culture Collection(ATCC)菌种保藏中心,采用Bristol’s medium(BM)培养基进行藻种的保藏和培养[12]。
1.2 实验试剂及仪器
本研究所采用的主要试剂有过氧化氢、乙醇、硫酸亚铁、甲醇、二氯甲烷、葡萄糖、硝酸钠以及培养基所需微量元素等均为分析纯,购自本地试剂公司。本研究主要仪器有高效液相分析仪(P680)购自美国DIONEX公司;液相色谱柱YMC carotenoid column C30购自美国Waters公司;流式细胞仪(Accuri C6)购自美国BD公司;pH计(SevenEasy)购自Mettler Toledo;生物传感分析仪(SBA-40D)购自山东省科学院;高速冷冻离心机(Alledra 25R)购自美国Beckman Coulter公司。
1.3 实验方法
1.3.1 藻种活化与种子液制备
从斜面培养基上挑取藻种,接种到装有100 mL BM培养基(外加10 g/L葡萄糖)的250 mL三角瓶中,初始pH为6.50,在光照强度为10 μmol/m2·s,温度为26 ℃,转速为150 r/min的恒温摇床中培养4~5 d进行活化。将培养好的藻液以10%的接种量接种到含有上述相同营养成分培养基的250 mL三角瓶中培养4 d,作为一级种子液。然后,再按10%的接种量转接到装有改良BM培养基的250 mL的三角瓶中(装液量100 mL),其中改良培养基中初始葡萄糖30 g/L,硝酸钠作为氮源,控制碳氮比为34,初始pH为6.50。在相同培养条件下将藻细胞培养到对数期末期或稳定期初期,作为二级种子液用于后续实验。
1.3.2 混合碳源优化
采用不同混合碳源的无氮BM培养基进行佐夫色绿藻的摇瓶培养,研究不同混合碳源组合对细胞生长和虾青素积累的影响。基于本实验室前期研究结果,发现葡萄糖浓度为20~30 g/L对于佐夫色绿藻生长性能和虾青素积累具有较好的促进效果,并且培养结束后,20 g/L葡萄糖能够消耗完,不会造成浪费[13]。而且1.50~3.00 g/L醋酸钠有助于提高虾青素产量,其中醋酸钠浓度为2.50 g/L时虾青素产量最高[14]。本实验为了探究以葡萄糖和醋酸钠为混合碳源取代单一碳源的可行性及其效果,故选择五种不同的混合碳源条件进行佐夫色绿藻的培养,具体条件分别为:只加20 g/L的葡萄糖(Glu);只加2.50 g/L的醋酸钠(NaAC);同时加20 g/L的Glu和1.50 g/L的NaAC;同时加20 g/L的Glu和2.50 g/L的NaAC;同时加20 g/L的Glu和3.00 g/L的NaAC。醋酸钠通过配置母液过滤除菌后加入。本实验在恒温摇瓶中培养,温度为26 ℃,转速为150 r/min,光照为130 μmol/m2·s,培养10 d,以虾青素产量和产率为最优评价指标。
1.3.3 过氧化氢浓度优化
以无氮的BM培养基为基本培养基,初始葡萄糖浓度为20 g/L,醋酸钠为2.50 g/L,设置不同的过氧化氢浓度梯度0、77.50、107.50、137.50 mg/L,并加入18 μmol/L硫酸亚铁,研究过氧化氢诱导胁迫对佐夫色绿藻细胞生长和虾青素积累的影响,以虾青素产量和产率为最优评价指标。培养过程中监测葡萄糖浓度变化,降至0~5 g/L时进行补料,补至20 g/L。其它培养条件同1.3.2。
1.3.4 光发酵罐发酵工艺优化
在5 L光发酵罐中,设置三种不同发酵工艺:恒定高光强、低光强-高光强、低光强-高光强-补加过氧化氢,研究不同发酵工艺对佐夫色绿藻细胞生长和虾青素积累的影响,以虾青素产量和产率为最优评价指标。具体工艺参数如下:(1)采用外置光源,通过调节电流控制光照强度,调节电流至最大从而将光照强度提高为653 μmol/m2·s,并维持恒定高光强;(2)光照强度采用逐渐提高光强的方式进行调节,培养过程中从169 μmol/m2·s不断增加到653 μmol/m2·s;(3)光照强度采用先低光后高光的方式进行调节,从312 μmol/m2·s不断增加到653 μmol/m2·s,培养至72 h进行过氧化氢补料,补料浓度为107.50 mg/L过氧化氢和18 μmol/L的硫酸亚铁。培养基采用无氮的BM培养基为基本培养基,并添加20 g/L葡萄糖和2.50 g/L醋酸钠。培养过程pH设置范围6.50~8.50,温度设置范围为26 ℃~28 ℃,通气量为3.33 L/min,转速为150 r/min。培养期间采用0.10 mol/L盐酸和氢氧化钠调节pH,温度通过冷却循环泵控制。
1.4 分析测试
1.4.1 生物量
生物量浓度采取干重法进行测定。吸取一定体积藻液置于事先烘干称重的2 mL离心管中,并将其置于8000 r/min的条件下离心3 min,弃上清,获得藻泥,并用蒸馏水进行洗涤。重复三次后将离心得到的藻泥置于60 ℃恒温干燥箱中烘干至恒重,最后通过计算前后重量的差值获得生物量。
1.4.2 比生长速率
通过生物量计算佐夫色绿藻的比生长速率μ(d-1),比生长速率的计算公式为:
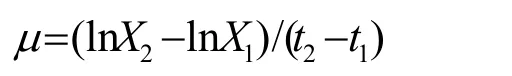
其中X2、X1分别为t2、t1时间测定的生物量(g/L)。
1.4.3 细胞密度
细胞密度采用美国贝克曼CytoFLEX型流式细胞仪进行测定。首先将藻液离心获得藻泥,然后用超纯水洗涤多次,稀释到约1×106CFU/mL的细胞密度后进行流式细胞仪测定,控制流式细胞仪的流速为35 μL/min,记录时间为30 s,记录10000个以上的细胞数据,并使用CytExpert 1.2软件分析细胞密度。
1.4.4 葡萄糖浓度
利用SBA-40D生物传感分析仪测定培养基内葡萄糖浓度。首先将待测样品上清液过滤并稀释至葡萄糖浓度在0.50~1.00 g/L的可测范围内进行传感仪测定,测定前先用1.00 g/L的葡萄糖标准品定标,待定标通过后,吸取25 μL稀释后样品进行测定,将测定获得的读数乘以稀释倍数即得培养基的葡萄糖浓度。
1.4.5 细胞内色素含量
佐夫色绿藻细胞内色素提取和成分测定参照相关文献[15]。将离心收集的藻泥采用冷冻干燥机冻干成藻粉,准确称量10 mg藻粉,置于装有陶瓷珠的振荡管中,采用甲醇/二氯甲烷混合液(体积比3:1,含有0.10%的2,6-二叔丁基-4-甲基苯酚)作为提取试剂,采用高频振荡仪进行破碎提取,反复操作直至藻细胞变成无色,合并收集的所有上清液并利用氮气吹干。然后用甲醇/MTBE混合溶剂(1:1,V/V)定容,过滤并转移至棕色瓶用于高效液相色谱分析。以上操作全程需注意避光。佐夫色绿藻细胞内色素提取和成分测定参照相关文献[16],依据上述HPLC的测定条件进行样品测定。
HPLC测定具体步骤如下:采用YMC C30类胡萝卜素色谱柱和PDA检测器,柱温为30 ℃,进样量为20 μL,流速为0.8 mL/min,流动相分别为甲醇(A)及MTBE(B),进行梯度洗脱,检测波长为480 nm、645 nm和665 nm,并在300~800 nm下进行全波长扫描以测定光谱。称取色素标准品虾青素、叶黄素、角黄素、叶绿素b、叶绿素a并分别制成一系列不同浓度梯度的标准溶液,按照上述同样方法进行测定,建立相应的色素标准曲线,最后依据色素标准品的保留时间和标准曲线进行样品中色素的定性和定量分析。
1.4.6 得率测定
生物量得率(Yg/gsubstrate)或虾青素得率(Ymg/gsubstrate)是指每消耗单位浓度(g/L)葡萄糖(或醋酸钠)对应生物量的增长量(g/L)或虾青素产量的增长量(mg/L),计算公式为:
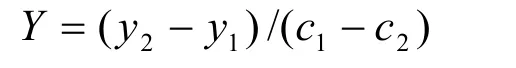
其中y1、y2为培养起始和结束时测得的生物量(g/L)或虾青素产量(mg/L),c1、c2为培养起始和结束时测得的葡萄糖(或醋酸钠)的浓度(g/L)。
1.4.7 数据分析
采用Microcal Origin 9.0和SPSS统计分析软件进行数据统计分析。
2 结果与分析
2.1 混合碳源对佐夫色绿藻积累虾青素的影响
本实验研究不同混合碳源对佐夫色绿藻细胞生长和虾青素积累的影响。由图1可知,在葡萄糖和混合碳源的实验组中,培养前两天,葡萄糖消耗速率较快,生物量增长也最快,但是培养到第四天时,葡萄糖消耗和细胞生物量增加值均下降。之后,虽然葡萄糖浓度不断降低,但是藻细胞生物量增加缓慢。培养结束后,采用混合碳源培养的藻细胞生物量高于单一碳源。其中,采用20 g/L葡萄糖与2.50 g/L的醋酸钠作为碳源,获得的生物量浓度最高为6.50 g/L,是单一葡萄糖生物量浓度的1.47倍,是单一醋酸钠碳源生物量浓度的2.00倍。这说明添加醋酸钠有助于佐夫色绿藻同化葡萄糖,进而促进藻细胞生长和繁殖。Helder等人[17]研究在BBM培养基中同时加入醋酸钠和葡萄糖各 7.50 g/L作为混合碳源进行Neochloris oleoabundans培养,获得了最高1.75 g/L的生物量,结果优于单一碳源,与本研究结果类似。这表明适宜浓度的混合碳源有利于微藻生物量的积累。
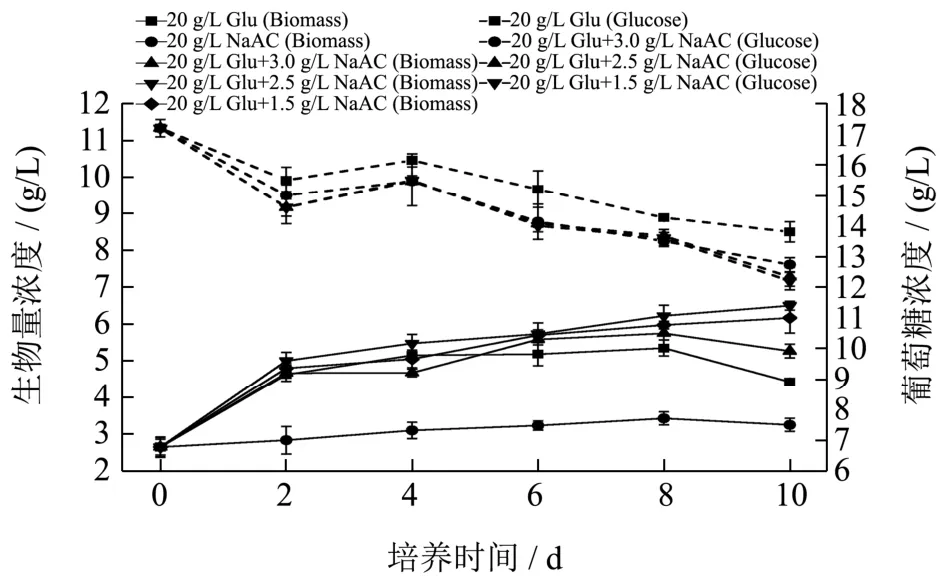
图1 不同碳源培养条件下佐夫色绿藻生物量(Biomass)和葡萄糖(Glucose)浓度的变化曲线Fig.1 Time courses of C.zofingiensis biomass and glucose concentration in the cultures with different carbon sources

图2 不同碳源培养条件下佐夫色绿藻的色素含量(a)及各色素所占总色素百分比(b)的变化情况Fig.2 Pigment contents (a) and abundances (b) as percentages of the total pigments in C.zofingiensis in the cultures with different carbon sources
但是,当混合碳源中醋酸钠浓度增加到3.00 g/L时,生物量浓度呈现下降趋势,在培养结束即第十天时,生物量为5.27 g/L、葡萄糖消耗速率为0.72 g/(L·d),均显著低于醋酸钠为1.50 g/L和2.50 g/L的实验组。起始醋酸钠浓度为3.00 g/L的实验组,在培养起始第0~2 d时,葡萄糖消耗速率就较低,这表明过高浓度的醋酸钠会一定程度上抑制细胞对葡萄糖的消耗能力,进而抑制藻细胞的生长。庄惠如等人[18]研究发现雨生红球藻随着醋酸钠浓度的增加,细胞生物量先增加后减少,在0.50~1.00 g/L的低浓度的醋酸钠条件下有利于雨生红球藻的生长,使得雨生红球藻迅速进入指数生长期,并延长生长期,在1.00 g/L的醋酸钠条件下最高生物量干重约为0.70 g/L。1.50~2.00 g/L的高浓度醋酸钠则会抑制其细胞生长,且初始醋酸钠浓度过高导致延滞期增长,并对细胞产生毒害作用。由此得出,在混合碳源条件下,添加醋酸钠有利于藻细胞的生长,但醋酸钠浓度不宜高于2.50 g/L,否则会抑制藻细胞生长。
混合碳源对佐夫色绿藻积累虾青素的影响如图2所示。由图2a可知,采用葡萄糖或醋酸钠作为单一碳源时,获得的虾青素含量最高,达到3.51 mg/g以上,两者无显著性差异,但均显著高于混合碳源实验组(p<0.05)。在混合碳源实验组,随着醋酸钠的浓度的增加,虾青素的含量也随之增加,最高为2.78 mg/g,虾青素占总类胡萝卜素的含量达到70%以上。混合碳源培养中虾青素含量较低,推测其原因可能是由于培养过程中,藻细胞内同时存在多种碳源代谢途径,从而合成不同的目标代谢产物,进而影响到虾青素的积累。在佐夫色绿藻培养中,藻细胞生长和虾青素积累并不是同步的[19],仅提高藻细胞内虾青素含量或藻的生物量,并不会显著提高虾青素生产水平。
在本研究中,采用混合碳源有助于藻细胞同化葡萄糖,如表1所示,葡萄糖平均消耗速率均在0.72 g/(L·d)以上,显著高于单独采用葡萄糖作为碳源的对照组(p<0.05)。虽然混合碳源在一定程度上降低了虾青素的含量,但是当醋酸钠浓度为2.50 g/L时,藻细胞密度较高,生物量相对于碳源的得率也最高达到0.51 g/g葡萄糖,最终获得的虾青素产量和产率也最高,分别达到16.98 mg/L和1.06 mg/(L·d),显著高于其他实验组。但是,虾青素得率为2.23 mg/g,稍低于单独葡萄糖培养的对照组。由此可知,采用混合碳源有助于提高佐夫色绿藻虾青素产量和产率。Wang等人[20]研究也发现葡萄糖和乙酸钠组合碳源,相对于单独的葡萄糖或单独的乙酸钠而言,具有潜在的培养优势,能够显著提高Coccomyxa subellipsoidea生物量和脂质合成等生物学指标。
综上,在无氮条件下,以葡萄糖和醋酸钠为混合碳源有助于提高佐夫色绿藻生产积累虾青素的能力,尤其是当葡萄糖浓度为20 g/L和醋酸钠浓度为2.50 g/L时为最优组合条件,可以显著提高藻细胞生物量和虾青素产量。
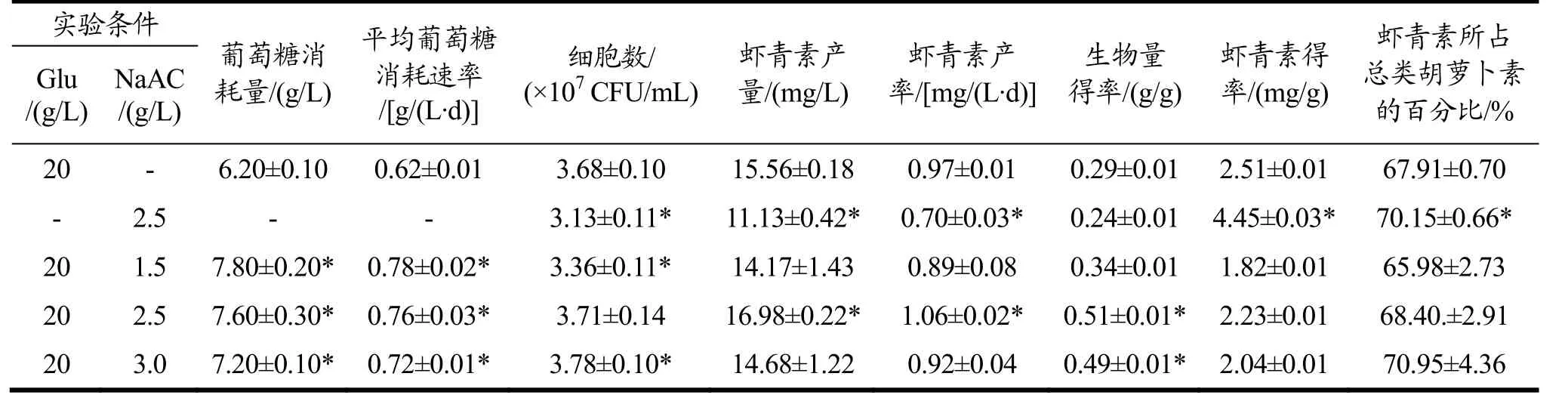
表1 不同碳源条件下佐夫色绿藻对葡萄糖消耗和虾青素积累情况的对比Table 1 Comparisons of average glucose consumption and astaxanthin accumulation in C.zofingiensis cultures with different carbon sources
2.2 不同过氧化氢浓度对佐夫色绿藻积累虾青素的影响
本实验研究不同过氧化氢浓度对佐夫色绿藻细胞生长和虾青素积累的影响。由图3可知,添加过氧化氢不会抑制藻细胞生长及其葡萄糖的消耗利用,反而有助于藻细胞的生长。随着过氧化氢添加量的增加,藻细胞生物量不断增加,当过氧化氢浓度为137.50 mg/L时,生物量达到最大值22.88 g/L,相对于对照组增加了37.50%,增加较显著(p<0.05)。培养到第6 d时,培养基中葡萄糖基本消耗完毕,而且添加过氧化氢的实验组中藻细胞对葡萄糖的消耗速率还会加快。Yu等人[21]对雨生红球藻进行了过氧化氢的处理后,发现过氧化氢对细胞密度有聚集效应,与本研究中过氧化氢促进藻细胞生长的结果类似。可能是过氧化氢会诱导藻细胞产生氧化胁迫,但适量过氧化氢不会影响藻细胞的质膜功能及胞内代谢酶的活性,反而因为提高培养基中饱和氧的水平而促进藻细胞生长。
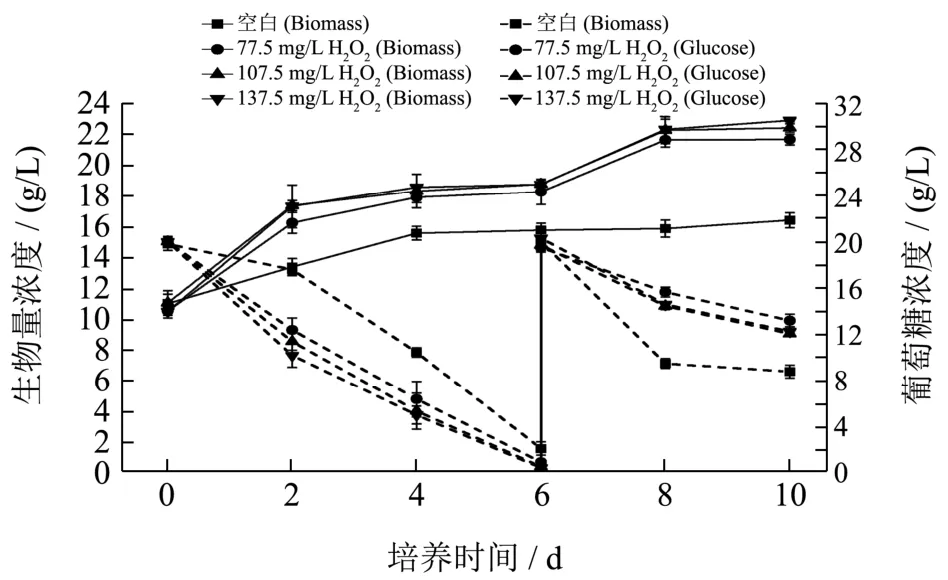
图3 不同过氧化氢浓度下佐夫色绿藻生物量(Biomass)及葡萄糖(Glucose)消耗情况的变化曲线Fig.3 Time courses of biomass and glucose concentration in C.zofingiensis cultures with different concentrations of hydrogen peroxide
不同过氧化氢浓度对佐夫色绿藻积累虾青素的影响如图4所示。由图4a中可知,当过氧化氢浓度在0~107.50 mg/L之间时,随着过氧化氢浓度的升高,虾青素含量逐渐升高,且在过氧化氢浓度为107.50 mg/L,虾青素含量最高为3.23 mg/g,显著高于对照组(p<0.05)。推测其原因可能是Fe2+与过氧化氢发生Haber-Weiss和Fenton反应,进而产生活性氧,对佐夫色绿藻形成一定的氧化胁迫,诱导藻细胞内的虾青素合成以抵抗氧化损伤[22]。同时,Fe2+也是类胡萝卜素合成中的羟化酶和酮化酶的辅因子,从而提高酶活,促进了虾青素的积累[23]。随后继续提高过氧化氢浓度至137.50 mg/L,虾青素的含量为3.21 mg/g,与过氧化氢浓度为107.50 mg/L下的虾青素含量(3.23 mg/g)相比并没有显著性增加,反而有所下降,这可能是因为过量的过氧化氢会影响虾青素的合成,导致虾青素积累量降低。当继续增加过氧化氢到137.50 mg/L或更高浓度时,可能会超过藻细胞的承受程度,从而会对虾青素合成起抑制作用,反而导致虾青素含量下降。Ip等人[24]发现在不添加过氧化氢条件下,佐夫色绿藻生物量最高约为9.00 g/L,而添加0.10 mM过氧化氢时,生物量降低到约7.50 g/L,但虾青素含量从约1.10 mg/g增加到约1.70 mg/g,之后继续增加其浓度,生物量和虾青素积累量均呈降低趋势。同样,Yu等人[21]研究雨生红球藻在(0~1.00 mM)过氧化氢浓度下,随着过氧化氢浓度的增加先增加后减少,在0.70 mM时达到最大,与对照组相比提高了10%,并且在1.00 mM时,虾青素降低到对照组水平,说明适宜浓度活性氧浓度能够促进虾青素积累,达到饱和之后,再继续增加过氧化氢会导致氧化损伤。由本研究可知,添加适宜浓度的过氧化氢有利于促进藻细胞生长和虾青素积累[25]。
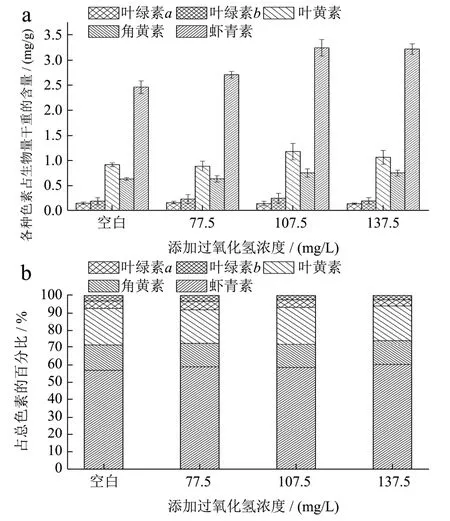
图4 不同过氧化氢浓度下佐夫色绿藻色素含量(a)和各色素所占总色素百分比(b)Fig.4 Pigment contents (a) and abundances (b) as percentages of the total pigments in C.zofingiensis in the cultures with different hydrogen peroxide concentrations
不同过氧化氢浓度对佐夫色绿藻生长和虾青素积累影响的综合对比分析如表2所示。添加过氧化氢不会抑制藻细胞对葡萄糖的消耗,反而可以提高葡萄糖消耗速率,最高为2.80 g/(L·d),显著高于对照组(p<0.05)。当过氧化氢浓度从77.50 mg/L增加到137.50 mg/L时,虾青素产量和产率也达到最大值,分别为73.45 mg/L和4.59 mg/L/d,相较于空白组,分别提高了82.93%和82.87%,增长非常显著(p<0.05)。过氧化氢浓度为137.50 mg/L的条件下,生物量得率和虾青素得率也为最大值,分别为0.45 g/g葡萄糖和2.66 mg/g葡萄糖。Ip等人[8]研究了异养条件下过氧化氢对佐夫色绿藻的影响,其研究结果表明过氧化氢的添加有利于虾青素的积累,这与实验结果相一致,但其虾青素的产量最高为12.58 mg/L,远低于本实验结果。由此得出:过氧化氢的最适浓度范围为107.50~137.50 mg/L,从虾青素含量和生产成本方面的角度考虑,认为107.50 mg/L过氧化氢最优。
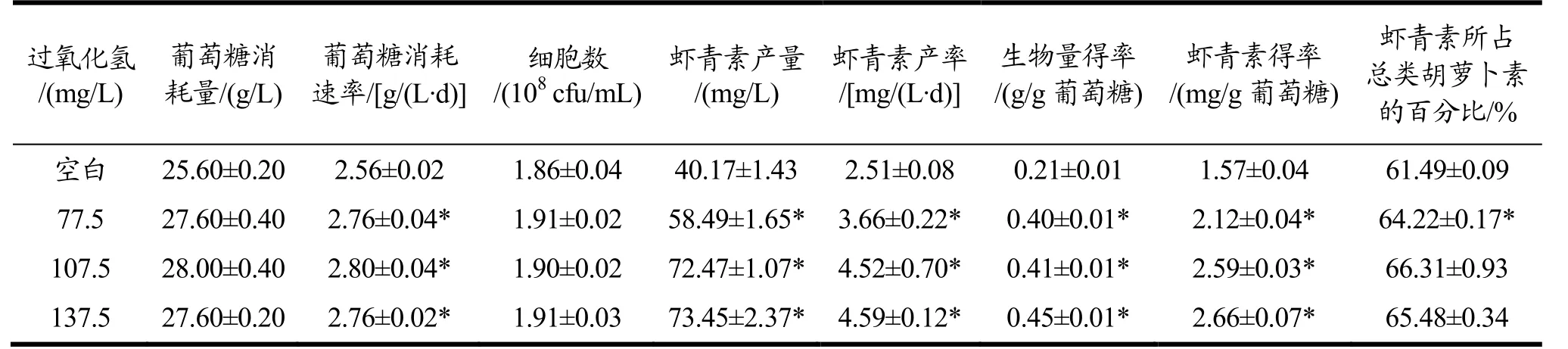
表2 不同乙醇浓度下佐夫色绿藻对葡萄糖消耗和虾青素积累情况的对比Table 2 Comparisons of average glucose consumption and astaxanthin accumulation in C.zofingiensis cultures with different hydrogen peroxide concentration
2.3 发酵工艺优化以强化佐夫色绿藻生产虾青素性能
在前期多诱导条件优化基础上,本研究在5 L光发酵罐中进行佐夫色绿藻放大培养,进一步分析比较了恒定高光强、低光强-高光强、低光强-高光强-补加过氧化氢三种发酵工艺对佐夫色绿藻生产虾青素的影响,从而获得最佳发酵工艺以强化佐夫色绿藻生产虾青素的性能。由图5a~c可知,三种不同发酵培养中,温度和pH值均处于藻细胞适宜生长的条件,但是不同光强及其变化对佐夫色绿藻细胞生长和葡萄糖消耗有直接影响。如图5a、5d所示,在恒定高光强组,藻细胞生物量增加较慢,葡萄糖消耗速率也较低,培养144 h结束后,共消耗葡萄糖浓度6.30 g/L,藻细胞密度为1.15×108CFU/mL,生物量较低,仅为8.05 g/L。这说明653 μmol/(m2·s)的高光直接抑制了藻细胞生长并减缓其对葡萄糖吸收利用,这是因为高光会损伤光系统PSII,从而影响了细胞的生长及营养物质的吸收,从而抑制了细胞分裂[26]。此外,需要注意的是高光培养效果还与培养体系有直接关系,如Del Campo等人[19]在460 μmol/(m2·s)恒定光强的圆柱状反应器中进行佐夫色绿藻培养10 d后,生物量从约0.30 g/L增加到7.00 g/L,生物量增加比较显著,此时高光强并没有抑制藻细胞生长,推测5 L发酵罐和圆柱反应器等不同培养体系因结构差异而对于外界光线具有不同光衰减效果,从而影响了光照培养效果。
而在先低光后高光实验组(图5b、e),藻细胞消耗葡萄糖的速率较快,在培养到36 h后,葡萄糖浓度就降低到6 g/L以下,之后补加到20 g/L后继续培养,之后葡萄糖消耗速率略有降低,培养结束后共消耗葡萄糖24.70 g/L。藻细胞生长速率也较快,在0~24 h及48~60 h的时间段内细胞数有显著增加,培养到72 h时生物量达到最大值16.15 g/L,之后略有降低并趋于平稳,培养结束后藻细胞生物量为14.75 g/L,同恒定高光强组相比增加83.23%,有显著的增长(p<0.05)。Chen等人[4]在摇瓶体系中采用两阶段培养策略,即先在35 μmol/(m2·s)弱光培养4 d,然后在80 μmol/(m2·s)强光下培养8 d,将藻细胞生物量从3.65 g/L提高到6.75 g/L以上,增加非常显著(p<0.01),这与本研究结果相似,但本研究获得的生物量更高。其中图5b中温度波动范围大的原因可能是由于外置光源强度的阶段式增大和发酵罐制冷系统响应不及时,导致培养24~72 h时培养体系的温度出现波动,但是基本都维持在藻细胞适宜生长的温度范围25~30 ℃之内[5],此时藻细胞生物量依然不断增加,这说明低光是影响藻细胞生长的主要因素。当培养到72 h时,光强从312.06 μmol/(m2·s)显著增加到539.46 μmol/(m2·s),此时高光和营养物质缺乏等胁迫条件协同作用从而诱导藻细胞内虾青素的积累,但会抑制藻细胞生长,因此藻细胞生长呈现出达到最大值后略有降低并趋于平稳的趋势。
在低光强-高光强-补加过氧化氢的发酵工艺优化实验中,在培养前12 h采用低光培养促进细胞生长并缩短延滞期,在培养到72 h后添加诱导剂过氧化氢从而强化藻细胞内虾青素的积累,实验结果如图5c、f所示。培养前12 h细胞生长速率较快,之后提高光强后,细胞生物量和细胞数短暂下降,继续培养72 h后,生物量才开始逐渐增加,培养结束后达到11.08 g/L,但是还是显著高于恒定高光强组。这说明前12 h低光培养还是有助于细胞生长,但可能时间还是太短,之后突然提高光强,产生了过多的光自由基,导致部分藻细胞损伤。培养前24 h的葡萄糖消耗速率较快,但之后也受到高光的抑制,培养结束后葡萄糖消耗量为16.10 g/L,显著低于低光强-高光强实验组。综上,低光强-高光强以及低光强-高光强-补加过氧化氢的生物量浓度分别为16.15 g/L和11.08 g/L显著高于恒定高光强(8.15 g/L)(p<0.05),从积累生物量角度而言,低光强-高光强的培养方式更有利于佐夫色绿藻生长。
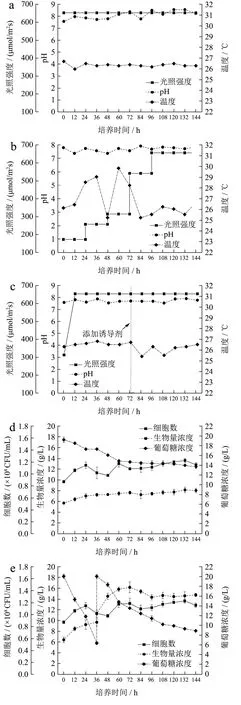
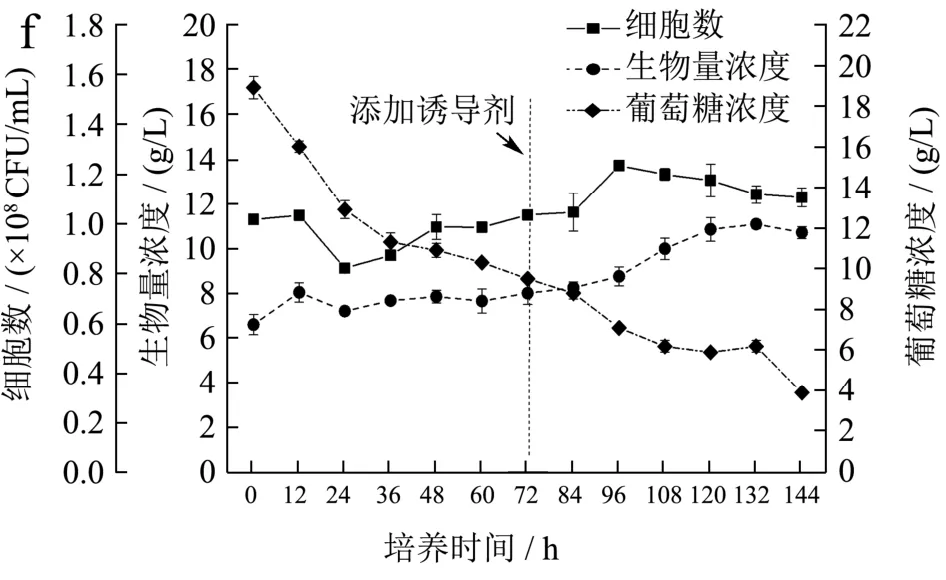
图5 不同光发酵罐培养过程中温度、pH值、光照强度以及佐夫色绿藻生长和葡萄糖消耗情况随培养时间的变化曲线Fig.5 Time courses of the changes of temperature, pH and light intensity, glucose consumption, and cell growth of C.zofingiensis grown in 5 L photo-fermenter with different culture conditions
三种不同发酵工艺对佐夫色绿藻积累虾青素的影响如图6所示。由图6a可知,在恒定高光强组,虾青素含量和产量随着培养时间的增加而呈现稳步上升的趋势,且培养到108 h时达到最大值,分别为2.80 mg/g和21.50 mg/L,分别是初始虾青素含量和产量的3.50倍和4.60倍,增加非常显著。Del Campo等人[19]采用圆筒装置对佐夫色绿藻在460 μmol/m2·s或者920 μmol/m2·s恒定光强下进行培养,其虾青素产量最高为19.00 mg/L,低于本实验结果。在低光强-高光强组(图6b),前期虾青素积累速率较慢,但培养至36 h之后,随着光强的提高,虾青素的含量和产量快速增长,推测其原因可能是葡萄糖的加入和光强增加会使得藻所在的环境处于适合藻生长和虾青素积累的高光及高C/N的条件[5,12]。在培养至96 h之后虾青素含量的增长速度降低,并在培养到132 h时虾青素含量达到最大值为2.66 mg/g,之后基本处于稳定状态,可能原因是培养至后期,细胞密度以及体积逐渐增大、细胞之间相互遮挡等因素,从而使得有效的光照强度降低,但低光强有助于细胞生长,故虾青素产量在培养至132 h时达到最大,为38.38 mg/L,相较于高光强条件下,尽管虾青素的含量略有降低,然而虾青素的产量提高了78.84%。Chen等人[4]同样采用低光强-高光强的培养策略进行培养288 h后,虾青素含量从1.80 mg/g增加到2.19 mg/g,而产量从6.58 mg/L增加到14.80 mg/L。这说明采用低光强-高光强能够提高佐夫色绿藻积累虾青素的能力,且在这种培养方式下不会显著降低细胞内虾青素含量。
在低光强-高光强-补加过氧化氢实验条件下,在培养前期虾青素含量虽然呈现不断增加趋势,但是增长较缓慢,与恒定高光强组的现象基本一致,结果如图6c所示。而在补加过氧化氢后的72~120 h内,虾青素含量的增加非常显著,从2.30 mg/g增加到3.82 mg/g。这相对于高光强和低光强-高光强实验组,分别提高了36.92%和43.60%,增加非常显著(p<0.05)。这说明补加过氧化氢对虾青素的积累具有显著的效果。此时,虾青素产量也达到最大值41.41 mg/L,产率为11.50 mg/L/d。之后继续培养,虾青素含量和产量均呈现下降趋势,这可能是由于细胞后期耐受高光强的能力下降,从而受到光氧化损伤,从而导致细胞数和生物量干重及虾青素含量和产量均呈下降的趋势。此外,由低光强-高光强-补加过氧化氢实验组的虾青素含量和产量变化可知(图6c),最佳的培养时间为120 h,此时采收可以确保获得最大虾青素生产效率并降低培养成本,相较于前两种培养方式能够获得更高的虾青素含量和产量。这种培养策略结合了低光强-高光强的模式的增加生物量浓度的优点,又提高了佐夫色绿藻的虾青素含量,最适宜用于佐夫色绿藻培养生产虾青素。


图6 不同光发酵罐培养条件下佐夫色绿藻胞内虾青素含量和产量随培养时间的变化曲线Fig.6 Time courses of the content and yield of astaxanthin in C.zofingiensis grown in 5 L photo-fermenter with different culture conditions
为了综合分析不同发酵培养条件对佐夫色绿藻生产积累虾青素的影响,本实验将不同培养条件下的藻细胞生产指标进行对比,结果如表3所示。
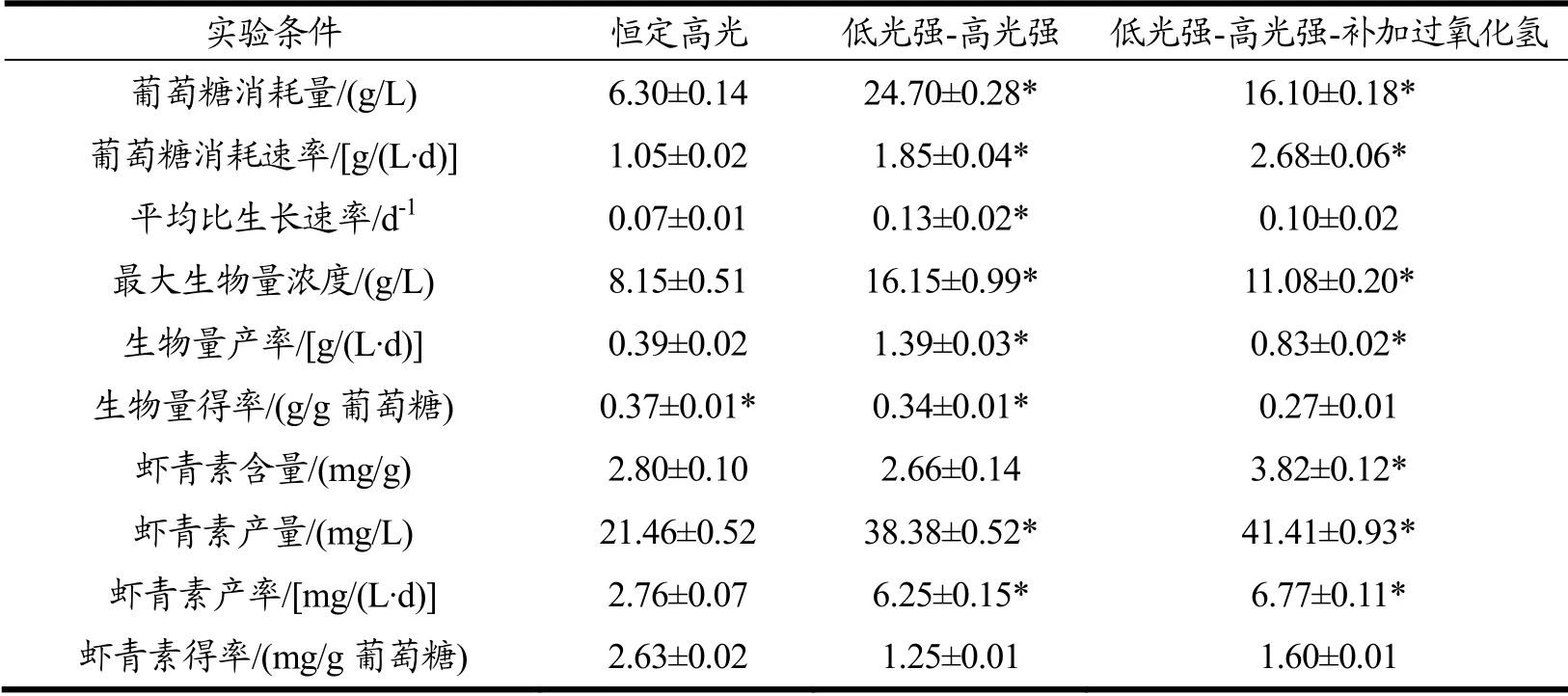
表3 三种不同发酵培养条件对佐夫色绿藻生产虾青素性能的影响对比分析Table 3 Comparisons of the effects of three different culture conditions on astaxanthin production by C.zofingiensis
由表3可知,在低光强-高光强实验组获得的藻细胞平均比生长速率最高为0.13 d-1,生物量产率达到最大值,为1.39 g/(L·d),显著高于恒定高光实验组。在虾青素积累方面,采用先低光后高光培养条件,在虾青素含量方面与恒定高光组无显著差异,但是由于生物量增长显著的原因,虾青素产量和产率也有显著提高。Liu等人[27]在350 μmol/(m2·s)高强光下进行C.zofingiensis的半连续培养,可以获得的生物量产率为0.79 g/(L·d),虾青素含量和产率分别为3.40 mg/g和2.70 mg/(L·d)。相对而言,本研究采用先低光后高光的发酵工艺,在不影响虾青素积累的前提上,可以显著提高佐夫色绿藻生产虾青素的能力。更进一步,采用培养中期补加过氧化氢的发酵培养,有助于提高藻细胞吸收利用葡萄糖的能力,最大消耗速率为2.68 g/(L·d),同时可以在此基础上显著提高虾青素的含量和产率。但培养结束后得到的藻细胞生物量得率和虾青素得率较低,仅为0.27 g/g和1.60 mg/g,这说明过多的葡萄糖消耗并没有被有效转化为生物量和虾青素,其中原因还有待深入研究。总之,采用低光强-高光强-补加过氧化氢的培养工艺最有利于佐夫色绿藻生产积累虾青素。
目前关于佐夫色绿藻的研究报道很多,然而利用发酵罐装置进行佐夫色绿藻培养积累虾青素的大多采用异养发酵。Sun等人[28]采用3.70 L的发酵装置在异养条件下对佐夫色绿藻培养了16 d,其最终获得虾青素产量为32.40 mg/L,低于本实验中采用低光强-高光强-补加过氧化氢发酵模式的结果。而Liu等人[29]利用3.70 L的发酵装置异养培养积累虾青素,尽管其最终获得虾青素产量为56.10 mg/L,然而其虾青素含量仅为1.23 mg/g,虾青素含量低于本研究中的结果。Chen等人[4]实验表明低光强-高光强两步法最有利于提高佐夫色绿藻生物量和虾青素产量,与本实验结果一致,并且本研究在此基础上产生加入了氧化诱导剂过氧化氢,进一步提高了虾青素产量。Zhang等人[11]采用两步法对佐夫色绿藻培养了16 d,其最高生物量浓度可达98.40 g/L,虾青素产量为73.30 mg/L,而其虾青素产率为5.24 mg/(L·d),低于本研究结果。以上研究结果进一步证明了本实验所采用于发酵罐中进行低光强-高光强-补加过氧化氢的发酵方式的科学性和优越性。
综上所述,采用光发酵罐的发酵模式进行佐夫色绿藻发酵培养具有其独特的优势,同时在培养前期(0~72 h)采用先低光后高光的阶梯式提高光强的培养策略有助于佐夫色绿藻细胞生长,而在培养中后期(72~120 h)通过添加过氧化氢进行诱导培养则有助于藻细胞内虾青素的高效积累。通过这两种培养策略可以使得佐夫色绿藻的虾青素生产性能得到显著提升,这可以为佐夫色绿藻的发酵培养优化以及规模化培养生产虾青素提供理论指导和参考依据,有利于推动佐夫色绿藻在天然虾青素商业化生产中的应用。
3 结论
本研究在摇瓶和光发酵罐中初步探索不同诱导条件和发酵工艺对佐夫色绿藻胞内虾青素积累的影响,从中可知采用葡萄糖和醋酸钠作为混合碳源优于单一碳源,同时添加过氧化氢进行诱导可优化佐夫色绿藻积累虾青素的效果。进一步在5 L光发酵罐实验中对上述优化条件进行验证,从而得出低光强-高光强-补加过氧化氢的发酵工艺最利于佐夫色绿藻积累虾青素,同时兼顾生物量和虾青素积累量,从而获得了最优的虾青素产量。本研究结果为高产虾青素的微藻规模化关键培养技术提供了重要研究基础。
