利用牡蛎制备DPP-IV抑制肽及其活性分析
2021-06-04陈玉磊张凌晶谢少浩刘光明曹敏杰
陈 宏,章 骞,2,陈玉磊,2,翁 凌,2,张凌晶,2,谢少浩,刘光明,2,曹敏杰,2,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.大连工业大学 海洋食品深加工协同创新中心,辽宁 大连 116034)
牡蛎,又称生蚝、蛎黄、海蛎子等,是我国重要的养殖贝类。据统计,2018年我国牡蛎产量达514万 t,占贝类总产量的35.6%,具有很高的经济价值[1]。牡蛎肉营养丰富,富含优质蛋白质、糖原、牛磺酸以及多种微量元素[2]。研究表明,利用牡蛎肉提取生物活性成分,具有抗氧化、抗肿瘤和降血压等活性功能[3-5]。福建牡蛎年产量达190万 t,但目前牡蛎主要以鲜食和传统粗加工为主[6-8],因此,利用现代食品生物技术实现牡蛎的精深加工和高值化利用,有助于牡蛎资源的高值化开发利用。
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和葡萄糖依赖性促胰岛素激素(glucose-dependent insulinotropic polypeptide,GIP)能够促进机体的胰岛素分泌,抑制胰高血糖素的分泌,在人体血糖平衡调节中具有重要作用[9]。研究发现,二肽基肽酶-IV(dipeptidyl peptidase-IV,DPP-IV)可将GLP-1和GIP氨基末端的两个氨基酸切除,使其失去生理功能,影响血糖调节[10]。因此,抑制DPP-IV活性有利于控制血糖水平。目前,以DPP-IV为治疗靶点,已开发出如西格列汀、维达列汀和沙格列汀等多种合成药物,它们对II型糖尿病具有良好的治疗效果,但这些药物往往伴随着一定的副作用[11]。据报道,食源性的DPP-IV抑制肽具有易吸收、安全性高等优点,近年来在II型糖尿病的预防方面备受关注[12]。目前,已有许多国内外学者从不同来源的蛋白质中获得DPP-IV抑制肽[13]。牡蛎富含优质蛋白质,是制备功能活性肽的理想原料,此外,牡蛎还含有丰富的锌元素[2],而锌元素具有调节胰岛素合成、分泌和葡萄糖转运等作用[14]。因此,利用牡蛎制备降血糖功能性食品更具有优势。
本研究以长牡蛎(Crassostrea gigas)为原料,以DPP-IV抑制率为指标,利用商品酶酶解牡蛎肉制备酶解液,分析其对DPP-IV的抑制效果。进一步对活性组分进行分离纯化和肽氨基酸组成鉴定,并对其进行合成验证,以期为牡蛎的功能性食品开发提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜长牡蛎购于厦门市夏商国际水产交易中心。
商品酶(木瓜蛋白酶(100 000 U/g)、碱性蛋白酶(200 000 U/g)、胰酶(4 000 U/g)、中性蛋白酶(400 000 U/g)) 广西南宁庞博生物工程有限公司;复合蛋白酶(1.5 AU/g) 诺维信生物技术有限公司;DPP-IV 美国Sigma-Aldrich公司;Sephadex G-15凝胶柱美国GE Healthcare公司;荧光底物甘氨酰-脯氨酸-MCA(Gly-Pro-MCA) 日本Peptide Institute公司;乙腈(色谱纯) 美国Tedia公司;合成肽HDGKGLFYNSYPD QEGKSDGTETSTNLHQKLYYHVLGTPQSEDVLCAE FP、APSTM和ILAPPER 合肥塞曼诺生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
PT-2100组织捣碎机 瑞士Kinematica公司;5417R小型高速冷冻离心机 德国Eppendorf公司;Infinite®M200 PRO酶标仪 瑞士Tecan公司;GF-1260高效液相色谱(high performance liquid chromatography,HPLC)仪美国Agilent公司;Triple TOF 6600质谱仪 美国AB SCIEX公司。
1.3 方法
1.3.1 酶解条件优化
1.3.1.1 商品酶的筛选
牡蛎肉与20 mmol/L缓冲液按料液比1∶2(g/mL)捣碎,选取5 种商品酶(木瓜蛋白酶、碱性蛋白酶、胰酶、中性蛋白酶和复合蛋白酶)在各自最适的pH值(相应的缓冲液)和温度下,加酶量为牡蛎肉质量的0.5%,酶解时间为150 min,制备得到酶解液,分别测定酶解液对DPP-IV的抑制活性,筛选最适的商品酶[15]。
1.3.1.2 加酶量的确定
选取对DPP-IV抑制效果最好的蛋白酶,在其最适反应温度和pH值条件下优化加酶量。在加酶量分别为0.2%、0.4%、0.6%、0.8%、1.0%条件下酶解牡蛎肉,测定酶解液对DPP-IV的抑制活性。
1.3.1.3 酶解时间的确定
在最适反应温度和pH值条件下优化牡蛎肉酶解时间。在酶解时间分别为30、60、90、120 min和150 min时,测定酶解液对DPP-IV的抑制活性。
1.3.2 DPP-IV抑制活性测定
参照Sato等[16]的方法并略作修改,依次将pH 8.0、20 mmol/L Tris-HCl缓冲液(50 μL)、DPP-IV(10 μL)、抑制剂(10 μL)加入到黑色酶标板混匀,在37 ℃孵育5 min,加入10 μmol/L荧光底物Gly-Pro-MCA溶液(30 μL)启动反应,继续在37 ℃条件下孵育30 min,利用酶标仪测定其荧光强度(激发波长380 nm,发射波长450 nm)。DPP-IV抑制率计算如下式所示:
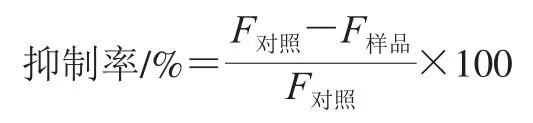
式中:F对照为对照组的荧光强度;F样品为实验组的荧光强度。
1.3.3 分子质量分布测定
参考Wu Qiang等[17]的方法。色谱条件:GF-1260 Agilent HPLC纯化系统;色谱柱为TSK G2000 SWXL(300 mm×7.8 mm);流动相乙腈-水-三氟乙酸(45∶55∶0.1,V/V);检测波长220 nm;进样量10 μL;流速0.5 mL/min;柱温25 ℃。用标准品分子质量的对数值和保留时间绘制得到标准曲线及方程。不同分子质量的标准溶液:鱼小清蛋白II,11 950 Da;50肽,5 617.97 Da;杆菌肽,1 422.69 Da;Gly-Gly-Arg-Tyr,451.48 Da;Tyr,181.19 Da。
1.3.4 超滤
称取牡蛎肉,按牡蛎肉-缓冲液(pH 8.0)1∶2(g/mL)捣碎均匀,根据单因素试验优化的酶解条件为:胰酶加酶量0.8%、pH 8.0、温度37 ℃、酶解90 min,结束后用100 ℃沸水浴中灭酶10 min,10 000×g离心10 min,取上清液。将上清液用3 kDa超滤膜超滤,分别收集内、外液,冷冻干燥,测定其对DPP-IV的抑制活性。
1.3.5 Sephadex G-15分离
将冷冻干燥的组分用超纯水复溶,用0.22 μm滤膜过滤后。将滤出液上样于超纯水平衡好的Sephadex G-15凝胶柱(1.5 cm×100 cm),测定各组分中多肽的浓度以及各组分对DPP-IV的IC50值,重复多次收集IC50值低的组分,冷冻干燥备用。
1.3.6 反相高效液相色谱(reverse phase-high performance liquid chromatography,RP-HPLC)分离
将Sephadex G-15凝胶柱分离得到的IC50最低组分进一步用RP-HPLC分离。纯化条件:GF-1260 Agilent HPLC纯化系统;色谱柱:ZORBAX SB-C18(4.6 mm×250 mm);流动相A:含0.1%三氟乙酸的超纯水,流动相B:含0.1%三氟乙酸的乙腈,洗脱条件:0~2 min,100% A,0% B;2~15 min,100%~75% A,0%~25% B;15~25 min,75%~50% A,25%~50% B;检测波长220 nm;进样体积20 μL;流速0.5 mL/min;柱温25 ℃。按出峰时间重复多次收集各组分,测定各组分对DPP-IV抑制活性,选取对DPP-IV抑制活性高的组分用质谱鉴定其氨基酸序列。
1.3.7 质谱鉴定
参照Zhang Jing等[18]的方法。将纯化得到的多肽组分重新溶解于Nano-LC流动相A(0.1%甲酸,2%乙腈)中,进行在线液相色谱-串联质谱分析。样品先经过脱盐保留后再经分析柱(C18反相色谱柱(75 μm×15 cm,3 μm,120 Å)Chrom XP Eksigent)分离,洗脱梯度:0~30 min,8%~38%流动相B(0.1%甲酸,95%乙腈)。
1.3.8 DPP-IV抑制肽的合成
纯度为95%以上的两种肽段Ala-Pro-Ser-Thr-Met(APSTM)和Ile-Leu-Ala-Pro-Pro-Glu-Arg(ILAPPER)委托合肥塞曼诺生物科技有限公司进行合成。
1.3.9 合成肽的DPP-IV抑制活性验证
为了验证合成肽对DPP-IV的抑制活性,取不同浓度的合成肽,参照1.3.2节方法,以抑制肽浓度对数值为横坐标,DPP-IV抑制率为纵坐标,经回归分析,计算得出合成肽对DPP-IV的半抑制浓度(IC50)[19]。
1.3.10 分子对接
DPP-IV(1WCY)的三维结构从PDB(Protein Data Bank)获取,抑制肽结构式利用ChemDraw 17.0软件构建,并优化其结构。利用AutoDock 4.2.6,将两个肽段分别与DPP-IV进行对接,并利用Discovery Studio 4.5分析对接结果。
1.4 数据分析
2 结果与分析
2.1 商品酶的筛选
将牡蛎肉分别用木瓜蛋白酶、碱性蛋白酶、胰酶、中性蛋白酶和复合蛋白酶最适pH值对应的20 mmol/L缓冲液进行酶解,制备酶解液。5 种蛋白酶酶解条件及其产物的DPP-IV抑制率如表1所示。由表1可知,胰酶酶解制备的酶解液对DPP-IV的抑制率最高,达到73%,碱性蛋白酶、中性蛋白酶和复合蛋白酶制备的酶解液对DPP-IV的抑制率相当(63%~64%),木瓜蛋白酶酶解产物抑制效果最差(47%)。因此,后续实验用胰酶作为工具酶开展研究。
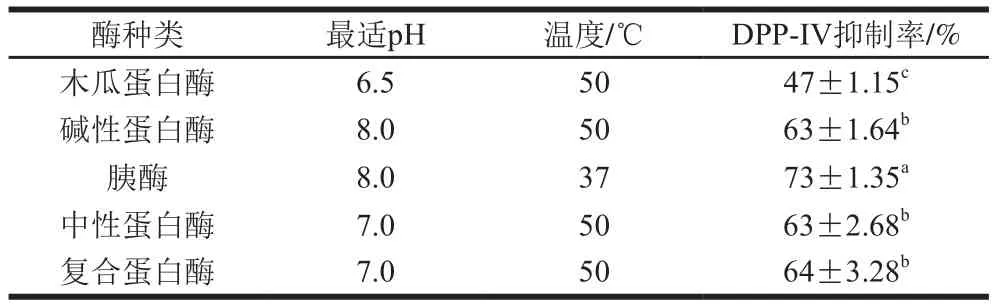
表15 种蛋白酶酶解条件及酶解产物的DPP-IV抑制率Table 1 Conditions for enzymatic hydrolysis of oyster with five proteases and DPP-IV inhibitory rates of the resulting hydrolysates
2.2 酶解液分子质量分布
在pH 8.0、温度37 ℃条件下,优化胰酶的加酶量和酶解时间进行牡蛎酶解液的制备,测定不同加酶量和酶解时间下酶解液的分子质量分布。由图1A可知,在酶解150 min的条件下,随着胰酶加酶量增加,分子质量>500 Da的各个组分所占比例微弱减少,分子质量<500 Da的组分所占比例相应增加。可能是由于酶解时间较长,分子质量分布比例变化不明显。由图1B可知,在加酶量为0.8%的条件下,随着酶解时间的延长,大量蛋白质底物逐渐被胰酶降解,分子质量>500 Da的组分占比从酶解30 min的34%下降到酶解150 min的15%,相应地,分子质量<500 Da的组分增加到85%。相比于Le Maux等[20]利用猪弹性蛋白酶酶解β-乳球蛋白获得不同水解度的酶解产物,分子质量<1 kDa的组分占比在70%以下,本研究制备的酶解液小分子质量组分占比更高。
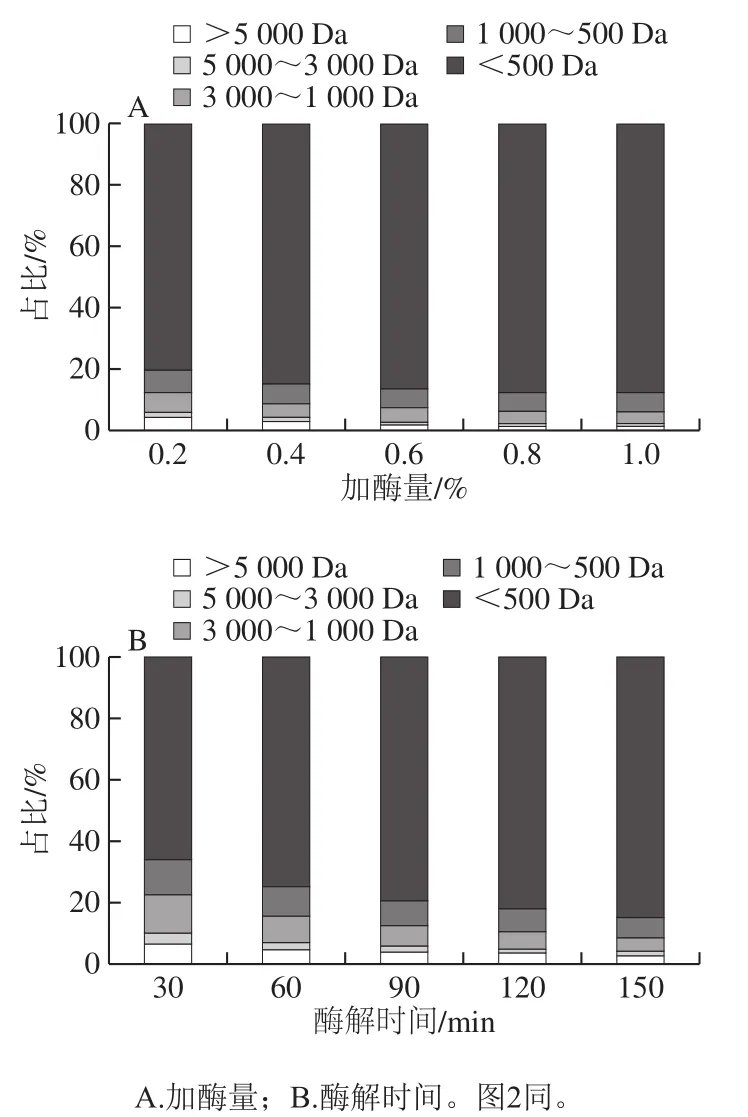
图1 加酶量和酶解时间对酶解液分子质量分布的影响Fig.1 Effects of enzyme dosage and hydrolysis duration on the molecular mass distribution of hydrolysates
2.3 胰酶酶解条件优化
进一步探究不同加酶量和酶解时间制备的酶解液对DPP-IV抑制活性的影响,对胰酶酶解条件进行优化。由图2A可知,随着加酶量增加,DPP-IV抑制率呈先上升后下降的趋势,这可能是由于酶过量时,一部分DPP-IV抑制肽被降解为更短的肽段或者氨基酸而降低或失去抑制活性[5,21]。选择加酶量为0.8%进一步优化酶解时间。由图2B可知,随着酶解时间延长,DPP-IV抑制率先上升后逐渐趋于平稳,推测是在酶解前期,牡蛎蛋白被胰酶降解,产生较多的DPP-IV抑制肽,尽管在90 min后仍有分子质量低于500 Da的小肽产生(图1B),由于底物中高分子质量组分的减少,反应趋于平缓。综上,最终确定胰酶酶解条件为加酶量0.8%、酶解时间90 min。
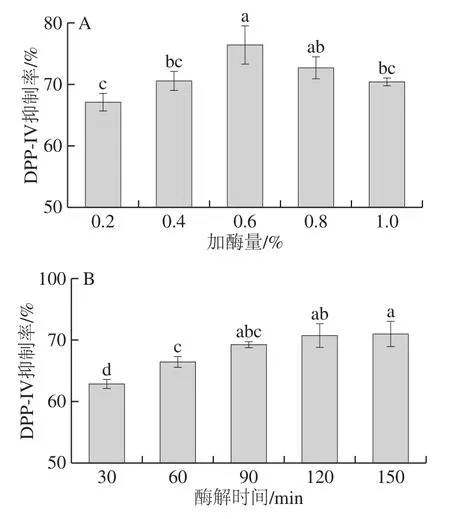
图 2加酶量和酶解时间对DPP-IV抑制率的影响Fig.2 Effects of enzyme dosage and hydrolysis duration on DPP-IV inhibitory rates of hydrolysates
2.4 超滤
牡蛎蛋白酶解液经3 kDa超滤膜超滤,得到分子质量<3 kDa和>3 kDa的两个组分,分别测定两个组分的IC50,由图3可知,<3 kDa组分的IC50值为1.41 mg/mL,显著低于>3 kDa组分的IC50值(56.89 mg/mL),两者相差40.3 倍。主要原因是>3 kDa组分是未被充分酶解的大分子多肽,不能进入到DPP-IV活性部位,因此,选择<3 kDa组分进行下一步分离纯化。
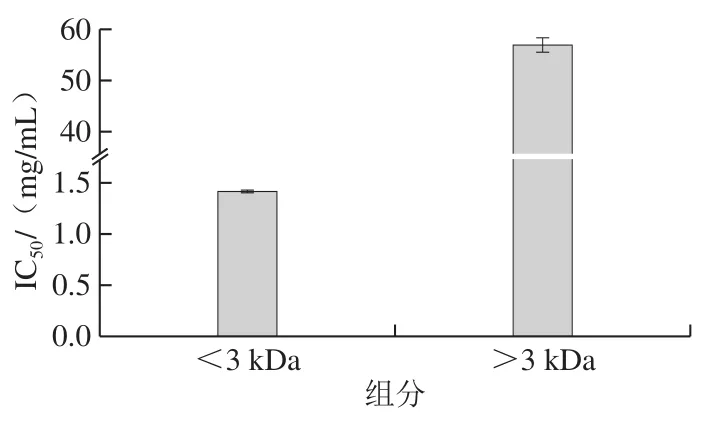
图3 超滤组分对DPP-IV的IC50Fig.3 IC50 of ultrafiltration fractions
2.5 Sephadex G-15分离
分子质量<3 kDa组分经Sephadex G-15凝胶层析分离得到4 个组分,如图4A所示,分别为F1、F2、F3和F4。将其分别冻干后,测定各组分的IC50值,结果如图4B所示,F2和F3组分的IC50值相当,分别为0.31 mg/mL和0.28 mg/mL,而F1和F4组分的IC50值均大于6 mg/mL。其中,F1组分可能是分子质量较大的多肽,F4组分主要以氨基酸为主,因而其IC50值较高。综上,选择F3组分进一步分离纯化。
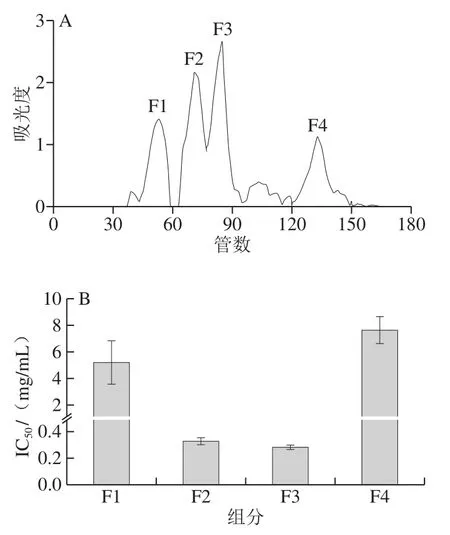
图4 Sephadex G-15凝胶柱层析图谱(A)及各组分对DPP-IV的IC50值(B)Fig.4 Sephadex G-15 gel chromatogram (A) and IC50 of all separated fractions (B)
2.6 RP-HPLC分离
F3组分继续利用RP-HPLC分离,结果如图5A所示。按分离度选取5 个组分F3-1、F3-2、F3-3、F3-4和F3-5,分别重复收集冻干,经复溶后配制成0.5 mg/mL的溶液,测定其对DPP-IV的抑制活性。由图5B可知,F3-4组分对DPP-IV的抑制率为34%,显著高于其他组分。收集F3-4组分用质谱鉴定其肽段序列。
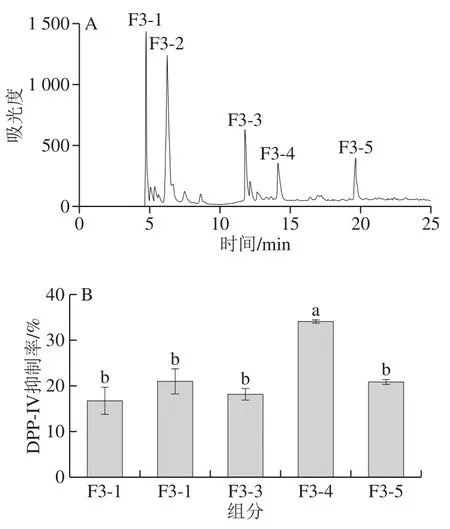
图5 RP-HPLC分离图谱(A)及各组分对DPP-IV的抑制率(B)Fig.5 RP-HPLC chromatogram of fraction F3 (A) and DPP-IV inhibitory rates of its sub-fractions (B)
2.7 质谱鉴定结果
F3-4组分经液相色谱-串联质谱鉴定分析,共得到10 个来源于牡蛎蛋白的肽段,包含6~12 个长度不等的氨基酸残基,从中筛选得到2 种多肽,如图6所示,氨基酸序列分别为Glu-Ile-Thr-Ala-Leu-Ala-Pro-Ser-Thr-Met-Lys(EITALAPSTMK,分子质量1 161.36 Da)和Ile-Leu-Ala-Pro-Pro-Glu-Arg(ILAPPER,分子质量794.94 Da)作进一步研究。
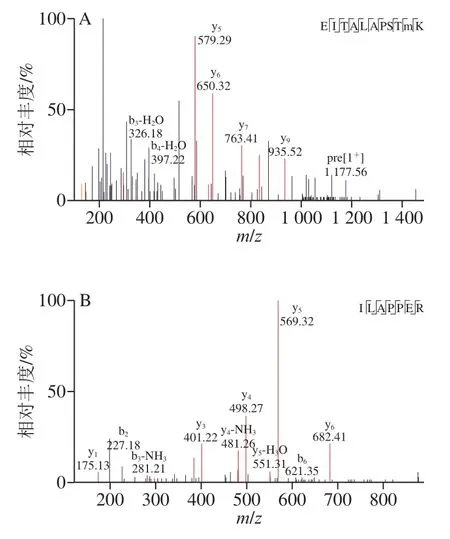
图6 EITALAPSTMK(A)和ILAPPER(B)的质谱图Fig.6 Mass spectra of EITALAPSTMK (A) and ILAPPER (B)
2.8 DPP-IV抑制肽抑制活性验证

图7 合成肽APSTM和ILAPPER对DPP-IV的IC50值Fig.7 IC50 of synthetic DPP-IV inhibitory peptides APSTM and ILAPPER
经质谱鉴定得到2 个具有潜在DPP-IV抑制活性的肽段EITALAPSTMK和ILAPPER。肽段EITALAPSTMK序列较长,通过BIOPEP[22]在线预测模拟胃肠液消化后得到肽段APSTM。合成肽APSTM和ILAPPER,分子质量分别为505.59 Da和794.94 Da。进一步测定合成肽对DPP-IV的抑制活性,如图7所示,2 种合成肽APSTM和ILAPPER的IC50值分别为354.81 μmol/L和16.98 μmol/L,其中,七肽ILAPPER的IC50值(16.98 μmol/L)接近于阳性对照抑制肽Ile-Pro-Ile(Diprotin A)的IC50值(12.45 μmol/L)。APSTM的IC50值高于ILAPPER,可能是由于其N-端第2个氨基酸为Pro的肽段容易被DPP-IV降解有关[23]。此外,APSTM的IC50高于Liu Rui等[24]报道的肽段LAPSTM(140.82 μmol/L),可能是由于LAPSTM的N-末端的疏水性氨基酸残基(Leu、Ala和Pro)较多,增强了与DPP-IV活性部位结合的特异性[25]。
2.9 分子对接
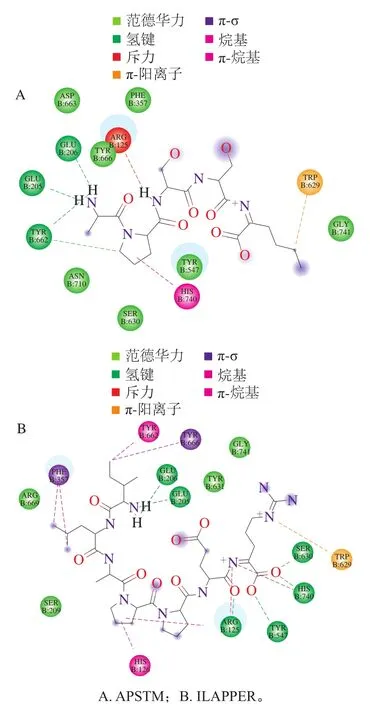
图8 APSTM和ILAPPER与DPP-IV的分子对接Fig.8 Molecular docking of APSTM and ILAPPER with DPP-IV
分子对接广泛应用于研究配体与受体之间的相互作用,继而揭示它们的结合位点和结合模式[26]。DPP-IV的催化三连体为Ser630、Asp708和His740[27],活性部位包含疏水口袋S1(Tyr631、Val656、Trp659、Tyr662、Tyr666和Val711)和电荷口袋S2(Arg125、Glu205、Glu206、Phe357、Ser209和Arg358)组成[28]。如图8所示,APSTM中Ala的氨基有两个氢原子与DPP-IV的S1口袋Tyr662和S2口袋Glu205、Glu206形成3 个氢键,且Tyr662与Pro的吡咯环形成氢键,与Ser630、Tyr666等氨基酸残基形成的范德华力主要集中在APSTM的N-末端,与Trp629、His740形成π键。ILAPPER和DPP-IV的氢键作用力体现在:催化中心Ser630、His740与Arg的羧基,S2口袋的Glu205、Glu206与Ile的氨基氢原子,Arg125与Glu的羧基,以及Tyr547与Arg的羧基形成氢键,与活性位点的Tyr631、Ser209所形成的范德华力集中在ILAPPER的N-末端,与Arg125、His126、Phe357、Trp629和Tyr666形成π键。据文献报道,DPP-IV抑制肽主要与其催化中心、S1和S2口袋等关键氨基酸形成相互作用力[29-31]。结合两个肽段对DPP-IV的抑制活性,尽管它们均与DPP-IV的关键氨基酸Arg125、Glu205、Glu206形成氢键,以及范德华力均集中在N-末端,但ILAPPER与DPP-IV的催化中心Ser630形成作用力更强的氢键,且形成更多的π键。因此,ILAPPER对DPP-IV具有更好的抑制效果。
3 结 论
牡蛎含有丰富的蛋白质,利用胰酶酶解可制备对DPP-IV具有抑制作用的产物。优化酶解条件为胰酶加酶量0.8%、pH 8.0、温度37 ℃、酶解时间90 min。酶解液经超滤、Sephadex G-15和RP-HPLC分离纯化得到最终组分F3-4,质谱鉴定出2 种多肽的氨基酸序列EITALAPSTMK和ILAPPER,在线模拟胃肠液消化后,合成了APSTM和ILAPPER两个肽段。结果显示,两个肽段对DPP-IV的IC50值分别为354.81 μmol/L和16.98 μmol/L。通过分子对接模拟,2 个抑制肽主要与DPP-IV活性部位以氢键、范德华力和π键相互作用,而ILAPPER与DPP-IV的催化中心Ser630形成作用力更强的氢键并且形成更多的π键,因此ILAPPER的抑制效果较好。本研究分离纯化的牡蛎肽具有DPP-IV抑制活性,为牡蛎肉的精深加工和高值化利用提供了理论依据。
