血清活性氧簇、还原型谷胱甘肽水平与原发性胆汁性肝硬化的相关性分析
2021-06-04江小云马思思董家琪
江小云,陈 科,马思思,董家琪
(四川省德阳市人民医院消化内科,四川 德阳 618000)
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)为消化内科因肝内小胆管进行性非化脓性炎症引发的胆汁淤积性疾病[1]。目前,临床针对PBC的病因机制尚不明确,可能与遗传、环境、自身免疫等有关,诊断以症状体征、免疫学检查及组织病理学检查等综合判断为主[2]。随着分子生物学及细胞因子学的不断发展,诸多学者指出PBC发病及进展中存在多种血清学指标变化,早期监测可为PBC临床诊断及病情发展提供重要依据[3]。PBC是免疫介导的炎性疾病,其病理学特点以肝纤维化及肝细胞破坏等为主,不及时治疗可发展为肝衰竭[4]。血清活性氧簇(ROS)是一类由吞噬细胞分泌释放的细胞因子,在正常生理状态下通过肝脏的酶系统发挥解毒作用,而当肝细胞破坏后,过量的ROS则反过来加剧炎症反应,促使肝功能障碍[5]。还原型谷胱甘肽(GSH)作为抗氧化剂的一种,可中和“ROS”作用,起到缓解肝损伤,减轻氧化应激反应的效果[6]。目前,有关ROS、GSH水平与氧化应激的关系及相互作用已有报道[7],但其在PBC中的变化及诊断效能尚无定论。本研究探讨两种血清标志物与PBC的相关性,为临床判断提供可靠数据支撑。
1 资料与方法
1.1 一般资料2017年1月至2019年6月我院接受治疗的121例PBC患者(观察组),纳入标准:①符合美国肝脏病学会(AASLD)2009年颁布的PBC相关诊断标准[8],并通过肝穿刺病理学检查确诊者;②其家属自愿签署知情同意书者;③临床各项检查资料完整者;④年龄≥18岁者;⑤初次确诊为PBC,并于我院接受熊去氧胆酸(UDCA)治疗者。排除标准:①合并心、脑等器官病变者;②合并自身免疫性疾病者;③合并原发性肝癌、肝血管瘤、肝腺瘤、肝囊肿、肝硬化再生结节等肝内占位性病变者;④遵医行为差,无法配合后续随访工作者;⑤治疗前已存在干燥综合征、甲状腺炎、骨质疏松等并发症者。选取同期接受体检的自愿者60例为健康对照组。观察组男9例,女112例,年龄35~76岁[(54.52±7.54)岁],体重指数(BMI)20 ~24 kg/m2[(22.50±0.84)kg/m2],健康对照组男4例,女56例,年龄34~70岁[(53.21±7.14)岁],BMI 20 ~24 kg/m2[(22.67±0.91)kg/m2]。两组性别、年龄、BMI比较差异无统计学意义(P>0.05),具有可比性。本研究已获得医院伦理会员会批准。
1.2 方法常规静脉采血后提取血清,通过CA-800C全自动生化分析仪(桂林优利特医疗电子有限公司,桂械注准20172400011)测定两组丙氨酸转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、白蛋白(ALB)水平;采用酶联免疫法测定透明质酸(HA),试剂盒来自深圳市安群生物工程有限公司;采用化学发光法测定层粘连蛋白(LN),试剂盒来自深圳市新产业生物医学工程股份有限公司;采用酶联免疫法测定Ⅲ型前胶原(PCⅢ)水平,试剂盒来自深圳市安群生物工程有限公司;采用磁微粒化学发光法测定Ⅳ型胶原(type Ⅳ collagen,Ⅳ-C),试剂盒来自郑州安图生物工程股份有限公司。采用酶联免疫发测定ROS,试剂盒来自上海仁捷生物科技有限公司,室温血液20~25 ℃自然凝固10~20 min,离心20 min左右(2000~3000转/min),用无菌管仔细收集上清,保存过程中如出现沉淀,应再次离心,使用ELISACalc软件分析标准曲线。采用微板法测定GSH,试剂盒来自南京建成生物工程研究所,取待测样本0.5 ml,加试剂一应用液2 ml混匀,3500~4000转/min离心10 min,取上清液1 ml进行显色反应,按步骤加入样本和试剂,混匀,静置5分钟,420 nm波长,1 cm光径,比色测定各管吸光度值。均严格按照试剂盒说明书操作。
1.3 观察指标收集临床资料,比较两组肝功能(ALT、AST、TBIL、ALB)、肝纤维化指标(HA、LN、PCⅢ、Ⅳ-C)及血清ROS、GSH水平。评估血清指标单独及联合检测对PBC的诊断价值,分析PBC患者血清ROS、GSH水平与相关生化指标之间的相关性。
1.4 统计学方法应用SPSS 18.0统计学软件分析数据。计量资料以均数±标准差表示,多组间比较采用单因素方差分析及SNK-q检验;经受试者工作曲线(ROC)评估血清指标单独及联合检测对PBC的诊断价值。并采用Pearson相关分析PBC患者血清ROS、GSH水平与相关生化指标之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 两组肝功能指标比较观察组ALT、AST、TBIL水平高于健康对照组,ALB水平低于健康对照组(P<0.05),见表1。

表1 两组ALT、AST、TBIL、ALB水平比较
2.2 两组肝纤维化指标比较观察组HA、LN、PCⅢ、Ⅳ-C水平高于健康对照组,血清ROS、GSH水平高于健康对照组(P<0.05)。见表2。
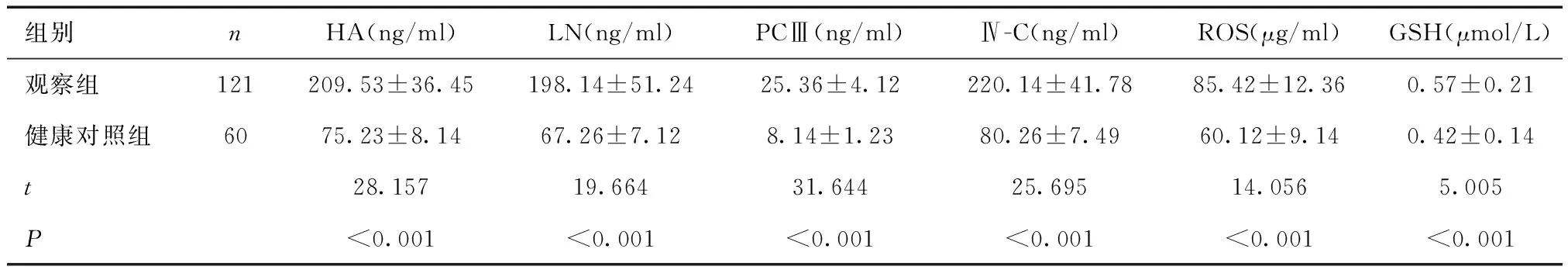
表2 两组肝纤维化指标及血清ROS、GSH水平比较
2.3 血清指标诊断效能评估单独检测及联合检测血清ROS、GSH水平均可作为诊断PBC的效能指标(P<0.05),见表3及图1。
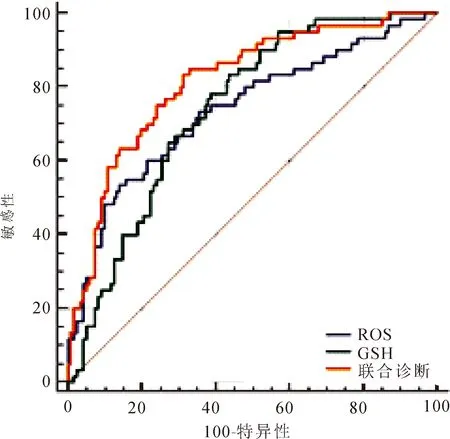
图1 血清ROS、GSH单独及联合检测诊断PBC的ROC图
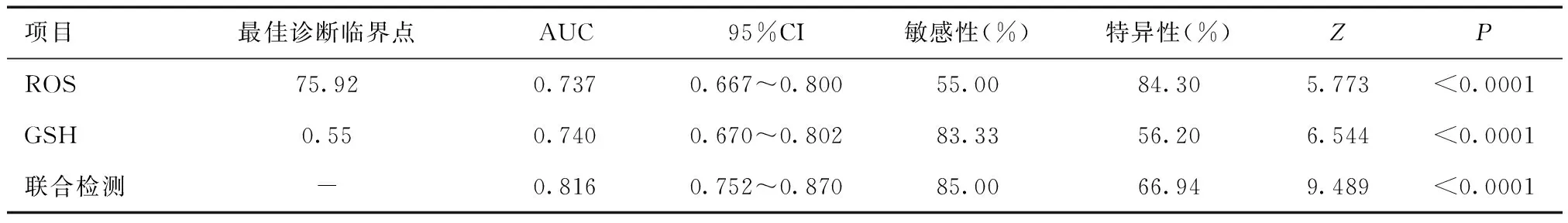
表3 血清ROS、GSH水平对PBC的诊断效能
2.4 相关性分析PBC患者血清ROS水平与ALT、AST、TBIL、HA、LN、PCⅢ、Ⅳ-C指标呈正相关(P<0.05),GSH水平与ALT、AST、HA、LN、PCⅢ、Ⅳ-C指标均呈负相关(P<0.05)。见表4。
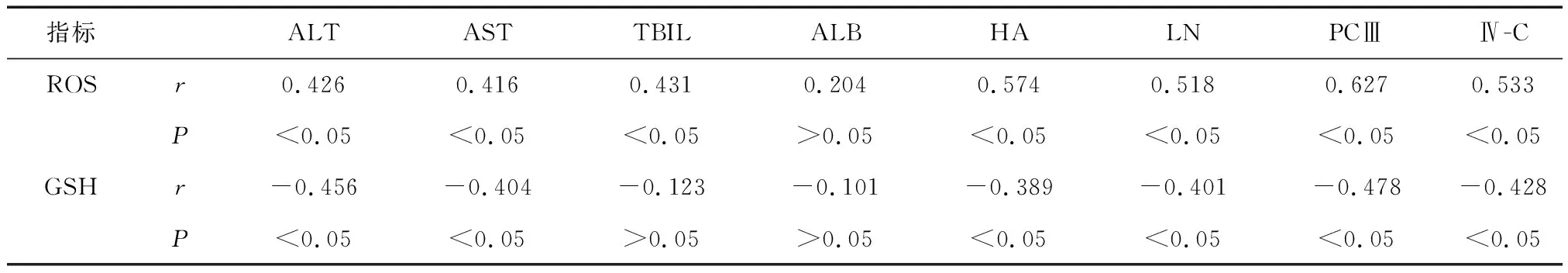
表4 PBC患者血清ROS、GSH水平与疾病相关生化指标的相关性分析
3 讨论
现代医学认为PBC患者伴有不同程度的肝功能受损,因小叶间胆管炎症反应导致胆汁淤积,门管区淋巴细胞浸润,而引起肝细胞损伤,并发展为肝纤维化及肝硬化,甚至肝衰竭等,临床治疗则以改善肝功能、减轻肝纤维化程度为主[9]。本文结果中,观察组ALT、AST、TBIL、HA、LN、PCⅢ、Ⅳ-C水平较健康人异常升高,而ALB水平明显降低,则证实PBC患者确存在肝纤维化进展。
PBC是一类病因不明的肝脏炎性疾病,美国肝病学会认为诊断PBC需依靠影像学显示肝功能改变、实验室指标检测胆红素升高、线粒体抗体阳性等并具有相应病理学及临床症状表现来综合评估[10]。研究发现,早期PBC患者无特征性抗体阳性,且临床症状不明显,较易与慢性肝炎等其他肝脏疾病混淆,因此尽早做肝穿刺病例检查是早期诊断PBC的金标准[11]。但考虑病理学穿刺活检检查有创,不利于推行,而随着研究的不断深入,诸多血清学指标与PBC发病的相关性得到关注,通过早期检测血清学指标不仅可为临床解释PBC发病机制提供依据,且还可在一定程度上辅助早期诊断[12]。本研究选取血清ROS及GSH指标,作为早期诊断PBC的依据,结果发现观察组血清ROS、GSH水平异常升高,且经ROC曲线分析,其可作为临床诊断PBC的血清指标,联合检测的敏感度及特异度可达85.00%及66.94%,表明早期检测血清ROS、GSH水平可在一定程度上帮助临床医师判断疾病。
另外,相关性分析发现,PBC患者血清ROS、GSH水平与部分肝功能及肝纤维化指标具有一定关联,提示当机体发生肝硬化或肝纤维化时,肝脏细胞发生肿胀变性或坏死,而血清ROS、GSH指标则参与其病变,部分指标之间无相关性可能与样本量较少有关,又或者肝功能损伤受诸多因素影响,血清指标的检测具有一定局限性。血清ROS、GSH指标与ALT、AST、HA、LN等指标具有相关性可能是因为,肝损伤将引起细胞外基质沉积,并改变其生理状态,且随着损伤加重,可引发肝纤维化的形成,并进一步导致肝硬化[13]。PBC患者体内伴有强烈的氧化应激反应,对核酸、蛋白质、脂类等的合成造成一定破坏。而ROS由线粒体中的电子传递链及蛋白质合成,是机体抵御外界病原体入侵的第一道预防机制,但当肝损伤后,氧化应激反应严重,激活的库普弗细胞及浸润中性粒细胞则可导致ROS水平异常升高,而过量的ROS又可加剧炎症反应,导致肝功能进一步恶化。GSH是一种在肝脏内合成的硫醇和三肽分子,属于抗氧化剂的一种,廖攀等[14]发现其可有效降低中性粒细胞内的ROS水平,两者具有互相制约、互相影响的关系。肝脏对GSH周转及器官间的水平稳态具有重要意义,而肝功能损伤后可引起内源性利用失衡,进而导致过度消耗,氧化应激反应可抑制GSH还原酶功能,进而导致氧化性GSH累积,降低机体抗氧化能力,进而表现出水平升高的情况。董亚芬等[15]发现,肝纤维形成过程中血清ROS及GSH异常升高,与本研究结果较为一致。
综上所述,PBC患者血清ROS、GSH水平异常升高,可能参与肝细胞损伤及肝纤维化形成,可作为临床早期诊断的重要指标,具有一定意义。本研究不足之处在于,在选取疾病相关生化指标时不够详细,未纳入免疫指标等,且因样本地区限制等,样本量较少,使结果具有一定局限,有待后期加强后再次探究。
