核黄素结合肽的生物活性及结构表征
2021-06-03阴宏婕鞠化鹏钟利敏林松毅
阴宏婕,鞠化鹏,钟利敏,孙 娜,林松毅,*
(1.大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034;2.赣州市全标生物科技有限公司,江西 赣州 341100)
核黄素,即VB2,是一种水溶性维生素。它在生物氧化还原反应、细胞功能和生长发育发面发挥很重要的作用。核黄素是黄素腺嘌呤二核苷酸和黄素单核苷酸的前体物质[1-2]。这两种物质是核黄素主要的生物活性形式,也是合成还原酶、氧化酶和脱氢酶的主要形式[3]。人体自身不能合成核黄素,必须通过小肠从饮食中获取[4]。核黄素缺乏在年轻和老年人群中普遍存在,甚至在发达国家也是如此[5]。核黄素的缺乏会引起很多人体的不良反应和疾病,如生长迟缓、贫血、皮肤损伤、肾脏损害和神经退行性病变[6]。
核黄素结合蛋白作为黄素-蛋白相互作用的模型已被研究多年。Rhodes等[7]最先从鸡蛋清中发现核黄素结合蛋白。之后研究者相继在原核生物和真菌中发现核黄素结合蛋白[8-9]。有研究报道称,核黄素在人体内通过核黄素转运蛋白(human riboflavin transporter,hRFVT)1、hRFVT-2和hRFVT-3被肠道吸收[10-12]。近年来,核黄素与蛋白之间的相互作用也得到进一步研究。Zhao Hongwei等[13]的研究表明,核黄素可以与人血清白蛋白和牛血清白蛋白结合,其结合位点为色氨酸残基;Sengupta等[14]利用稳态荧光实验发现核黄素与人血清白蛋白的色氨酸214残基结合。然而,关于核黄素与肽之间相互作用的研究尚鲜见报道。
核黄素可与蛋白多肽链中的色氨酸发生相互作用而结合,且色氨酸具有抗氧化能力,可以提高多肽清除自由基的能力[15]。本课题组前期研究通过酶解、Sephadex凝胶G-25过滤柱层析法和高效液相色谱-串联质谱法从分子质量3~10 kDa的松仁粕蛋白中提取并纯化得到一种新型松子肽Ac-QWFCT,该新型松子肽具有良好的抗氧化活性[16]。本实验采用松子肽Ac-QWFCT与核黄素相互作用制备核黄素结合肽。用扫描电子显微镜观察核黄素结合肽的微观结构;基于RAW264.7细胞研究肽Ac-QWFCT、核黄素以及核黄素结合肽对巨噬细胞的细胞活性、中性红吞噬率和NO释放率的影响;通过测定1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除率评价核黄素结合肽抗氧化活性;利用荧光光谱、傅里叶变换红外光谱和核磁共振氢谱研究肽Ac-QWFCT与核黄素的相互 作用;通过翻转肠囊法研究核黄素结合肽在大鼠肠道的吸收特性。本研究可为新型VB2补充剂的开发提供理论参考和科学依据。
1 材料与方法
1.1 动物、材料与试剂
小鼠巨噬细胞RAW264.7由中国科学院上海细胞库提供;Wistar雄性大鼠(体质量180~220 g;生产许可证号:SCXK(辽)2020-0001)购于辽宁长生生物科技有限公司;实验前于大连工业大学动物实验室(使用许可证号:SYXK(辽)2017-0005)适应性喂养1 周。
肽Ac-QWFCT 合肥赛曼诺生物科技有限公司;核黄素、DPPH、ABTS、噻唑蓝(3-(4,5-dimethyl-2-thiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)、二甲基亚砜、重水(纯度99.8%) 美国Sigma公司;DMEM细胞培养液、胎牛血清、青链霉素混合液、L-谷氨酰胺、磷酸盐缓冲液(phosphate buffered saline,PBS) 美国Gibco公司;中性红检测试剂盒、NO检测试剂盒 上海碧云天生物技术有限公司;甲醇 北京化工厂;乙腈、甲酸 美国Fisher公司;溴化钾 天津光复化学试剂厂。
1.2 仪器与设备
JSM-7800F场发射扫描电子显微镜 日本电子株式会社;Synergy HT多功能酶标仪 美国博腾仪器有限公司;AVANCE III 400 MHz型核磁共振波谱仪 德国 Bruker公司;IR Prestige-21傅里叶变换红外光谱仪 日本岛津公司;ACQUITY UPLC H-Class PLUS超高效液相色谱仪 美国Waters公司;BT125D电子天平 赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 核黄素结合肽的制备
称取一定量的肽Ac-QWFCT与核黄素,溶解于蒸馏水中。将肽溶液与核黄素溶液按照物质的量比10∶1混合。配制的混合溶液在室温下避光磁力搅拌3 h。样品经真空冷冻干燥成粉末,放置在-80 ℃冰箱保存备用。
1.3.2 扫描电子显微镜观察微观结构
参照Jin Yan等[17]的方法,利用扫描电子显微镜观察肽Ac-QWFCT、核黄素和核黄素结合肽的微观结构。 将10 μL样品溶液滴加在矩形铜块上的圆形凹槽内。将铜块浸入液氮中预冷抽真空,然后将样品置于15 mA电流下镀金90 s。最后将样品置于5 kV加速器电位下拍照。
1.3.3 免疫活性检测
1.3.3.1 RAW264.7细胞活性检测
细胞处理:参照Yuan Qingxia等[18]的方法,将指数生长期RAW264.7细胞接种于96 孔板中,细胞密度2×105个/mL,每孔接种100 μL。细胞在37 ℃、5% CO2培养箱中培养24 h后,弃掉培养液,分别加入终质量浓度为12.5、25、50 μg/mL的肽Ac-QWFCT、核黄素和核黄素结合肽溶液;以不含样品溶液的培养基作为空白对照,加入含终质量浓度25 μg/mL脂多糖(lipopolysaccharide,LPS)的培养基作为阳性对照。
在培养箱中培养24 h后,加入20 μL 5 mg/mL MTT溶液,继续培养4 h,弃掉培养基,用PBS清洗2 次,加入150 μL二甲基亚砜。室温放置10 min后用酶标仪于490 nm波长处测定溶液吸光度。细胞存活率按式(1)计算。

式中:A样品为样品组溶液A490nm;A对照为空白对照组溶液A490nm。
1.3.3.2 RAW264.7细胞中性红吞噬率和NO释放率测定
中性红吞噬率:细胞处理方法同1.3.3.1节,在培养箱中培养24 h后,吸取50 μL上清液备用,用PBS清洗3 次,向每孔加入100 μL质量分数0.075%的中性红溶液,培养4 min。弃掉中性红溶液,用PBS清洗2 次,再向每孔加入100 μL细胞裂解液(1 mol/L无水乙醇-乙酸,1∶1,V/V),室温下裂解30 min。用酶标仪于540 nm波长处测定溶液吸光度。中性红吞噬率按式(2)计算。

式中:A样品为样品组溶液A540nm;A对照为空白对照组溶液A540nm。
NO释放率:细胞处理方法同1.3.3.1节,在培养箱中培养24 h后,吸取50 μL细胞上清液,按照NO检测试剂盒说明书操作步骤,每孔分别加入50 μL Griess I试剂和50 μL Griess II试剂。用酶标仪于540 nm波长处测定溶液吸光度。以溶液吸光度为纵坐标,NO浓度为横坐标绘制得到标准曲线:Y=0.0128X+0.0426(R2=0.9995)。根据标准曲线计算细胞内NO浓度。
1.3.4 抗氧化活性检测
DPPH自由基清除率测定:参照Yang Ruiwen等[16]的方法,将一定质量浓度的样品溶液、甲醇溶液和DPPH-甲 醇溶液各取100 μL,加入96 孔板中,空白组用甲醇代替样品溶液。室温下避光30 min后,用酶标仪于517 nm波长处测定反应体系溶液吸光度。DPPH自由基清除率按 式(3)计算。
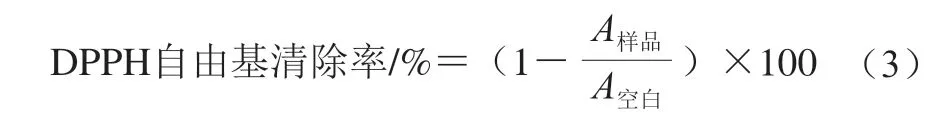
式中:A样品为样品组反应体系溶液517 nm波长处吸光度;A空白为空白组反应体系溶液517 nm波长处吸光度。
ABTS阳离子自由基清除率测定:参照Liang Rong等[19]的方法,将ABTS用蒸馏水配制成浓度7 mmol/L的溶液,室温下避光放置12~16 h。用蒸馏水稀释ABTS溶液直至其在734 nm波长处的吸光度为0.70±0.02。将50 μL一定质量浓度的样品溶液和150 μL稀释后的ABTS溶液加入96 孔板中,室温下避光反应60 min。用酶标仪于734 nm波长处测定反应体系溶液吸光度。以相同体积分数95%乙醇溶液替代样品溶液为空白组。ABTS阳离子自由基清除率按式(4)计算。

式中:A样品为样品组反应体系溶液734 nm波长处吸光度;A空白为空白组反应体系溶液734 nm波长处吸光度。
1.3.5 荧光光谱测定
参照Duurkens等[20]描述的实验方法,将3 mL样品溶液置于1 cm四通石英比色皿中,在激发波长280 nm处测定300~450 nm波长范围内的发射光谱。所有实验均在室温下进行。激发和发射光谱狭缝宽度均为5 nm。
1.3.6 傅里叶变换红外光谱测定
采用Sun Na等[21]的方法,取200 mg干燥后的溴化钾(130 ℃下干燥8 h以上)和2 mg样品在研钵中研磨成均匀粉末,压成薄片,进行傅里叶变换红外光谱测定。波数扫描范围4000~400 cm-1,分辨率4 cm-1。
1.3.7 核磁共振氢谱分析
参照Xing Jie等[22]的方法,将5 mg核黄素、肽Ac-QWFCT 和核黄素结合肽粉末溶解在500 μL重水中,将不同样品溶液置于5 mm核磁管中。检测探头为BBFO探头(5 mm),脉冲宽度13 μs、抽样延迟时间6 s、采样频率32。
1.3.8 大鼠外翻肠囊研究样品吸收特性
将Wistar雄性大鼠适应性喂养1 周后进行大鼠外翻肠囊研究。参照Wang Liying等[23]的方法,大鼠禁食12~18 h后,腹腔注射2 mL巴比妥钠麻醉。切开腹部,迅速收集小肠并放置于冰Kreb-Ringer缓冲液中,用细玻璃棒将肠腔翻转,用Kreb-Ringer缓冲液冲洗肠内容物。用丝线将一端系紧,从另一端灌入1 mL Kreb-Ringer缓冲液。将肠囊置于7 mL、37 ℃的核黄素、肽Ac-QWFCT以及核黄素结合肽溶液中,溶液中通入95% O2和5% CO2。2 h后从浆膜侧收集样液,用0.22 μm滤膜过滤,进行超高效液相色谱分析。
色谱条件:色谱柱:ACQUITY UPLC BEH C18柱(2.1 mm×50 mm,1.7 μm);流动相A:体积分数0.1%甲酸-水溶液;流动相B:纯乙腈;柱温30 ℃;检测波长220 nm;进样体积5 μL;流速0.3 mL/min。洗脱条件:0 min,95%流动相A、5%流动相B;3.5 min,25%流动相A、75%流动相B。以核黄素标准品作标准曲线计算浆膜侧样液核黄素浓度。
1.4 数据处理与分析
所得结果用平均值±标准差表示,采用Origin 8.0软件进行数据处理和作图,采用SPSS Statistics 20软件中最小显著性差异法进行差异显著性分析,P<0.05表示差异显著。利用MestReCv 4.9.9.6软件分析采集到的核磁图谱。
2 结果与分析
2.1 核黄素结合肽的微观形态特征

图 1 扫描电子显微镜观察核黄素(A)、肽Ac-QWFCT(B) 和核黄素结合肽(C)的微观结构(×5000)Fig. 1 Microstructures of riboflavin (A), peptide Ac-QWFCT (B) and riboflavin-binding peptide (C) observed by scanning electron microscope (× 5000)
由图1可知,核黄素分子呈现大小不均一的颗粒状分布(图1A),肽Ac-QWFCT分子在微观下呈现连续均匀的网状结构(图1B),肽-核黄素复合物呈现不规则的絮状分布(图1C)。扫描电子显微镜图像显示,肽与核黄素相互作用后,微观结构发生了明显的变化,表明生成了核黄素结合肽。
2.2 核黄素结合肽对RAW264.7细胞免疫活性的影响


图 2 核黄素、肽Ac-QWFCT和核黄素结合肽对RAW264.7细胞活力(A)、中性红吞噬率(B)和NO释放率(C)的影响Fig. 2 Effect of riboflavin, peptide Ac-QWFCT and riboflavin-binding peptide on cell viability (A), phagocytosis (B) and production of NO (C) in RAW264.7 cells
采用MTT法检测核黄素、肽Ac-QWFCT和核黄素结合肽对RAW264.7细胞是否具有细胞毒性,结果如图2A所示。在质量浓度12.5~50 μg/mL范围内,3 种样品对RAW264.7细胞均不具有细胞毒性。因此可以选择12.5、25、50 μg/mL这3 种质量浓度进行后续实验。
巨噬细胞的吞噬作用是免疫反应中的主要作用[24],吞噬率的增加是巨噬细胞活化最主要的特征之一[25]。采用中性红法测定RAW264.7细胞的吞噬作用,结果如 图2B所示。与空白对照组相比,核黄素、肽Ac-QWFCT和核黄素结合肽处理后,RAW264.7细胞的吞噬能力明显增强,但明显低于阳性对照(25 μg/mL LPS)组。核黄素结合肽处理组RAW264.7细胞吞噬能力明显高于核黄素与肽Ac-QWFCT处理组。此外,核黄素结合肽在质量浓度25 μg/mL时,细胞中性红吞噬率达到最大, 为(47.53±1.72)%。结果表明,核黄素、肽Ac-QWFCT和核黄素结合肽均可以增强RAW264.7细胞的吞噬能力,且核黄素结合肽表现出更好的活性。
NO是一种重要的信号传导介质,具有广泛的免疫学意义。NO参与一系列生理和病理代谢,影响巨噬细胞内其他细胞因子的分泌,在活化巨噬细胞的免疫保护和调节中发挥作用[26]。由图2C可知,在质量浓度为12.5 μg/mL 和25 μg/mL时,3 个处理组巨噬细胞中的NO浓度均高于空白对照组,说明核黄素、肽Ac-QWFCT和核黄素结合肽可以促进RAW264.7细胞中NO的产生;而当质量浓度为50 μg/mL时,核黄素处理组细胞中NO浓度低于空白对照组。所有样品处理组的NO浓度均低于阳性对照(25 μg/mL LPS)组。在实验所选质量浓度范围内,核黄素结合肽处理组细胞内NO浓度均显著高于核黄素和肽Ac-QWFCT组(P<0.05),且在质量浓度25 μg/mL时,NO浓度达到最大,为(40.03±0.46)μmol/L。综上所述,相比于核黄素与肽Ac-QWFCT,核黄素结合肽可以更有效地提高RAW264.7细胞的NO释放量。
2.3 核黄素结合肽的抗氧化能力分析结果

图 3 核黄素、肽Ac-QWFCT和核黄素结合肽对DPPH自由基(A) 和ABTS阳离子自由基(B)的清除能力Fig. 3 DPPH radical (A) and ABTS cation radical (B) scavenging capacity of riboflavin, peptide Ac-QWFCT and riboflavin-binding peptide
肽Ac-QWFCT是由谷氨酰胺、色氨酸、苯丙氨酸、半胱氨酸和苏氨酸组成。苯丙氨酸、组氨酸、色氨酸和酪氨酸等芳香族氨基酸具有提高多肽清除自由基的能力[15]; 半胱氨酸在还原反应中可以提供巯基基团,也具有抗氧化活性[27-28]。由图3A可知,在质量浓度0.1~1.0 mg/mL范围内,核黄素的DPPH自由基清除能力没有明显变化,而肽Ac-QWFCT、核黄素结合肽的DPPH自由基清除能力随质量浓度的增大而增强;此外,在相同质量浓度下,核黄素结合肽的DPPH自由基清除能力均显著高于核黄素与肽Ac-QWFCT(P<0.05)。由图3B可知,在质量浓度0.1~1.0 mg/mL范围内,核黄素的ABTS阳离子自由基清除能力均显著低于肽Ac-QWFCT和核黄素结合肽,且不随质量浓度的改变而发生明显变化;在质量浓度为0.1 mg/mL 和0.2 mg/mL时,核黄素结合肽的ABTS阳离子自由基清除能力显著高于肽Ac-QWFCT(P<0.05);在质量浓度0.5 mg/mL和1 mg/mL时,肽Ac-QWFCT与核黄素结合肽的ABTS阳离子自由基清除能力没有显著差异(P>0.05)。以上结果表明,肽Ac-QWFCT与核黄素的结合明显地提高了二者的DPPH自由基清除能力,而在低质量浓度下,核黄素结合肽表现出更高的ABTS阳离子自由基清除能力。
2.4 核黄素与肽Ac-QWFCT相互作用的结构分析结果
荧光发射光谱是研究小分子与生物大分子相互作用的一种重要方法[29],因此,采用荧光光谱分析核黄素与肽Ac-QWFCT相互作用后引起的肽的结构变化。图4为在激发波长280 nm、发射波长300~450 nm处肽Ac-QWFCT与核黄素相互作用的荧光光谱图。肽Ac-QWFCT在发射波长358 nm处荧光强度达到最大(51.46),而核黄素 结合肽在发射波长357 nm处荧光强度达到最大(44.15),表明核黄素的加入使肽Ac-QWFCT发生了荧光猝灭,肽Ac-QWFCT与核黄素分子之间存在相互作用。这一现象表明肽-核黄素复合物的形成,并导致芳香族荧光团的荧光猝灭。Bangaru等[30]利用荧光光谱法研究核黄素和鸡核黄素转运蛋白之间的相互作用,发现核黄素的络合可以导致蛋白发生荧光猝灭,这与本实验结果一致。
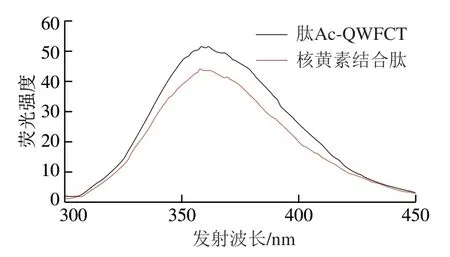
图 4 肽Ac-QWFCT与核黄素结合肽的荧光光谱图Fig. 4 Fluorescence spectra of peptide Ac-QWFCT and riboflavinbinding peptide

图 5 肽Ac-QWFCT与核黄素结合肽的傅里叶变换红外光谱图Fig. 5 FTIR spectra of peptide Ac-QWFCT and riboflavin-binding peptide
由图5可知,肽Ac-QWFCT与肽-核黄素复合物的傅里叶变换红外光谱存在明显差异。在3296 cm-1处的吸收峰归属于O-H的伸缩振动[31],核黄素的加入使该峰的位置蓝移至3352 cm-1处。在肽Ac-QWFCT傅里叶变换红外光谱中,1676 cm-1处的吸收峰归属于酰胺I带(C=O)的伸缩振动,加入核黄素后,1676 cm-1处吸收峰消失。1572 cm-1处的吸收峰归属于酰胺II带(C-N和N-H)的伸缩振动。傅里叶变换红外光谱吸收峰在酰胺I带和酰胺II带的变化可以反映肽二级结构的变化[32]。706 cm-1和636 cm-1处的吸收峰主要是苯环中C-H的振动吸收引起[33], 表明核黄素与肽Ac-QWFCT的结合使肽上芳香环所处微环境发生改变。研究表明,生物活性肽二级结构的改变与其抗氧化活性之间存在密切联系[16]。二级结构的改变可能会导致多肽链上芳香族氨基酸更多地暴露于溶剂分子中,暴露更多的活性位点从而增强了其抗氧化活性。核黄素与肽Ac-QWFCT结合引起的二级结构变化可能导致更多芳香族残基在溶液中暴露,从而导致自由基清除能力和抗氧化活性的增强。此外,二级结构的改变也可能会影响多肽的免疫调节活性。芳香族残基的暴露会对多肽的疏水性造成影响,而有报道称疏水性与免疫调节活性相关,可能会增强肽与细胞膜的相互作用,从而改善免疫调节[34]。因此,核黄素与肽Ac-QWFCT结合后,疏水氨基酸色氨酸和苯丙氨酸可能在提高核黄素结合肽的免疫调节活性中发挥重要作用。
本研究进一步采用核磁共振技术研究肽Ac-QWFCT与核黄素相互作用后化学基团的变化,结果如图6所示。在低场区域,位于苯丙氨酸芳香环上的氢核磁峰(δ7.00~7.30)在与核黄素发生相互作用后展宽,位移至δ7.20,同时伴随峰强度的增强。而在色氨酸残基上,位于紧邻吡啶环的苯环上的氢核磁峰(δ7.35~7.53)消失。这可能是由于肽-核黄素复合物的形成使肽 Ac-QWFCT上的苯环处于疏水环境中。在高场和中场区域核磁峰的变化尤为明显。在δ3.50~3.80之间峰强度增加但化学位移没有发生改变,这一区域的峰代表了肽氨基酸侧链上的亚甲基。而位于δ1.82处代表乙酰基上甲基的峰强度降低,峰发生展宽并从δ1.80向低场位移至δ1.88处。此外,在δ0.90~1.15之间,代表苏氨酸残基上甲基的峰合并为一个峰,并发生明显地展宽和强度的增加。这些结果表明,肽Ac-QWFCT上的芳香族氨基酸残基可能通过疏水相互作用与核黄素发生络合。在晶体结构中,核黄素的异氧嘧啶部分与肽Ac-QWFCT中色氨酸、苯丙氨酸残基具有疏水性。在核黄素与肽Ac-QWFCT相互作用时,核黄素的异氧嘧啶部分堆积在色氨酸 和苯丙氨酸残基侧链的平行芳香环之间,通过疏水相互作用与肽结合。荧光光谱中肽Ac-QWFCT的荧光猝灭也可能是异氧嗪环和芳香族残基的堆积所致。

图 6 肽Ac-QWFCT的结构式及核黄素、肽Ac-QWFCT和核黄素结合肽的核磁共振氢谱Fig. 6 Structural formula of peptide Ac-QWFCT and 1H-NMR spectra of riboflavin, peptide Ac-QWFCT, and riboflavin-binding peptide

图 7 肽Ac-QWFCT(A)、肽Ac-QWFCT-核黄素(B)的同核化学位移相关谱Fig. 7 1H-1H COSY spectra of peptide Ac-QWFCT(A) and riboflavin-binding peptide (B)
为进一步研究核黄素与肽Ac-QWFCT的反应机制,本研究测定肽Ac-QWFCT、核黄素及其复合物的同核
化学位移相关谱。由图7可知,与肽Ac-QWFCT相比,肽-核黄素复合物的同核化学位移相关谱中出现了4 处关联信号的变化,表明苯环的关联信号发生展宽,此结果揭示核黄素并没有引起肽中氨基酸侧链上苯环发生结构变化,而是使苯环周围的微环境发生变化。这也说明核黄素通过疏水相互作用与肽Ac-QWFCT发生结合。此外,代表亚甲基((4.36,2.72)、(4.39,2.72)、(4.48,2.72)和(4.52,3.02))和甲基(4.20,1.04)的相关峰消失,这可能是由于核黄素与肽Ac-QWFCT结合后使芳香环发生堆积,从而使肽分子内形成了氢键。由以上结果推测,核黄素是与肽Ac-QWFCT上带有芳香环的色氨酸残基和苯丙氨酸残基相互作用。
2.5 翻转肠囊法分析核黄素结合肽在大鼠小肠内的吸收行为

图 8 核黄素与核黄素结合肽在大鼠翻转肠囊中的核黄素吸收量Fig. 8 Absorption of riboflavin and riboflavin-binding peptide in the rat everted gut sac
外翻肠囊技术被广泛用于预测人体药物吸收[35]。通过外翻肠囊后,测定浆膜侧核黄素浓度,由图8可知,单独的核黄素的吸收浓度为(0.07±0.01)μmol/mL,而核黄素结合肽的核黄素的吸收浓度为(0.12±0.01)μmol/mL, 差异显著(P<0.05)。结果表明,核黄素与肽 Ac-QWFCT的结合能够促进小肠对核黄素的吸收。然而,小肠对核黄素结合肽的吸收机制需要进一步研究。
3 结 论
本实验以松子肽Ac-QWFCT和核黄素为原料,制备核黄素结合肽,并对其微观结构、生物活性、结构特征以及吸收特性进行研究。结果表明,与核黄素结合后,肽Ac-QWFCT的微观结构由网状变为絮状。在相同质量浓度下,核黄素结合肽的免疫活性明显高于肽 Ac-QWFCT和核黄素;而在低质量浓度下,核黄素结合肽的抗氧化活性明显高于肽Ac-QWFCT和核黄素。与核黄素的结合会引起肽Ac-QWFCT发生荧光猝灭。肽 Ac-QWFCT上的色氨酸和苯丙氨酸残基通过疏水相互作用与核黄素进行结合。除此之外,相比于核黄素,核黄素结合肽可以促进核黄素在大鼠肠道内的吸收。本研究结果可为新型VB2补充剂的开发提供理论参考。
