空气放电处理诱导尖孢镰刀菌孢子的凋亡过程
2021-06-03刘梦蝶姜慧雯严守雷王清章
刘梦蝶,姜慧雯,李 洁,2,3,*,严守雷,2,3,王清章,2,3
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.华中农业大学 环境食品学教育部重点实验室,湖北 武汉 430070; 3.湖北省水生蔬菜保鲜加工工程技术研究中心,湖北 武汉 430070)
莲藕(Nelumbo nuciferaGaertn.)是我国重要的水生经济作物,深受国内外众多消费者青睐。莲藕在长期贮藏以及运输中容易发生腐烂,腐烂是仅次于褐变的影响莲藕品质的重要因素之一。实验室前期研究发现,尖孢镰刀菌(Fusarium oxysporum)是莲藕采后的主要腐败菌[1]。
空气放电技术是将风机送入的空气在高压静电处理下,通过一系列复杂的电离和结合过程,产生放电生成气的过程,主要生成臭氧(ozone,O3)和负离子(包括O2-、O3-、H2O-等)。用一定浓度的放电生成气对果品的贮藏环境进行处理,能够抑制果实呼吸强度和微生物生长,有助于果蔬的保藏[2]。
凋亡是由高度进化后基因调控的一种细胞程序性死亡过程,普遍存在于动物、植物以及微生物中,对维持细胞稳态,衰老和分化等过程具有重要作用[3-6]。丝状真菌在生长的各个阶段经常会有凋亡现象出现,如异核体不亲和和菌丝自溶,另外多种胁迫因子如紫外线、渗透压、抗真菌药物等均能诱导细胞凋亡[6]。很多学者以酵母凋亡通路为例,研究外界刺激下丝状真菌凋亡特征事件发生的次序及关联,结果发现,番茄红素可以诱导尖孢镰刀菌菌丝凋亡,凋亡细胞具有DNA断裂、线粒体膜去极化和活性氧簇(reactive oxygen species,ROS)累积等特征[7]。实验室前期研究表明空气放电处理能显著抑制尖孢镰刀菌菌丝生长和孢子萌发,对尖孢镰刀菌细胞活力及其超微结构、生理代谢和细胞膜等方面产生影响,达到抑菌作用[2,8-9]。本研究将从空气放电处理诱导尖孢镰刀菌孢子凋亡过程中的各种现象及可能存在的凋亡机制方面出发,进一步完善空气放电处理抑菌机理,为空气放电技术对果品腐败的抑制提供理论参考。
1 材料与方法
1.1 菌株、材料与试剂
尖孢镰刀菌为莲藕贮藏期病原菌,经本实验室分离、纯化、鉴定后保存备用。
马铃薯葡萄糖(potato dextrose agar,PDA)培养基 北京陆桥技术有限责任公司;马铃薯葡萄糖水培养基 国药集团化学试剂有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒、DCFH-DA ROS检测试剂盒、Fluo-3 AM荧光探针 上海碧云天生物技术有限 公司;Rho123线粒体膜电位检测试剂盒 上海贝博生物科技有限公司;Rhod-2 AM Ca2+荧光线粒体探针 美国AAT Bioquest公司;CaspACE FITC-VAD-FMK染液 美国 Promega公司。
1.2 仪器与设备
MIC-O3臭氧变送器 深圳市蓝月测控技术有限 公司;QT2SVP500一体化臭氧发生器 深圳市松野电器有限公司;TFB-YA278负离子发生器 天长市创普电子有限公司;Guava easyCyte 8流式细胞仪 美国Merck Millipore公司;FACSVerse流式细胞仪 美国Becton Dicknson公司;F-4600荧光分光光度计 日本HITACHI公司;ECLIPSE Ti-S倒置荧光显微镜 日本Nikon 公司。
1.3 方法
1.3.1 尖孢镰刀菌的空气放电处理
F. oxysporum接种于PDA平板上,于26 ℃培养箱中培养6 d。密闭空气放电设备内臭氧和负离子生成气达到设定浓度后将平板分别放入臭氧(6.87 mg/m3)、负离子(5×106ions/cm3)、臭氧+负离子同时处理 (6.87 mg/m3+5×106ions/cm3)环境中,分别处理1、2、3、4、5 h,以不做任何处理为对照,向每个平板中加入1.5 mL无菌水,将其产生的分生孢子用无菌水润洗至试管,然后离心(4 ℃、1000 ×g、5 min)收集孢子。
1.3.2 尖孢镰刀菌孢子的凋亡双染
用0.1 mol/L pH 7.0磷酸盐缓冲液(phosphate buffered saline,PBS)重悬1.3.1节得到的孢子并计数,取10 μL孢子悬液用190 μL Annexin V-FITC结合液轻轻重悬洗涤,使孢子密度约1×106个/mL,加入用PBS稀释10 倍后的Annexin V-FITC染色液5 μL,1 μL碘化丙啶(propidium iodide,PI)染色液轻轻混匀,避光孵育20 min,采用FACSVerse流式细胞仪进行检测。
1.3.3 尖孢镰刀菌孢子ROS含量测定
按照1∶1000体积比用PBS稀释荧光探针DCFH-DA至浓度为10 μmol/mL。取洗涤后的孢子,重悬于稀释好的500 μL DCFH-DA中,孢子密度约1×106个/mL,室温避光孵育1 h。PBS洗涤后,用Guava easyCyte 8流式细胞仪进行检测,荧光强度与细胞内ROS水平成正比,故以荧光强度表征孢子ROS含量。
1.3.4 尖孢镰刀菌孢子膜电位的测定
按照Rho123线粒体膜电位检测试剂盒说明书配制染色缓冲液及Rho123染色工作液(质量浓度50 μg/mL)。用500 μL Rho123染色工作液将孢子重悬,孢子密度约1×106个/mL,室温避光孵育30 min,洗涤离心(4 ℃、3000×g、5 min)收集孢子,用500 μL染色缓冲液将孢子重悬,用Guava easyCyte 8流式细胞仪进行检测,以荧光强度表征膜电位,荧光强度越大,膜电位越高。
1.3.5 尖孢镰刀菌孢子胞浆Ca2+浓度的测定
Fluo-3 AM是一种可以穿透细胞膜的荧光染料。Fluo-3 AM 的荧光非常弱,其荧光不会随Ca2+浓度升高而增强。Fluo-3 AM 进入细胞后可以被细胞内的酯酶剪切形成Fluo-3, 从而被滞留在细胞内。Fluo-3可以和Ca2+结合,且结合后可以产生较强的荧光。
按照1∶10000体积比用PBS稀释荧光探针Fluo-3 AM, 使终浓度为0.5 μmol/L。取30 μL收集的孢子悬液,重悬于稀释好的200 μL Fluo-3 AM溶液中,孢子密度约2.5×106个/mL,室温避光孵育50 min进行荧光探针装载,PBS洗涤两次(4 ℃、3000×g、5 min),再孵育20 min后用Guava easyCyte 8流式细胞仪检测[10],以荧光强度表征Ca2+浓度,荧光强度越大,胞浆Ca2+浓度越高。
1.3.6 尖孢镰刀菌孢子线粒体Ca2+浓度的测定
Rhod-2 AM Ca2+荧光线粒体探针是一种Rhod-2的乙酰甲酯衍生物,进入细胞后被内酯酶剪切生成不具膜渗透性的Rhod-2,负载到细胞内。Rhod-2是一种可见光激发的高亲和力Ca2+指示剂,能有效地将钙荧光信号增加几十倍。Rhod-2具有很强的染料吸收性能,使得更低浓度的探针即可成功检测Ca2+浓度变化,从而降低了对活细胞的光毒性;由于产生的荧光强度具有很强的Ca2+依赖性,对Ca2+浓度检测的敏感度也更高,故以荧光强度表征Ca2+浓度。
利用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解Rhod-2 AM配制成质量浓度2 mg/mL的储存液,分装后于-20 ℃避光干燥密封保存,在使用前回温至室温,用PBS稀释到质量浓度5 μg/mL。用稀释好的300 μL Rhod-2 AM染色液重悬收集的孢子,使孢子浓度约为1×107个/mL。 室温避光孵育40 min,PBS洗涤细胞两次(4 ℃、3000×g、5 min),加入PBS缓冲液1.5 mL再室温避光孵育30 min后用荧光分光光度计检测。激发波长550 nm、发射波长580 nm[11]。
1.3.7 尖孢镰刀菌孢子半胱天冬氨酸酶(metacaspase)激活的检测
收集臭氧(6.87 mg/m3)、负离子(5×106ions/cm3)、 臭氧+负离子同时处理(6.87 mg/m3+5×106ions/cm3) 条件下处理5 h的分生孢子,悬浮在用PBS稀释的CaspACE FITC-VAD-FMK (10 μmol/L)染液中,室温避光孵育2 h,PBS洗涤一次(4 ℃、3000×g、5 min)后重悬,取适量在荧光显微镜下观察染色情况[12]。
1.4 数据处理与分析
所得数据用Data Processing System 7.05软件中的t检验进行显著性分析,采用Origin 8.0软件进行数据处理和图表制作,流式细胞仪图像由Flowjo 7.6软件进行分析。
2 结果与分析
2.1 空气放电处理诱导尖孢镰刀菌孢子凋亡
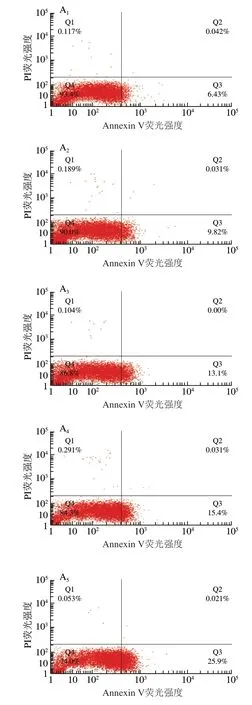
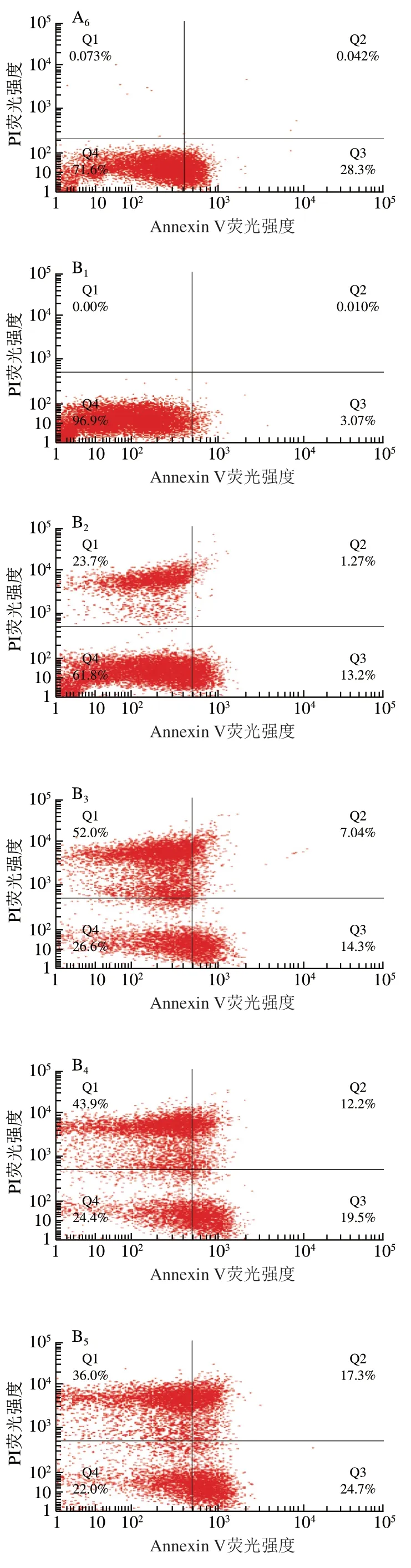
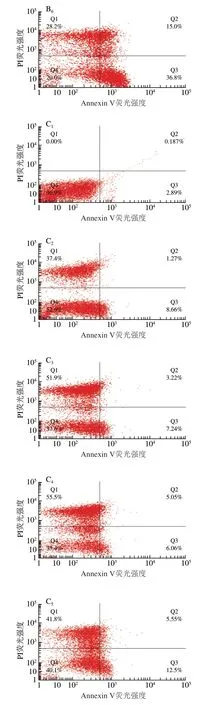

图 1 空气放电处理尖孢镰刀菌孢子FITC/PI双染凋亡分析Fig. 1 Annexin V-FITC/PI double-staining analysis of apoptosis in F. oxysporum spores after air discharge treatment
如图1所示,随着处理时间的延长,负离子处理组早期孢子凋亡数(Q3)增多,处理5 h时,早期孢子凋亡比率从6.43%增加至28.3%,而晚期孢子凋亡数(Q2)和坏死数(Q1)基本无变化。臭氧处理组和臭氧+负离子同时处理组早/晚期孢子凋亡数和坏死数都明显增加,且在每个处理时间点臭氧+负离子同时处理组孢子坏死数都明显占优势。
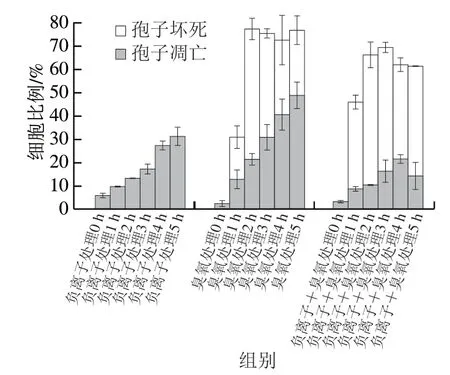
图 2 空气放电处理尖孢镰刀菌孢子的凋亡率和坏死率Fig. 2 Apoptosis and necrosis rates of F. oxysporum spores after exposure to air discharge
如图2所示,负离子处理组和臭氧处理组孢子凋亡率随着处理时间的延长呈现递增趋势,臭氧处理组和臭氧+负离子同时处理组孢子坏死率均在处理2 h时达到最大。臭氧+负离子同时处理1 h时,尖孢镰刀菌孢子已表现出明显坏死,坏死率明显高于臭氧单独处理。说明空气放电处理对尖孢镰刀菌孢子存在诱导凋亡和坏死双重作用。
2.2 空气放电处理对尖孢镰刀菌孢子ROS含量的影响
如图3所示,空气放电处理后,尖孢镰刀菌孢子ROS含量增加,在处理过程中,臭氧处理组和臭氧+负离子同时处理组ROS含量均显著高于负离子处理组 (P<0.05)。臭氧处理组和臭氧+负离子同时处理组在处理2 h内ROS明显上升,随后上升趋势减缓。而负离子单独处理组在前3 h内ROS含量无明显变化,处理4 h后ROS含量明显升高。
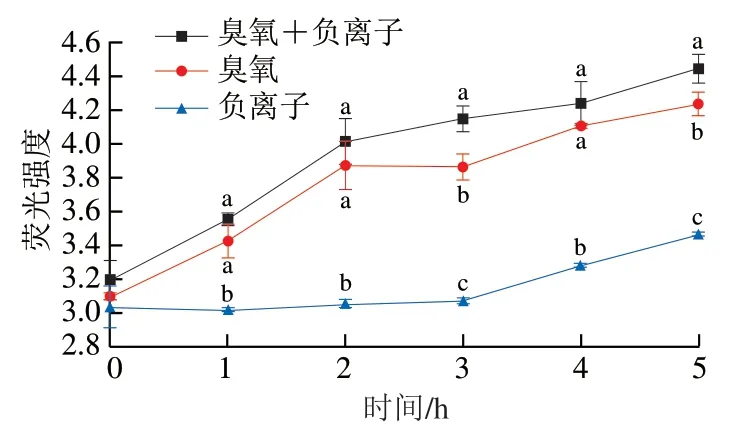
图 3 空气放电处理对尖孢镰刀菌孢子ROS积累的影响Fig. 3 ROS accumulation in F. oxysporum spores after exposure to air discharge
2.3 空气放电处理对尖孢镰刀菌孢子线粒体膜电位的影响

图 4 空气放电处理对尖孢镰刀菌孢子线粒体膜电位的影响Fig. 4 Detection of Δψm in F. oxysporum spores after exposure to air discharge
如图4所示,随着空气放电处理时间的延长,孢子内线粒体膜电位逐渐下降。臭氧处理组和臭氧+负离子同时处理组在处理2 h内下降趋势明显,负离子处理组在处理1 h内下降趋势明显,在处理2 h后臭氧处理组和 臭氧+负离子同时处理组线粒体膜电位明显低于负离子处理组(P<0.05)。
2.4 空气放电处理对尖孢镰刀菌孢子胞浆Ca2+浓度的影响


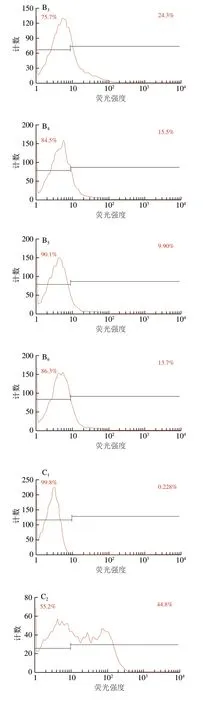

图 5 空气放电处理尖孢镰刀菌Fluo-3 AM染色细胞分布直方图Fig. 5 Fluo-3 AM stained cell distribution of F. oxysporum spores after exposure to air discharge
从染色细胞分布直方图(图5)中可以看出,随着处理时间的延长,相较于臭氧处理组和臭氧+负离子同时处理组,负离子处理组染色细胞数变化不明显。臭氧处理组和臭氧+负离子同时处理组染色细胞比率均在处理1 h达到最大值,分别为34.5%和44.8%。

图 6 空气放电处理对尖孢镰刀菌孢子胞浆Ca2+浓度的影响Fig. 6 Cytosolic Ca2+ levels in F. oxysporum spores after exposure to air discharge
如图6所示,随着处理时间的延长,相较于负离子处理组尖孢镰刀菌孢子胞浆Ca2+浓度缓慢上升,臭氧处理组和臭氧+负离子同时处理组Ca2+浓度在处理1 h时达到峰值,在处理2 h后有所下降,维持相对稳定的水平。不同处理组在各处理时间都有显著性差异(P<0.05),其中臭氧+负离子同时处理胞浆Ca2+浓度最高,其次是臭氧处理,负离子处理最低。
2.5 空气放电处理对尖孢镰刀菌孢子线粒体Ca2+浓度的影响
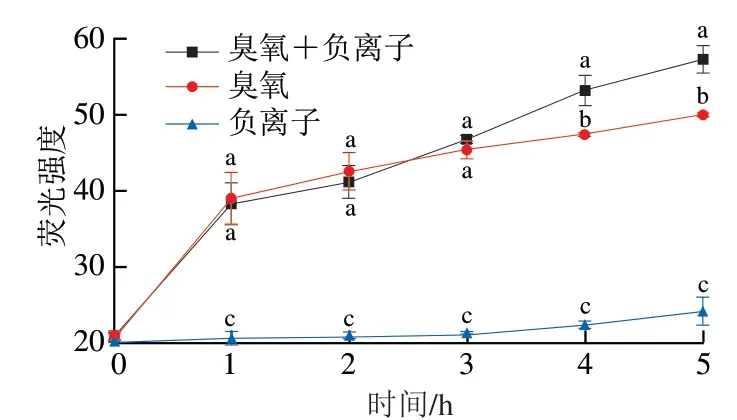
图 7 空气放电处理对尖孢镰刀菌孢子线粒体Ca2+浓度的影响Fig. 7 Mitochondrial Ca2+ levels in F. oxysporum spores after exposure to air discharge
如图7所示,随着处理时间的延长,负离子处理组尖孢镰刀菌孢子线粒体Ca2+浓度缓慢上升,而臭氧处理组和臭氧+负离子同时处理组Ca2+浓度在处理1 h时已大幅度升高,之后减幅稳定上升。臭氧处理组和臭氧+负离子同时处理组与负离子处理组在各处理时间都有显著性差异(P<0.05),处理4 h后臭氧+负离子同时处理组与臭氧处理组有显著性差异(P<0.05)。
在处理1 h时,臭氧处理组和臭氧+负离子同时处理组胞浆(图6)及线粒体Ca2+浓度(图7)均显著升高 (P<0.05),而处理时间延长时,孢子内胞浆Ca2+浓度下降,线粒体Ca2+浓度继续上升,可以推断存在胞浆 Ca2+内流入线粒体。
2.6 空气放电处理对尖孢镰刀菌孢子内Metacaspase 活力的影响
Metacaspase是一类存在于真菌、植物及原生生物中的半胱氨酸依赖蛋白酶,与动物细胞中胱天蛋白酶(caspase)家族具有直接同源性,通过细胞内ROS的积累和线粒体功能的损伤对细胞凋亡起着关键作用[6,13-15]。 Z-VAD-FMK是一种广泛的Caspase抑制剂,可以使用FITC-VAD-FMK(Z-VAD-FMK的FITC缀合物)检测Metacaspase活力,该FITC缀合物被递送到细胞中,与凋亡细胞中活化的Caspase特异性结合,产生荧光[16-18]。
如图8所示,3 种处理组中部分细胞显示出明显的绿色荧光,而对照组未观察到荧光,其中臭氧处理组和臭氧+负离子同时处理组染色细胞数及荧光强度明显高于负离子处理组。表明空气放电处理后,尖孢镰刀菌孢子内Metacaspase活力明显增强。
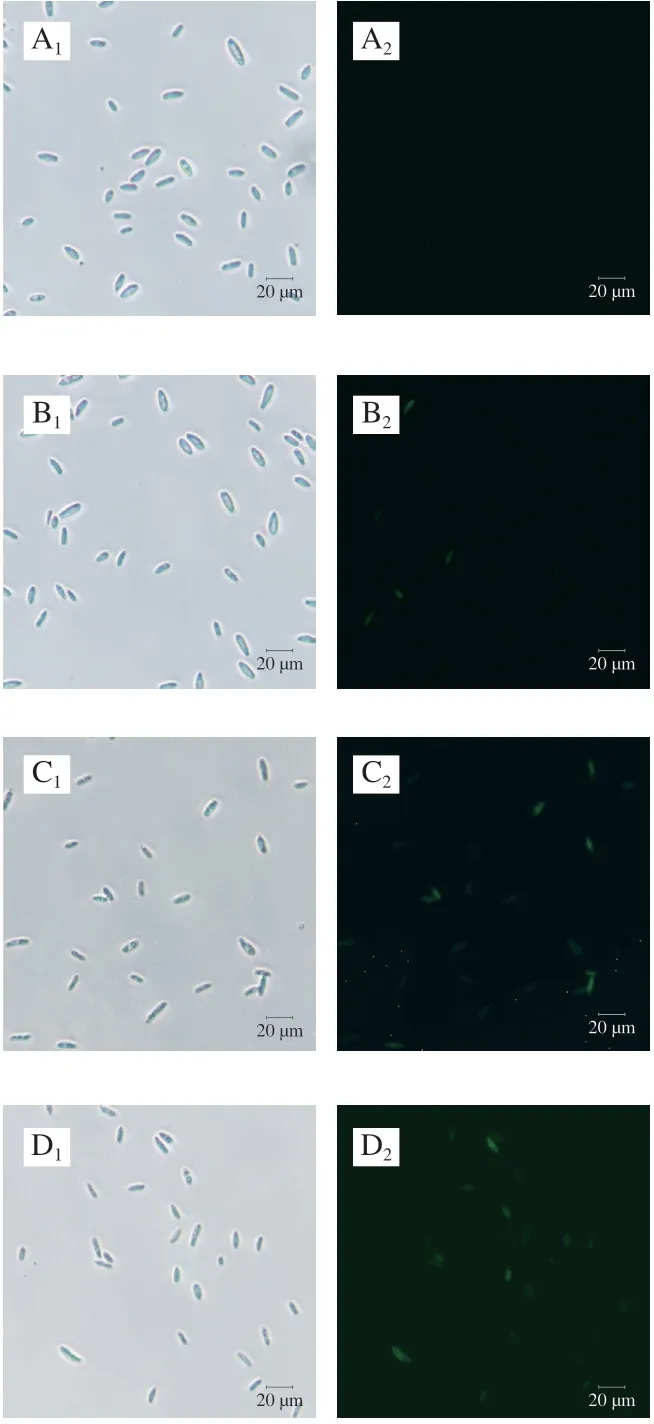
图 8 空气放电处理对尖孢镰刀菌孢子内Metacaspase活力的影响Fig. 8 Effect of air discharge on the activity of metacaspase in F. oxysporum spores
3 讨 论
诱导细胞凋亡的两个关键分子信号为ROS和Ca2+[19-20]。 细胞Ca2+超载或胞内Ca2+区域化分布的扰动会对细胞产生毒性并能引发细胞凋亡或细胞坏死[21]。有研究发现,胞浆内增多的Ca2+可促使ROS过量产生而引起膜脂质过氧化,破坏细胞膜及线粒体的结构与功能,激活内源性核酸酶等多种酶,引起核DNA降解而诱导凋亡 发生[22-23]。本实验中空气放电处理后胞浆和线粒体内 Ca2+浓度均迅速上升,因此,推测Ca2+超载是空气放电诱导尖孢镰刀菌孢子凋亡的原因之一。这与沈青山[24]的 研究发现麝香草酚是通过激活电压门控钾离子通道导致K+外流,最终导致黄曲霉孢子细胞凋亡不同。线粒体作为细胞能量代谢的中心,对细胞凋亡起到了关键作用[25],是ROS产生的主要来源[26]。ROS在凋亡过程作为非常重要的信号和效应器,其积累可导致孢子内的蛋白质、脂质损伤,从而激活细胞内信号传导级联,诱导凋亡 发生[27-28]。侯颖等[29]研究了不同致死浓度ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)对酿酒酵母细胞凋亡的影响机制,结果表明ε-PL能够诱导酿酒酵母细胞ROS迸发,使细胞进入凋亡早期阶段。Savi等[30]在研究臭氧气体破坏禾谷镰刀菌(F. graminearum)和轮枝镰孢菌 (F. verticillioides)菌丝形态造成细胞死亡的原因之一是细胞内ROS的异常产生积累,推断存在细胞凋亡。ROS诱导的细胞损伤已被证明是念珠菌属真菌常见的抗真菌机制,也有少量研究集中在一些丝状真菌如曲霉菌[31]、丝核菌[32]和镰刀菌[33]中。
在多种刺激诱导的细胞凋亡期间,线粒体膜电位的崩解是线粒体介导的细胞凋亡的重要事件,被认为是细胞内ROS水平升高的结果[34];刘晶[35]以H2O2作为氧化损伤刺激物,研究从3 种乳酸杆菌中分离的S-层蛋白对HT-29细胞的线粒体凋亡通路的影响,发现氧化应激诱导的ROS过度触发引起线粒体膜电位的下降,并且3 种菌株的S-层蛋白能显著地降低HT-29细胞的线粒体膜电位。这种破坏造成线粒体膜孔的打开,导致凋亡因子和细胞色素c(cytochrome c,Cyt c)从线粒体释放到胞质[36-37]。Cyt c是位于线粒体膜间隙的一种血红素蛋白质,不仅在线粒体呼吸链中起重要作用,在复合酶III和复合酶IV之间传递电子,也作为一种多功能蛋白酶参与细胞的生长和凋亡[38]。细胞凋亡进程中下游Caspase的激活必须经由Cyt c与Caspase的结合[39]。Metacaspase是Caspase的同系物,被认定是存在于真菌、植物和原生生物凋亡过程中的引发物[18]。在真菌中,细胞凋亡途径有Metacaspase独立型和依赖型两种[40],本实验表明空气放电诱导尖孢镰刀菌凋亡过程中会引起Metacaspase的激活,属于Metacaspase依赖型;而毛霉素VI诱导尖孢镰刀菌凋亡过程中,Metacaspase未激活[41],属于Metacaspase独立型。
综上研究结果表明,空气放电诱导尖孢镰刀菌孢子的凋亡过程是以线粒体为核心的凋亡机制,即空气放电首先引起胞内Ca2+浓度的增加和ROS的积累,线粒体膜电位的去极化由线粒体ROS的产生引起,导致Cyt c从线粒体释放到细胞质,激活Metacaspase,最终导致孢子凋亡。
