丙烯醛-丙氨酸加合物制备与细胞毒性
2021-06-03邹照佳黄才欢欧仕益
邹照佳,郑 洁,黄才欢,刘 付,欧仕益*
(暨南大学理工学院,广东 广州 510632)
丙烯醛是α、β-不饱和醛中最简单且活性最高的小分子醛,广泛存在于热加工食品(如咖啡、酒、油炸土豆等)和环境(因工业排放、有机物不完全燃烧等原因产生)中[1-4]。同时,丙烯醛也是一种内源性代谢产物,髓过氧化物酶介导的苏氨酸降解、胺氧化酶介导的精胺和亚精胺降解均会生成丙烯醛[5];抗癌药物环磷酰胺在体内通过细胞色素P450酶将其转化生成丙烯醛[6];细胞膜内自由基引发的多不饱和脂肪酸过氧化中也会生成丙烯醛[7-10]。
丙烯醛属于高毒性物质,对小鼠和大鼠的半数致死量分别为30、50 mg/kg[11],且人经口摄入的最小致死量为5 mg/kg[12]。通常情况下,丙烯醛的毒性表现为通过亲核反应修饰DNA和蛋白质,降低分子内的谷胱甘肽(glutataione,GSH)水平[13-16]。丙烯醛的高亲电性致使其极易与生物体内的亲核大分子发生反应,进而引发各种疾病,如阿尔茨海默症(Alzheimer’s disease,AD)[17]、 糖尿病[18]、帕金森症[19]和动脉粥样硬化[20-25]。陈佳红等[26]证明丙烯醛可通过消耗细胞内GSH含量以及氧化应激引起细胞凋亡和坏死,对PC12细胞表现出急性毒性,为丙烯醛对AD的发病机制研究提供了依据。Lovell等[27]报道,在AD患者的大脑中检测到的丙烯醛浓度与正常大脑表现出显著差异,并且AD患者大脑杏仁核和海马体中丙烯醛浓度约为正常人的8 倍。Liu Jinhui等[28]认为,丙烯醛诱发神经元受损的缺血性中风的机理是它消耗中风患者体内GSH,以及通过激活亚精胺/亚精胺-N1-乙酰基转移酶参与了中风诱发的神经毒性。Rom等[21]发现,丙烯醛处理后,小鼠主动脉粥样硬化的几种标志物含量显著增加,确认了丙烯醛与心血管疾病的关系。
为了减轻热加工食品中产生的有毒化合物对生物体造成的危害,人们一直致力于研究能够降低这些有毒化合物毒性的物质。Tao Zhihao等[29]发现并阐明了阿魏酸消除丙烯醛毒性的机理:在天然酚酸中,阿魏酸具有优异且独特的清除丙烯醛作用,它通过脱羧后与丙烯醛发生迈克尔加成反应,有效抑制丙烯醛对细胞抗氧化系统的破坏。本课题组前期研究表明,蛋白质和氨基酸在丙烯醛清除过程中发挥着十分重要的作用:Jiang Kaiyu等[30]模拟几种蛋白在胃肠肠道中消化过程对丙烯醛的清除作用,发现蛋白质的摄入可以明显降低几种羰基化合物(如丙烯醛等)对结肠癌Caco-2细胞的毒性,其降毒作用归因于消化过程中释放的氨基酸,其中半胱氨酸呈现最大的解毒作用; Yin Zhao等[31]在研究中合成分离出了丙烯醛-半胱氨酸加合物,并就其对人支气管上皮细胞HBE和Caco-2细胞毒性进行了检测,丙烯醛与双半胱氨酸加合物可通过减轻活性氧和细胞凋亡干预,大大降低了丙烯醛诱导的细胞毒性,而单半胱氨酸-丙烯醛加合物仍具有较高毒性。
半胱氨酸属于含硫氨基酸,其巯基极易与丙烯醛发生迈克尔加成反应[30,32],但氨基酸中氨基的反应活性及其与丙氨酸形成的加合物鲜见研究。丙氨酸是仅次于甘氨酸的最简单氨基酸,在马铃薯和面粉中的含量显著高于甘氨酸[33]。本研究选择丙氨酸作为丙烯醛的清除剂,通过阐释其加合物的结构及其反应机理,以期为控制食品中的丙烯醛毒性提供一种新策略。
1 材料与方法
1.1 材料与试剂
人正常胃上皮黏膜细胞株(GES-1)由上海酶研生物有限公司提供。
丙烯醛(分析纯) 成都艾科达化学试剂有限公司;L-丙氨酸(L-Ala)(纯度99%) 北京百灵威科技有限公司;甲醇(色谱纯) 美国Mallinckrodt Baker公司; 氘代水 美国Cambridge Isotope Laboratories公司;A-HG型十八烷基键合硅胶 日本东京YMC有限公司。
1.2 仪器与设备
SHA-BA恒温振荡器 江苏省金坛市医疗仪器厂; 精密电子天平 广州市艾安得仪器有限公司;LC-20AT型高效液相色谱(high performance liquid chromatography,HPLC)分析系统(配有SPD-M20A光电二极管阵列检测器)、LC-MS8045三重四极杆液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)联用仪(配有电喷雾离子源) 日本岛津仪器公司; ZORBAX SB-Aq色谱柱(250 mm×4.6 mm,5 μm) 美国Agilent公司;N-1300型旋转蒸发仪 日本东京理化器械株式会社;Scientz-10N型真空冷冻干燥机 宁波新芝生物科技有限公司;X500R QTOF型高分辨质谱仪 美国SCIEX公司;600 MHz Avance III型核磁共振(nuclear magnetic resonance,NMR)仪 瑞士布鲁克公司;MB-580型酶标仪 深圳汇松科技有限公司。
1.3 方法
1.3.1 丙氨酸对丙烯醛清除率检测
对照组:于100 mL具塞锥形瓶中加入20 mL去离子水,再加入1 mmol丙烯醛后封口膜封紧瓶口;实验组:100 mL具塞锥形瓶中加入20 mL去离子水,依次加入1 mmol丙氨酸和丙烯醛后封口膜封紧瓶口。在50 ℃水浴温度下分别反应90、120 min后,参照文献[34]检测反应体系中剩余丙烯醛质量浓度。
1.3.2 加合物的制备及条件优化
反应在100 mL的具塞锥形瓶中进行,溶液体积20 mL。设置不同反应物浓度比(c(丙烯醛)∶c(丙氨酸))为2∶1、1∶1、1∶2、1∶3、1∶4,加盖并用封口膜封口后,于恒水浴振荡器中反应0.5、3、5、6 h,温度分别为 37、50 ℃。反应结束后冷却至室温,用0.45 μm微孔滤膜过滤,用HPLC测定生成加合物含量,选择出目标加合物含量高且易分离的反应条件。
1.3.3 HPLC法检测加合物含量的分析条件
流动相为体积分数5%甲醇-水溶液;流速0.6 mL/min; ZORBAX SB-Aq色谱柱(250 mm×4.6 mm,5 μm);柱温40 ℃;进样量为10 μL;加合物的检测波长220 nm。在此条件下进行检测,根据目标加合物峰面积确定加合物含量。
1.3.4 目标加合物的分离纯化
在优化后的反应条件下合成样品:丙烯醛与丙氨酸浓度比为1∶2,50 ℃水浴中反应5 h。反应后,收集反应液,用旋转蒸发仪减压旋蒸除去大部分溶剂水,浓缩得到待分离的反应液1~2 mL。
将浓缩后的反应液经过0.22 μm微孔滤膜过滤后,加到平衡好的反相硅胶层析柱(30 mm×500 mm)上端,进行柱层析分离。反相硅胶填料体积为250 mL,平衡条件:依次用70%、50%、30%(体积分数,下同)甲醇溶液冲洗1 倍柱体积,再用洗脱剂25%甲醇溶液平衡3 倍柱体积。分离纯化条件:流速1 mL/min;洗脱剂为5%甲醇溶液,用量为0.3 L,等度洗脱150 mL后开始收集样品,馏分体积为5 mL。各馏分液用0.45 μm微孔滤膜过滤后,HPLC法测定目标加合物的纯度。合并高纯度馏分并冷冻干燥48 h,获得目标加合物固体。
1.3.5 目标加合物的结构鉴定
将10 mg 1.3.4节所得目标加合物固体溶于纯水中,用紫外全波长扫描、高分辨质谱(离子源为电喷雾离子源,扫描范围为m/z50~1500)分析获得目标加合物相对分子质量,LC-MS联用获得一级、二级质谱图;取35 mg目标产物纯物质溶于550 μL氘代水中,经核磁氢谱(1H NMR)、核磁碳谱(13C NMR)、核磁Dept-135谱(Dept-135 NMR)分析,鉴定其结构。
LC-MS条件:ZORBAX SB-Aq色谱柱(250 mm×4.6 mm,5 μm);流动相为5%甲醇-水溶液,流速:0.3 mL/min,进样量为1 μL;柱温40 ℃,检测波长220 nm;以正离子模式运行,离子源为电喷雾离子源,扫描范围为m/z50~800;离子源温度为300 ℃,去溶剂化温度为250 ℃;毛细管电压为4000 V,扫描速率为1000 Da/s,电离能15 eV。
NMR条件:用550 μL D2O溶液溶解35 mg目标加合物纯品,并用Avance III光谱仪(600 MHz)分析,获得1H NMR、13C NMR。
1.3.6 细胞毒性实验
采用噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)[35]法分别检测丙烯醛及加合物对人正常胃细胞(GES-1)毒性。GES-1细胞采用含有10%胎牛血清的RPMI-1640培养基培养,当细胞生长至汇合率为70%~80%时,采用0.25%的胰酶消化成单细胞悬液,显微镜下观察计数后,向96 孔细胞培养板(除外周36 孔)中加入100 μL 1×105个/mL的单细胞悬液。采用不同浓度的加合物和丙烯醛(0、0.02、0.04、0.06、0.08、0.1、0.2、1、2 mmol/L)孵育细胞,在37 ℃培养箱中分别培养24 h和48 h后,用0.0067 mol/L pH 7.4磷酸盐缓冲溶液(phosphate buffered saline,PBS)冲洗掉药物,再用200 μL含有质量浓度5 mg/mL MTT溶液的培养基替代药物,37 ℃下继续培养4 h后终止培养,移除培养液,每孔加入150 μL二甲基亚砜溶液,置摇床上低速振荡10 min,使用酶标仪于570 nm波长处检测吸光度,按下式计算细胞存活率。每个浓度处理重复3 次,细胞存活率均以平均值± 标准偏差表示。
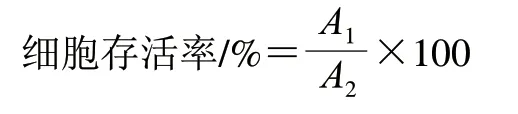
式中:A1为药物组的吸光度;A2为对照组的吸光度。
1.4 数据处理与分析
实验数据采用Microsoft Excel软件处理,结果以平均值±标准差表示。应用SPSS 22.0软件进行方差分析和半抑制浓度(half maximal inhibitory concentration,IC50)计算,并在P<0.05水平下进行Duncan显著性差异分析。NMR图谱经Mestrenova软件进行处理分析。
2 结果与分析
2.1 丙烯醛清除率
实验中丙烯醛标准曲线方程为y=0.0258x-0.0855,R2=0.9887(其中x代表丙烯醛质量浓度,y代表吸光度)。根据该标准曲线,获得对照组和实验组的丙烯醛清除率如表1所示,相比于对照组,实验组在90 min后的丙烯醛消除率即接近80%,说明丙氨酸对丙烯醛有较高的清除能力。
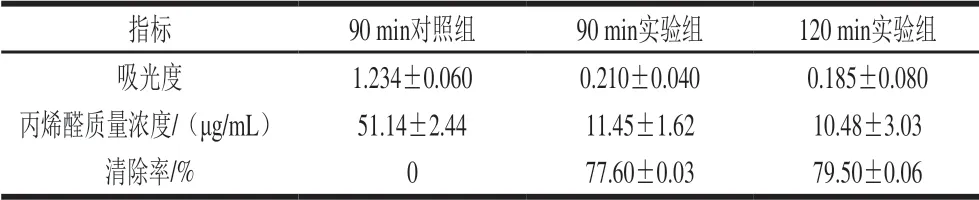
表 1 丙氨酸对丙烯醛清除率Table 1 Elimination of acrolein by alanine
2.2 加合物的分离纯化
采用不同浓度比的丙烯醛与丙氨酸反应,发现产物中除丙氨酸外,还出现一个峰面积较大的新产物 (图1A)。其中,丙烯醛与丙氨酸浓度比为1∶2,在50 ℃反应5 h后,新产物的峰面积最大,因此以此为最佳反应条件制备加合物。
经反相硅胶层析柱细分离后的目标加合物用HPLC法检测,色谱结果如图1B所示。纯化后目标加合物的保留时间为5.926 min(图1B),经紫外全波长扫描,目标产物的最大吸收波长是220 nm(图1C)。根据 图1B峰面积积分计算得出纯化后获得的目标加合物纯度可达95%以上。
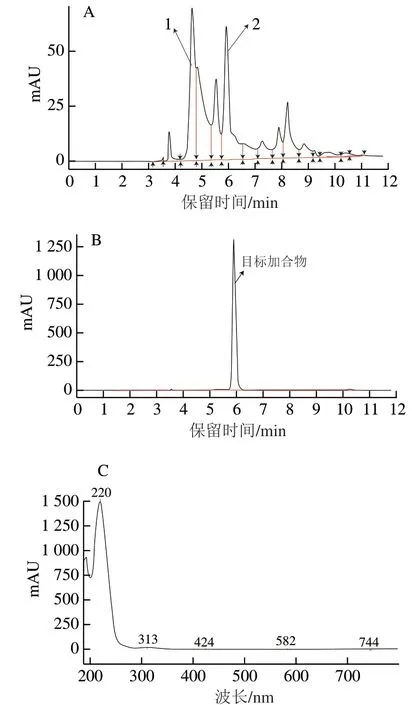
图 1 丙烯醛与丙氨酸反应产物(A)、纯化后目标产物(B)的HPLC图及纯化后目标产物的全波长扫描图(C)Fig. 1 HPLC chromatogram of the products of reaction between acrolein and alanine (A), and HPLC chromatogram (B) and fullwavelength spectrum (C) of the purified product
2.3 目标加合物的结构鉴定
纯化后的目标产物经高分辨质谱法检测结果如 图2所示。该物质相对分子质量为183.0823,分子式为C9H13NO3。
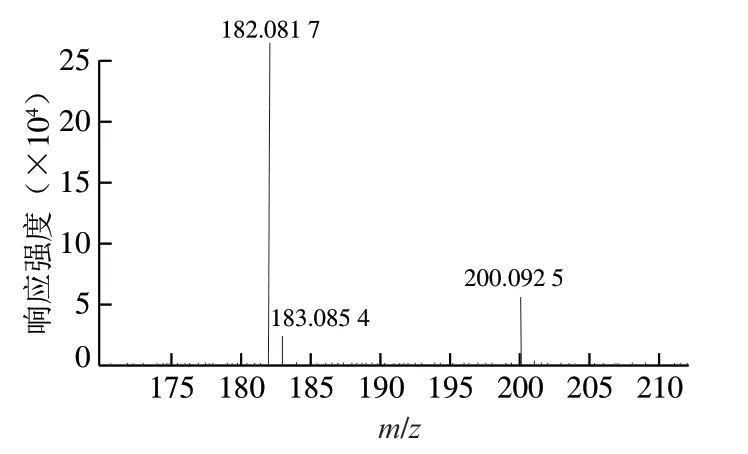
图 2 目标加合物的高分辨质谱图Fig. 2 High resolution mass spectrum of the purified adduct
纯化后的目标加合物经LC-MS分析所得的一级、二级质谱如图3所示,从一级质谱图可以看到明显的 [M+H]+、[M+Na]+、[M+K]+峰(图3A),再次确定了加合物相对分子质量为183,且二级质谱图中脱羧峰 [M-45]+(图3B)的存在以及较少的碎片离子峰表明目标加合物中仍存在一个完整的羧基,化合物结构相对稳定。
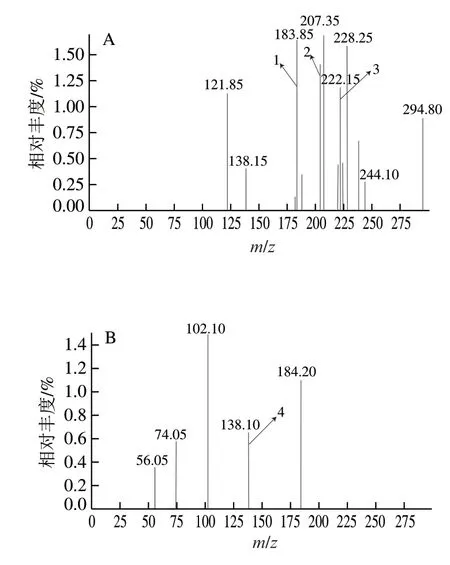
图 3 正离子模式下纯化产物的一级质谱(A)和目标产物 (MW= 183)的二级质谱(B)Fig. 3 Primary (A) and secondary (B) mass spectra of the purified product (with molecular mass of 183) in positive ion mode

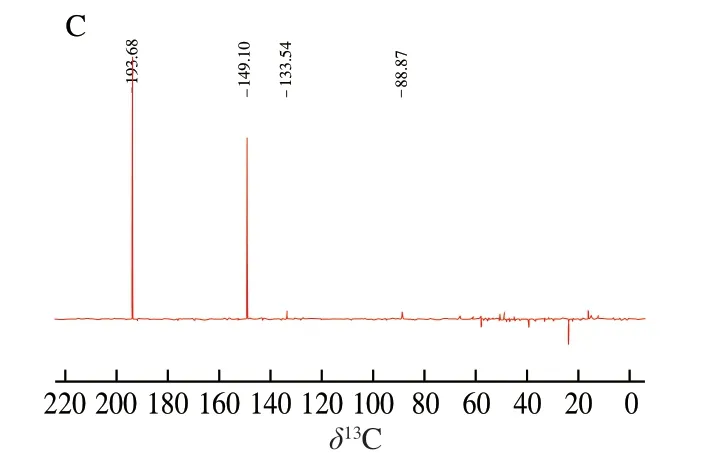
图 4 目标加合物的1H NMR(A)、13C NMR(B)、 Dept-135 NMR(C)图谱Fig. 4 1H-NMR spectrum (A), 13C NMR spectrum (B), and Dept-135 spectrum (C) of the adduct
目标加合物的13C NMR、1H NMR图谱如图4所示,根据13C NMR和Dept-135 NMR分析可得:δ193.69(—CHO),δ149.11、δ133.54(环内—CH=C—),δ45.46 (环内—N—CH2—C—),δ48.87(环内—N—CH2—CH2—),δ23.8(环内—CH2—C—),δ173.64(-COOH)。 根据1H NMR分析可得:δ9.45s(-CHO)、δ7.32m(环内 —CH=C—)、δ4.79(D2O)、δ1.57d(—CH3)。Zhu Qin等[13]探讨了含有不同亲核基团的丙烯醛清除剂对丙烯醛的清除作用以及其可能的反应机理,结合本研究结果推测该加合物的结构应为如图5所示,并推测出其反应机理:丙氨酸的氨基端是良好的亲核位点,在常温或者加热条件下极易与丙烯醛发生加成反应(先迈克尔加成再羟醛缩合)生成结构稳定的环状化合物。

图 5 目标加合物的形成机理Fig. 5 Formation mechanism of the adduct
2.4 加合物的细胞毒性
鉴于丙烯醛广泛存在于各种热加工食物中,而丙氨酸也是食品中含量较高的游离氨基酸。上述研究表明,丙氨酸可通过与丙烯醛形成加合物而清除丙烯醛,但加合物的毒性未知。
本课题组前期研究表明,蛋白质在消化过程中会降低一些羰基化合物对于Caco-2细胞的毒性,其中的原因可能与消化过程中释放的氨基酸有关[20]。胃是人消化系统的主要器官,也是营养物质吸收的核心器官。本研究选取人正常胃上皮细胞对丙烯醛和加合物的毒性进行探索。结果表明,丙烯醛和加合物的细胞毒性存在显著差异(图6)。GES-1细胞活力随着丙烯醛浓度的增加急剧降低,在丙烯醛浓度达到0.06 mmol/L时细胞的存活率仅为38.9%(24 h)、32.2%(48 h),且随着浓度的增加细胞的存活率基本上没有发生改变,说明在浓度达到0.06 mmol/L甚至更高时,细胞已经基本死亡,丙烯醛的毒性具有很强的剂量依赖性。由图6可知,加合物浓度高达2 mmol/L时,24 h后GES-1细胞的存活率依然保持在60%以上,毒性明显低于丙烯醛的毒性。但延长培养时间至48 h后,增加加合物浓度开始显现出细胞毒性,1 mmol/L时细胞存活率出现明显降低,但细胞存活率依然保持40%以上。综上所述,在实验设置的浓度范围内,丙烯醛对GES-1细胞生长有较大的抑制作用,较低浓度的丙烯醛就可导致细胞存活率快速下降,而加合物在低浓度时对GES-1细胞生长没有抑制作用,但高浓度、较长时间(48 h)处理会抑制GES-1细胞生长。
IC50也说明了两者的细胞毒性差异。培养24 h和48 h后,丙烯醛的IC50分别是0.058、0.067 mmol/L,而加合物的IC50分别为3.286、0.869 mmol/L。培养24 h和48 h后加合物的IC50分别为丙烯醛的56.7、12.9 倍,说明加合物的形成大大降低了丙烯醛的细胞毒性。孵育时间对丙烯醛的毒性影响不大,但延长孵育时间显著增加了加合物的细胞毒性(IC50下降了74%),推测可能是加合物被吸收后结构发生了转化,形成了毒性高于加合物的物质。 Yin Zhao等[31]分离纯化得到双半胱氨酸-丙烯醛加合物,在没有半胱氨酸共同孵育的情况下,该加合物转变成为单半胱氨酸,后者表现出更强的毒性作用。丙烯醛-丙氨酸加合物是否也发生类似转化需进一步研究。

图 6 丙烯醛(A)、加合物(B)孵育GES-1细胞24、48 h后细胞存活率Fig. 6 Viability of GES-1 cells after incubation with acrolein (A) and the adduct (B) for 24 and 48 hours
3 结 论
本研究制备并分离纯化出了一种丙氨酸-丙烯醛加合物。经HPLC检测该加合物最大吸收波长为220 nm,经分离 纯化后,确定该加合物的相对分子质量为183.0823,结构为一分子丙氨酸与两分子丙烯醛先经过迈克尔加成反应再通过羟醛缩合生成一个含氮六元环的稳定结构。加合物的形成大大降低了丙烯醛的细胞毒性,以加合物和丙烯醛孵育GES-1细胞24 h和48 h后,加合物的IC50分别是丙烯醛的56.7、12.9 倍,说明丙氨酸可作为丙烯醛的清除剂。但是,随着加合物孵育时间的延长,高剂量加合物的细胞毒性增加,其机理有待进一步研究。
