Ag2S@BSA存储液对纯钛表面成骨细胞行为的影响
2021-06-03汤泽华朱文卿
汤泽华,朱文卿,邱 憬
南京医科大学附属口腔医院种植科,江苏省口腔疾病研究重点实验室,江苏省口腔转化医学工程研究中心,江苏 南京 210029
纯钛具有优异的理化性能、良好的生物相容性及骨整合潜能,是口腔种植体最常用的材料之一。钛表面的理化特性决定了能否快速建立牢固的骨结合,国内外学者已经对钛种植体的表面处理进行了诸多尝试,以期提高成骨速度,增加骨结合强度[1-4]。已有文献报道,纯钛表面和修饰改性钛表面均存在时间依赖的生物活性老化现象[5]。课题组前期研究发现,纯钛表面的二氧化钛表层会吸附空气中的碳氢化合物形成碳累积,且碳累积量与钛表面亲水性呈显著的负相关性[6]。老化钛表面生物相容性的降低可能与表面亲水性的减弱有关,新制备的钛表面具有超亲水性,随着时间的延长逐渐转变为疏水性,成骨细胞黏附、扩散、增殖和碱性磷酸酶活性均呈时间依赖性降低[7-8]。动物实验表明,在早期愈合阶段,存放4 周后植入的钛种植体周围骨覆盖率不足新鲜表面的50%[9]。
为了延缓钛种植体表面的生物活性老化,提高钛表面的骨结合效率,钛种植体存储媒介的优化已成为研究热点。国内外研究已提出了多种抗老化方法,如紫外光功能化、盐溶液浸泡、等离子体处理、低真空存储等[10-11]。其中,盐溶液最为方便、经济。有文献报道生理盐水存储可以减少钛表面碳累积,改善钛表面的亲水性,促进成骨细胞的黏附、扩散和增殖,提高Ⅰ型胶原表达和钙沉积水平[12]。临床中已经运用生理盐水进行种植体存储,如ITI⁃Slactive 亲水性种植体。但在种植区骨量不足或骨质条件差的情况下,开发具有更强骨诱导活性的种植体存储液势在必行。
近年来,蛋白包裹的近红外硫化银(Ag2S)量子点因其良好的生物相容性及在生物介质中良好的分散性被广泛应用于生物成像领域[13]。有学者以牛血清白蛋白(boviaue serum albumin,BSA)为稳定剂,在水溶液中制备纳米银材料,可形成稳定的分散体,在纳摩尔范围内产生最佳抗菌活性,且远低于体外测定的成骨细胞毒性浓度,合成的纳米银颗粒可作为生物材料或药物产品的添加剂,分散在水溶液中,或涂覆于不同材料表面[14]。Zhou等[15]研究发现,包裹纳米银颗粒的丝纤蛋白基涂层具有良好的蛋白吸附性、亲水性和持久的抗菌性能。体外研究表明,该涂层不仅能够促进细胞附着、扩散和增殖,还能增强碱性磷酸酶表达、胶原分泌和矿化。体内研究显示,具有骨架结构的涂层显著改善了新生骨的生成以及软组织结合,有助于形成快速而持久的骨整合。由此推测蛋白包裹的Ag2S水溶液可用于钛种植体的储存,为开发新的种植体存储液提供不同的思路。本研究制备一种BSA包裹的Ag2S 种植体存储液,评估Ag2S@BSA 存储液对钛表面特性和成骨细胞生物学行为的影响。
1 材料和方法
1.1 材料
商用纯钛(99.5%,宝鸡钛业),砂纸(天津南景),氯化钠、乙酸银、硫化钠、氢氧化钠(分析纯,上海国药),BSA(南京生兴生物),扫描电子显微镜(MAIA3 RISE,Tescan 公司,捷克),X 射线能谱仪(ULTIM EXTREME,Oxford公司,英国),标准型光学接触角仪(SL200B,科诺公司,美国),小鼠MC3T3⁃E1细胞系(上海中科院细胞库),α⁃MEM、FBS、青⁃链霉素双抗、胰酶(Gibco公司,美国),鬼笔环肽(Cyto⁃skeleton 公司,美国),DAPI、CCK⁃8、RIPA 裂解液(上海碧云天),BCA试剂盒(南京凯基生物),碱性磷酸酶测试盒(南京建成),细胞恒温培养箱(Thermo公司,美国),多功能酶标仪(Spectramax 190,MD公司,美国),激光共聚焦显微镜(CLSM710,Zeiss公司,德国),化学发光凝胶成像系统(上海天能5200)。
1.2 方法
1.2.1 存储液及试件制备
存储液的制备:Ag2S@BSA 存储液的制备:定量称取乙酸银、硫化钠和BSA,双蒸水依次溶解配制为0.01 mol/L乙酸银溶液、0.1 mol/L硫化钠溶液和20 g/L BSA溶液。将乙酸银溶液与BSA溶液以适量体积混合,所得混合液调节pH 至碱性后与硫化钠溶液以适量体积混合得到Ag2S@BSA存储液。生理盐水存储液制备:定量称取氯化钠粉末,双蒸水稀释为0.9%的氯化钠溶液。BSA 存储液制备:定量称取BSA粉末,双蒸水稀释为5 g/L的BSA溶液。
试件制备:纯钛片经砂纸打磨抛光,超声清洗并干燥后备用。将纯钛试件随机分为4 组,分别密闭保存于空气(Air)、生理盐水(Saline)、BSA 溶液、Ag2S@BSA 溶液中2 周后观察钛片表面特性及成骨细胞的生物学行为。
1.2.2 钛表面特性分析
4组钛片在不同介质中保存2周后,晾干后使用扫描电镜(scanning electron microscope,SEM)观察试件的表面微形貌,X 线能谱仪(energy dispersive spectrometer,EDS)分析4 种介质中存储2 周后的试件表面元素分布情况。随机选取4种介质中存储2周后的试件各3 枚,接触角仪测量钛片的接触角及表面能以评价各组试件的表面亲水性。
1.2.3 细胞培养
体外复苏MC3T3⁃E1 成骨细胞,加入α⁃MEM 培养基(含10%胎牛血清、1%青⁃链霉素),于细胞恒温培养箱(37 ℃、95% 相对湿度、5% CO2)内静置培养。每3 d换液,细胞密度达80%后1∶4传代。
1.2.4 细胞黏附观察
选用直径5 mm、厚1 mm的纯钛片打磨抛光、超声清洗后置于96 孔板中,分别以空气、生理盐水、BSA 溶液、Ag2S@BSA 溶液密闭存储2 周,弃存储液后用磷酸盐缓冲液(phosphate buffer saline,PBS)漂洗3 遍,将MC3T3⁃E1 细胞(5×103个/孔)接种于4 组材料表面孵育8 h,4%多聚甲醛4 ℃固定过夜,鬼笔环肽室温下避光染色30 min,DAPI 室温下避光染色2 min。激光共聚焦显微镜下随机选取视野观察各组试件表面细胞黏附形态。
1.2.5 CCK⁃8法检测细胞增殖活性
每组各选用3枚纯钛片置于96孔板中,分别以4 种介质密闭存储2 周,弃存储液后用PBS 漂洗3 遍,将MC3T3⁃E1 细胞(2×103个/孔)接种于4组试件表面。培养1、3、6 d后,加入200 μL新鲜配制的CCK⁃8 液37 ℃孵育2 h,多功能酶标仪检测各孔在波长450 nm下的吸光度。
1.2.6 蛋白印迹法(Western blot)检测成骨相关蛋白表达
将4 组钛片置于6 孔板中,在4 种条件下保存2 周后用PBS 漂洗3 遍,将MC3T3⁃E1 细胞以2×105个/孔的密度接种于4组钛片表面培养7 d后,提取细胞总蛋白。以GAPDH 为内参,Western blot 检测成骨分化相关蛋白骨桥蛋白(osteopontin,OPN)、锌指结构转录因子(osterix,OSX)、骨钙蛋白(osteo⁃calcin,OCN)的表达水平,Photoshop 软件测定蛋白条带灰度值,计算蛋白相对表达水平。
1.2.7 碱性磷酸酶(alkaline phosphatase,ALP)活性检测
将4 组钛片置于6 孔板中,分别以不同介质保存2 周,弃存储液后用PBS 漂洗3 遍,将MC3T3⁃E1细胞以2×105个/孔的密度接种于4组钛片表面培养7 d后,RIPA冰上裂解30 min,收集裂解液离心后取上清,采用BCA 试剂盒检测蛋白浓度,碱性磷酸酶测试盒测定ALP活性。
1.3 统计学方法
采用SPSS 22.0 统计软件进行分析,数据以均数±标准差()表示,对亲水性、细胞增殖、ALP活性和蛋白相对表达数据进行方差齐性检验,显示方差齐,进行单因素方差分析和SNK 多重比较,P<0.05为差异有统计学意义。
2 结果
2.1 表面微形貌
扫描电镜观察纯钛试件在4种介质中存储2周后的表面形貌见图1。低倍镜下观察4 组试件表面平坦,均可见整齐的机械划痕。高倍镜下生理盐水组钛表面可见散在分布的晶体,Ag2S@BSA 组钛表面均匀分布纳米级颗粒。该结果表明,钛表面经4种介质存储2 周后,表面微形貌无明显改变,Ag2S@BSA 溶液浸泡后可形成大小均一的纳米级颗粒吸附于钛片表面。

图1 纯钛试件在不同介质中存储2周后的扫描电镜图像Figure 1 SEM images of titanium specimens stored in different media for 2 weeks
2.2 表面元素分析
4组纯钛试件表面元素的EDS面分析结果如图2 所示。各组试件表面均含有钛、氧、碳元素,生理盐水组可见散在重叠分布的钠、氯元素,表明钛片表面经生理盐水浸泡后散在分布氯化钠晶体。BSA组表面相比空气组和生理盐水组碳元素和氧元素的分布更均匀密集,提示以碳元素和氧元素为主要组成元素的BSA 均匀吸附于钛片表面。Ag2S@BSA组可见与颗粒重叠分布的银元素和硫元素,提示含有Ag2S的纳米颗粒形成并均匀吸附于钛片表面。

图2 纯钛试件在不同介质中存储2周后的EDS面分析图像(×10 000)Figure 2 EDS mapping images of titanium surfaces stored in different media for 2 weeks(×10 000)
2.3 接触角和表面能
4组纯钛试件的接触角和表面能测量结果见图3。生理盐水组和BSA 组与空气组相比接触角减小,表面能增大,生理盐水组和BSA 组间无统计学差异。Ag2S@BSA 组与其余3 组相比接触角明显减小,表面能明显增大,提示钛表面的亲水性得到了更好的留存。

图3 纯钛试件在不同介质中存储2周后的接触角和表面能Figure 3 Contact angle and surface energy of titanium specimens stored in different media for 2 weeks
2.4 细胞黏附观察
4组试件表面接种MC3T3⁃E1细胞培养8 h后的黏附形态见图4。激光共聚焦显微镜观察显示,空气组黏附细胞较少,形态较为缩窄,生理盐水组较空气组铺展稍大,BSA组较空气组和生理盐水组黏附细胞铺展更为充分,Ag2S@BSA 组黏附细胞数量最多,铺展充分,细胞伪足多而长。结果表明Ag2S@BSA组促进MC3T3⁃E1细胞黏附的作用最明显。

图4 四种介质存储后的钛表面接种成骨细胞孵育8 h后的细胞黏附形态(×200)Figure 4 Adhesion morphology of osteoblasts cultured for 8 hours on titanium surfaces stored in four media(×200)
2.5 细胞增殖活性
4 组试件表面培养MC3T3⁃E1 细胞的增殖活性如图5 所示。第1、3 天,各组吸光度值无明显差异(P>0.05)。培养6 d 后,生理盐水组、BSA 组和Ag2S@BSA 组与空气组相比吸光度值增高(P<0.05),其中,Ag2S@BSA组吸光度值较生理盐水组更高(P<0.05),与BSA 组之间无显著差异(P>0.05)。该结果提示,与空气组相比,经3种液体存储后的钛表面均能促进MC3T3⁃E1 细胞的增殖活性,其中Ag2S@BSA组的促进作用相对明显。

图5 四种介质存储后的钛表面接种成骨细胞1、3、6 d后的细胞增殖活性结果Figure 5 Proliferation of osteoblasts cultured for 1,3,and 6 days on titanium surfaces stored in four media
2.6 成骨相关蛋白表达
4组钛片表面接种MC3T3⁃E1细胞7 d后表达成骨相关蛋白的Western blot 条带和灰度值比较结果见图6。各组之间MC3T3⁃E1 细胞成骨相关蛋白表达水平均有统计学差异(P<0.05),以GAPDH 为内参蛋白,OPN、OSX、OCN 的相对表达水平由高到低依次为Ag2S@BSA组>BSA组>生理盐水组>空气组。该结果表明,经液体存储后的钛片表面增强了MC3T3⁃E1细胞的成骨分化活性,其中Ag2S@BSA组的促进作用最明显。
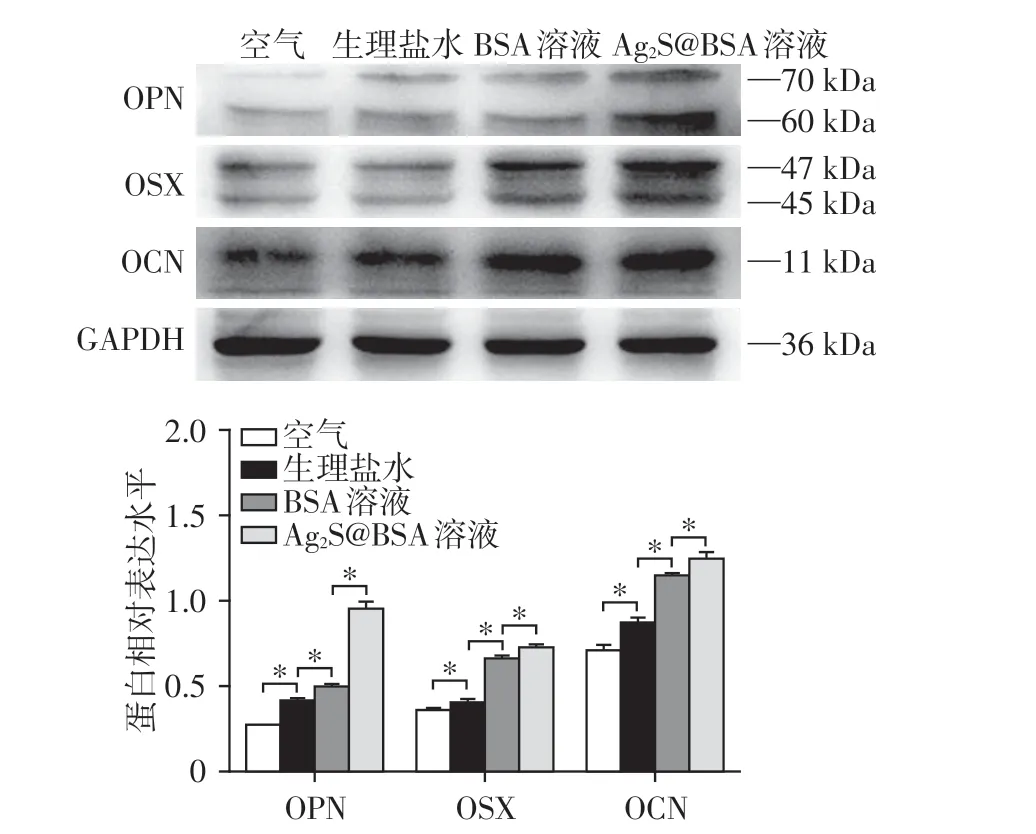
图6 Western blot检测4种介质存储后的钛表面接种成骨细胞7 d后的成骨相关蛋白表达Figure 6 Osteogenesis⁃related protein expression in osteo⁃blasts cultured for 7 days on titanium surfaces stored in four media Western blotting
2.7 ALP活性
4组试件表面接种MC3T3⁃E1细胞7 d后的ALP活性检测结果见图7。相比空气组,经3种液体保存后的钛片表面成骨细胞ALP 活性均有不同程度升高,其中BSA 组和Ag2S@BSA 组ALP 的表达水平显著增强。结果提示,经液体存储后的钛片表面MC3T3⁃E1 细胞成骨分化活性增强,且BSA 组和Ag2S@BSA组更为显著。
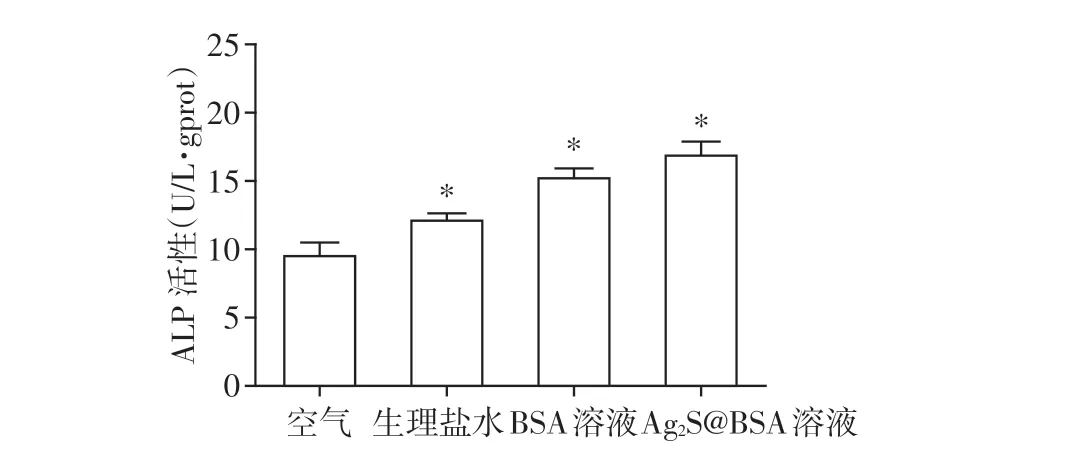
图7 4种介质存储后的钛表面接种成骨细胞7 d后的ALP活性Figure 7 The ALP activity of osteoblasts incubated for 7 days on titanium specimens stored in four me⁃dia
3 讨论
近年来我国种植体植入数量逐年增长,成品纯钛种植体通常保存在封闭的无菌包装盒或生理盐水中。纯钛表面暴露于空气中可快速形成二氧化钛层并吸附碳氢化合物,生成一层致密的氧化膜从而降低材料的亲水性[16]。Hori 等[17]研究发现,纯钛、酸蚀和喷砂钛表面随着贮存时间的延长均存在生物老化过程,表面亲水性逐渐转为疏水性,且3种表面的蛋白吸附量与亲水性成正相关。因此,如何改进钛种植体存储方法,提高钛表面亲水性亟待研究。
为探索新型的种植体存储媒介,本实验将BSA包裹的Ag2S 纳米颗粒用于钛表面存储,以空气、生理盐水、BSA溶液为对照组,研究4种存储介质对纯钛表面特性及成骨细胞生物学行为的影响。打磨抛光的纯钛片置于4种介质中存储2周后于扫描电镜下观察,4组钛片表面均呈现整齐的机械划痕,表明不同存储介质保存后不会影响钛片表面形貌。高倍镜下可见Ag2S@BSA组钛表面均匀吸附大小均一的纳米级颗粒,而BSA组未见明显变化,提示BSA包裹Ag2S 后聚集成核,体积增大。对比4 组试件的接触角发现,经过不同溶液存储后的钛表面亲水性与空气组相比均有不同程度的提升,其中Ag2S@BSA 组接触角最小,表面能最大。分析其原因可能是液体存储隔绝了钛表面的二氧化钛层与空气的接触,减少钛表面的碳累积,其中Ag2S@BSA组形成的纳米级颗粒在钛片表面均匀密集地吸附,使钛表面的亲水性得到更好地留存。
在不同介质存储2 周后的钛表面培养MC3T3⁃E1细胞后的CEK⁃8结果显示,经过不同溶液存储后的钛表面成骨细胞的增殖活性较空气组均有不同程度的改善,其中Ag2S@BSA 组相对更佳。提示BSA 包裹Ag2S以纳米颗粒的形式吸附于钛片表面,限制了其活动性,消除了Ag2S的细胞毒副作用。表面修饰剂是硫化物纳米粒子合成过程中控制粒径大小和分布的关键,BSA因其良好的生物相容性和酶稳定性被广泛应用为稳定剂和修饰剂[18]。BSA 包裹后的金属硫化物生物毒性降低,表面活性增强,且具有良好的尺寸稳定性和热稳定性[19]。有研究证明,BSA、腐殖质、藻酸盐等天然有机质包覆可以通过稳定Ag2S纳米颗粒、减少其与细胞相互作用造成的细胞膜损伤程度来减轻纳米材料的毒性,其中BSA包覆层最厚,对细胞膜损伤程度最小[20]。
激光共聚焦、ALP 活性和Western blot 结果表明,Ag2S@BSA 组成骨细胞的黏附和成骨分化活性显著提升,可能与钛表面亲水性的增加和蛋白吸附有关[21]。Calciolari 等[22]研究发现,亲水性钛表面通过调控特异性信号通路、血管内皮生长因子和有丝分裂原活化蛋白激酶等途径促进血管生成、骨矿化和骨重建。动物实验研究发现,亲水性种植体早期成骨反应增强,炎症反应降低[23]。这归因于血清中的生物活性因子在亲水性钛表面快速扩散,通过调节吸附蛋白量、构象和结合强度促进细胞黏附、增殖和分化[24]。蛋白吸附在骨整合过程中至关重要,种植体在植入后几毫秒内血液即可快速扩散,蛋白吸附于钛表面形成生物活性修饰,进而影响后续的细胞黏附、增殖和扩散[25]。选用血浆蛋白对不同形貌和润湿性的钛种植体进行吸附研究发现,亲水性表面促进了蛋白质的选择性吸附,增强了细胞黏附、增殖等生物学行为[26]。
综上所述,本研究以BSA 为稳定剂制备包裹Ag2S 的纳米颗粒用于纯钛表面的存储,结果表明,Ag2S@BSA 溶液存储后的纯钛表面亲水性和表面能增加,对成骨细胞无明显毒性作用,且能促进其黏附、增殖和成骨分化。本研究结果可为新型种植体存储液的研发提供新的思路,后续研究将对其最优浓度和银离子释放产生的抗菌性能进行更深入的探索。
